Спектральная область исследования биополимеров методом электронной спектроскопии
Одна из особенностей спектроскопии биополимеров состоит в необходимости работать с растворами, поскольку изучение таких больших молекул в газовой фазе невозможно. Спектральные исследования в твердой фазе осложняются дихроичными эффектами. Для подавляющего большинства белков и нуклеиновых кислот наиболее пригодными для имитации условий in vivo растворителями являются водные буферные растворы при рН» 7,0, содержащие достаточные количества электролитов (например, ~ 0,15 М NaCl). Использование воды в качестве растворителя автоматически ограничивает спектральные измерения областью длин волн, больших чем 170 нм. Ниже этого предельного значения поглощение даже очень тонких (~ 1 мкм) водных пленок столь велико, что регистрация на его фоне вклада от макромолекул практически невозможна. Из-за высокой полярности воды электронные полосы поглощения оказываются заметно шире, чем для большинства других растворителей.
Другая трудность связана с узостью температурного интервала, в котором белки и нуклеиновые кислоты сохраняются в нативном виде, т.е. не денатурируют. Кроме того, и сама вода существует в жидком состоянии в достаточно ограниченном диапазоне 0 – 1000С. Для белков и нуклеиновых кислот это не столь важно (денатурация наступает в еще более узком диапазоне), но для модельных соединений и экспериментов невозможность проводить измерения ниже 0°С и выше 100°С оказывается подчас весьма нежелательным обстоятельством.
ПОГЛОЩЕНИЕ БЕЛКОВ
Хромофоры белковых молекул удобно разделить на три класса - это:
· пептидные группы,
· боковые группы аминокислотных остатков,
· простетические группы.
Для изучения свойств пептидных хромофоров можно использовать модельные соединения, такие, как формамид или N -метил ацетамид:
Как известно, электроны пептидной группы в известной мере делокализованы по трем атомам: азоту, углероду и кислороду. Среди наблюдаемых в пептидной группе переходов наименьшую энергию имеет n à p *-переход. Как и в случае формальдегида, n -электрон локализован на атоме кислорода, и этот переход запрещен по симметрии.
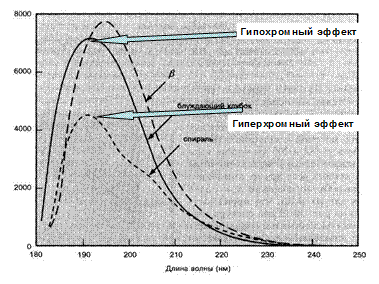
Рис. 2.3.1
Спектр поглощения поли-L-лизина в водном растворе. I - беспорядочный клубок, рН 6.0, 250С; II - a-спираль, рН 10.8, 250С; III - b-слой, рН 10.8, 520С. [К. Rosenheck, P. Doty, Ргос. Natl. Acad. Sci. USA, 47, 1775 (1961).]
Полоса n à p * поглощения в пептидах обычно наблюдается при 210-220 нм и является очень слабой (e max» 100). В качестве примера на рис. 2.3.1 приведены спектры поглощения разных структурных форм поли-L-лизина. Только в случае a -спиральной конформации полимера n à p * - переход очень слабо проявляется в виде небольшого плеча с l» 220 нм на фоне гораздо более сильной полосы с максимумом вблизи 190 нм. Эта интенсивная полоса, главная в доступной для измерений области, порождается p à p *-переходом (e max» 7000).
При еще более высоких частотах (энергиях) можно наблюдать третий переход с l max около 175 нм. Предположительно, это n à s* -переход.
ПОГЛОЩЕНИЕ аминокислотных остатков
Для боковых групп таких аминокислот, как Asp, Glu, Asn, Gln, Arg и His, наблюдаются электронные переходы, полосы которых маскируются рассмотренным выше интенсивным поглощением пептидной группы. Поэтому зарегистрировать эти переходы в белках или полипептидах практически нельзя. С одной стороны они уступают по интенсивности n à p *-переходу пептидной группы, с другой - число соответствующих боковых радикалов обычно меньше, чем число пептидных групп. Таким образом, интерес могут представлять только те хромофору белковых молекул, которые проявляются при длинах волн больше 230 нм, где вклад в поглощение пептидных групп пренебрежимо мал. Такими свойствами обладают Phe, Туг и Тгр, а также гистидиновый фрагмент и дисульфидный мостик цистина. Спектры поглощения этих трех ароматических аминокислот при нейтральных рН представлены на рис. 2.3.2.
Использование логарифмической шкалы обусловлено большими различиями в экстинкции. Поглощение триптофана значительно сильнее, чем двух других аминокислот. Однако он редко присутствует в белках в больших количествах, поэтому вклад тирозина в поглощение белка также оказывается весьма значимым.
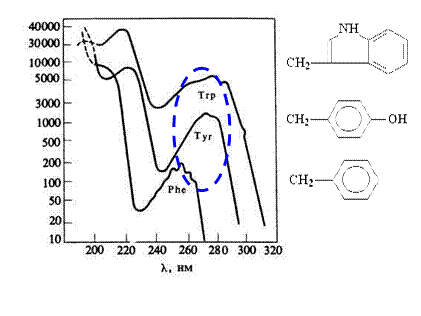
Рис. 2.3.2
Спектры поглощения ароматических аминокислот.
По оси ординат отложены значения молярного коэффициента
экстинкции в логарифмической шкале
Поглощение фенилаланина гораздо меньше (e около200 М-1×см-1) при 250 нм. По этой причине обнаружить его присутствие в белках, содержащих другие ароматические аминокислоты, оптическими методами почти невозможно. Поглощение фенилаланина при 250 нм обусловлено запрещенным по симметрии p à p *-переходом. Ту же природу имеет полоса при 256 нм в бензоле (e max» 400). В тирозине локальная симметрия оказывается значительно ниже, а наблюдаемый при 274 нм переход - интенсивнее (e max» 1400). Аналогичный переход наблюдается в молекуле фенола при 271 нм (e max» 2000). Спектр индольной боковой группы триптофана имеет сложную природу. В достаточно узком интервале длин волн (от 240 до 290 нм) располагаются три или более электронных перехода.
Изменение рН мало влияет на спектры поглощения изолированных пептидных хромофоров. В противоположность этому тирозин и триптофан весьма чувствительны к рН, так как места протонирования этих молекул непосредственно связаны с системой электронного сопряжения хромофоров. Наиболее ярко это проявляется в спектральном сдвиге у тирозина, когда отщепляется протон ОН-группы (рКа» 10,9) Этот сдвиг можно надежно зарегистрировать, просто измеряя поглощение при 295 нм. Записывая разностные спектры при этой длине волны, можно с высокой точностью следить за ходом титрованием остатков тирозина в белках. В качестве примера на рис. 2.3.3 приведены результаты спектрофотометрического титрования панкреатической РНКазы быка. Участки, изображенные сплошной линией, отвечают данным, не зависящим от времени. Молекула РНКазы содержит шесть тирозиновых остатков. Представленные результаты показывают, что три из них титруются обратимо, причем их рКа равно 10,2, т.е. обычному значению. Три других не титруются и при более высоких рН, вплоть до денатурации белка, что приводит к гистерезису, наблюдаемому при обратном титровании.
Влияние рН на поглощение триптофана не столь существенно, чтобы использовать его для аналогичных измерений. К тому же значения рКа триптофана лежат вне области значений рН, при которых большинство белков сохраняет свою нативность.
Измерение поглощения цистеинов в белках затруднено тем, что наиболее длинноволновый интенсивный переход (l max» 230 нм) приходится на область поглощения пептидной группы. Полосы поглощения дисульфидных мостиков (цистинов) лежат в более длинноволновой области, с l max около 250 и 270 нм, но их интенсивность слишком мала (e» 300), чтобы заметно сказываться на поглощении белка. Тем не менее, вклад этих переходов в оптическую активность белков весьма ощутим.
Поскольку некоторые из упомянутых боковых групп поглощают в той же области, что и пептидные группы, их присутствие иногда затрудняет спектральные исследования белков. Когда белок содержит лишь несколько сильно поглощающих остатков, становятся возможными однозначная идентификация и анализ различных компонентов спектра. Наличие большого количества ароматических остатков затрудняет подразделение спектра вблизи 200 нм на отдельные составляющие, которые отвечали бы боковым группам и пептидному остову.
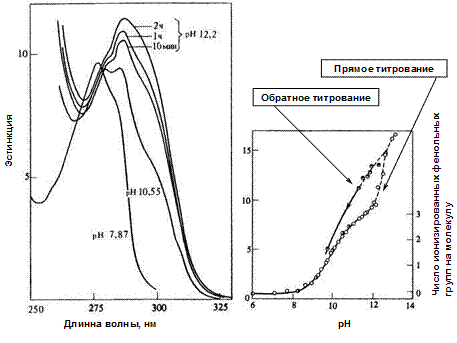
| А | Б |
Рис. 2.3.3
Спектрофотометрическое титрование панкреатической РНКазы быка.
А. Изменение спектра поглощения с изменением рН и со временем (при рН 12,2). При меньших значениях рН зависимость от времени отсутствует.
Б. Зависимость коэффициента экстинкции при 295 нм от рН.
хромофорные белки
Многие белки содержат группы, отличающиеся от обычных аминокислот. Часто, но не всегда, эти группы связаны ковалентными связями с полипептидной цепью. Вот некоторые примеры присоединенных групп: гликопротеины (сахара), гемпротеины (железосодержащие порфирины), флавопротеины (флавины), родопсин (ретиналь; витамин А). В последних трех случаях группа является хромоформом и вносит вклад в спектр поглощения в видимой или ближней УФ области.
Родопсин широко распространен в природе в позвоночных и беспозвоночных животных. Родопсин состоит из бесцветного белка (или гликопротеина), опсина, к которому ковалентно присоединена хромофорная оболочка (ретиналь). У млекопитающих изомер 11-цис-ретиналя присоединяется к e -аминогруппе лизиновой боковой цепи опсина при помощи протонированного основания Шиффа:
| 11- цис- ретиналь | Основание Шиффа |
Ретиналь — это пример линейных полиенов, которые мы рассмотрели ранее. Шесть сопряженных двойных связей альдегида содержат p -электроны. В результате сопряжения здесь наблюдается значительный батохромный сдвиг p à p* - перехода, что и обуславливает окраску этого хромофора.
Родопсины имеют интенсивные широкие полосы поглощения с максимумами, лежащими между 440 и 565 нм в зависимости от специфики хромофора и среды. Коровий родопсин поглощает при 500 нм (рис. 2.3.4) и имеет яркий красно-оранжевый цвет; животные, имеющие недостаточную пигментацию (многие альбиносы), проявляют эту красно-оранжевую окраску в зрачке. Длинноволновая полоса поглощения (p à p* переход) изолированного ретиналя в целом ряде органических растворителей находится в интервале между 366 и 377 нм, и это ожидаемая область для полиенов такой длины. Действительно, спектр родопсина после его конверсии светом (пунктирная кривая) очень похож на спектр ретиналя. Причина сдвига этой полосы к 500 нм или даже в более длиноволновую область в неосвещенном родопсине состоит в присутствии отрицательного заряда на опсине.
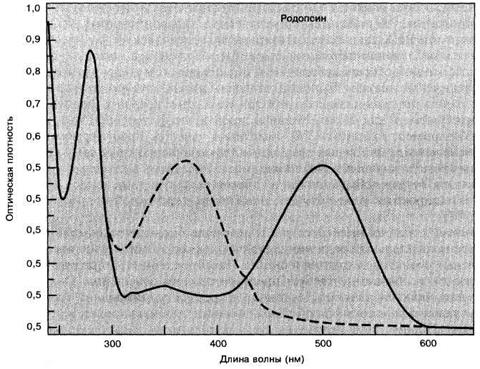
Рис. 2.3.4
Спектр поглощения коровьего родопсина в УФ и видимой областях. Очищенный родопсин был измерен дважды: сначала он был выделен из адаптированной к темноте коровьей сетчатки (сплошная кривая) и затем снова выделен из сетчатки после ее освещения (пунктирная кривая). (From M.L. Applebury, DM. Zuckerman, A.A. Lamola, and T.M. Jovin, 1974, Biochemistry 13: 3448. Copyright by the American Chemical Society
Были получены производные ретиналя с уменьшенным количеством двойных связей, присоедененных к опсину, и измерены их спектры поглощения. Это показало, какая часть системы p- электронов необходима для наблюдаемого сдвига.
Гемоглобин в красных клетках крови можно измерить спектрофотометрически при 541 или 577 нм (рис. 2.3.5), потому что другие компоненты содержимого клетки (белки, липиды, углеводороды, соли, вода и прочее) на этих длинах волн практически не поглощают.
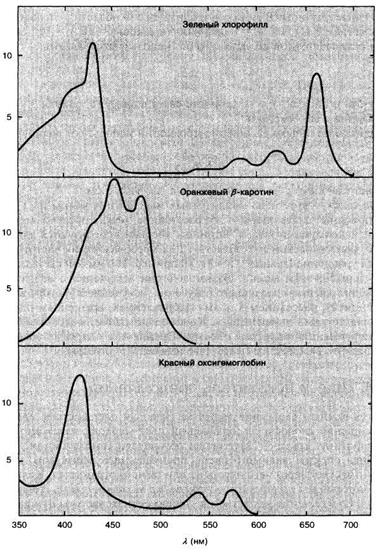
Рис. 2.3.5
Электронные спектры поглощения некоторых хромофорных белков
поглощение ПРОСТЕТИЧЕСКИХ ГРУПП в белках
Излучение могут поглощать содержащиеся в молекулах некоторых белков простетические группы (см. рис. 2.3.6). Так, например, гемы, флавины, пиридоксальфосфат и некоторые металлопротеиды обладают интенсивными полосами поглощения в ближней УФ- и видимой областях. По этим полосам, обычно весьма чувствительным к ближайшему окружению простетических групп, можно следить за их состоянием, например за окислением или оксигенацией. Такие хромофоры являются весьма полезными при исследовании многих ферментативных процессов.
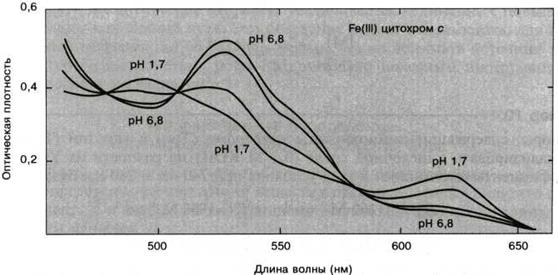
Рис. 2.3.6
Спектры поглощения цитохрома с (Fe3+) при различных значениях рН 1.7 – 6.8. Изобестические точки 477, 509 и 584 нм.
С другой стороны, присутствие в белках простетических групп создает и определенные трудности. Почти все хромофоры, которые поглощают в ближней УФ- или видимой областях, имеют столь же интенсивные переходы в интервале от 200 до 300 нм. Если такие хромофоры содержатся в белке в большом количестве, они могут сильно мешать исследованию собственно полипептида. Обойти эту трудность можно, используя апобелки, т.е. белки лишенные простетической группы. Однако при этом нужно быть уверенным, что подобная процедура не искажает структуру полипептидной цепи. Для этого редко бывает достаточно прямых оптических измерений. Если сумма спектров изолированной простетической группы и апобелка совпадает со спектром нативного холобелка, это можно принять как аргумент. Однако, как правило, подобной аддитивности не наблюдается по вполне очевидным причинам (здесь аддитивность скорее исключение из правила, чем правило). Даже в отсутствие конформационных изменений спектры как простетической групппы, так и белка изменяются под действием электронных взаимодействий.
Наличие простетической группы оказывается полезным лишь при условии, что она обладает достаточно большим коэффициентом молярной экстинкции, дабы быть заметной при типичных концентрациях белка. Последние во избежание агрегации должны быть меньше 2,5 мг × мл-1. Если простетические группы обладают e max = 103 - 104, то тем самым обеспечивается более чем достаточная экспериментальная чувствительность в широком диапазоне концентраций. В табл. 2.3.1 кратко суммированы спектральные свойства некоторых белков, содержащих наиболее распространенные простетические группы
Таблица 2.3.1
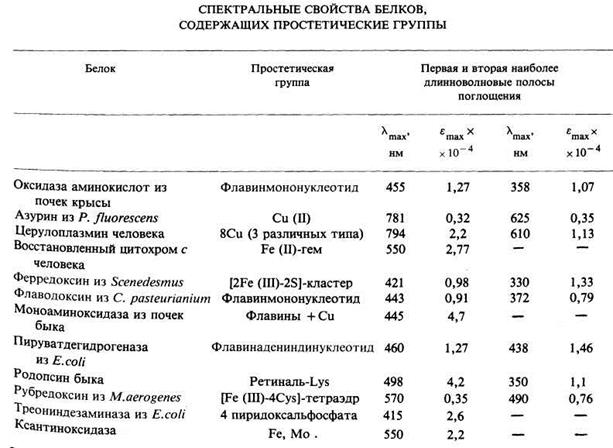
поглощение полипептидных цепей
Вклад амидных связей в спектры поглощения можно увидеть при сравнении спектров аминокислот и полипептидов. На сегодня общеизвестно, что для всех полипептидов наблюдается широкая полоса поглощения с максимумом при 192 нм, которая обусловлена наличием чередующихся амидных группировок. При этом, если сравнить, к примеру, интенсивность поглощения для гидрохлорида лизина и поли-L-лизин гидрохлорида в форме блуждающего клубка, то характерная для амидной связи полоса в поли-L-лизине по экстинкции в 8 раз превышает таковую для свободной аминокислоты. Все белки дают вклады полипептидного скелета в спектры поглощения в области около 190 нм (от 180 до 200 нм). Не следует, однако упускать из виду, что в это поглощение могут давать вклады и боковые цепи аминокислот, особенно ароматических.
Проявление вторичной структуры белков в УФ спектрах
Когда пептидные цепи формируются в упорядоченные структуры (например, спираль) возникает вторичная структура белка. Появление таких структур можно выявить методом УФ спектроскопии. Так, например, на рис. 2.3.1 показано влияние рН и температуры на вид спектра поли-L-лизина. При повышение величины рН (при постоянной температуре) количество положительных зарядов на боковых цепях лизина уменьшается. Это способствует укладке полипептидной цепи в более упорядоченную структуру (спираль). В УФ спектре такая перестройка вторичной структуры (от статистического клубка к спирали) проявляется гипохромным эффектом. Повышение температуры при постоянном рН преобразует спиральную структуру полипептида в b -структуру складчатого типа. Эта перестройка проявляется гиперхромным эффектом. Белки обычно содержат одновременно несколько элементов вторичной структуры в различных положениях пептидной цепи. Процесс денатурации уничтожает значительную часть этих вторичных структур, и как следствие мы имеем изменения в спектрах поглощения. Особенности поглощения, связанные с a-спиралью, b-складчатой структурой или произвольным скручиванием достаточно отчетливы, чтобы можно было использовать их для диагностических целей в случае природного белка, однако здесь более информативными могут быть спектры кругового дихроизма.
Количественный анализ белков методом УФ спектроскопии
Типичный белок, не содержащий простетических групп, имеет максимум поглощения в ближней УФ-области при l max = 280 нм, что обусловлено наличием ароматических аминокислот. Коэффициенты экстинкции триптофана и тирозина при этой длине волны составляют приблизительно 5700 и 1300 М-1×см-1 соответственно. В первом приближении можно считать, что экстинкция этих аминокислот не претерпевает значительных изменений при их включении в белковую цепь. Поскольку никакие другие остатки не дают заметного вклада в поглощение при 280 нм, коэффициент экстинкции белка можно определить, зная число остатков тирозина (n Туг) и триптофана (n Тгр). Оптическая плотность раствора с концентрацией 1 мг×мл-1 и толщиной слоя 1 см равна (5700 n Туг + 1300 n Тгр)/М, где М - молекулярная масса. Вычисленная таким способом оптическая плотность 14 выбранных наугад белков составила 1,1 ± 0,5. Таким образом, предполагая, что раствор любого белка с концентрацией 1 мг×мл-1 обладает оптической плотностью 1,0, можно (рискуя ошибиться вдвое), определить весовую концентрацию белка, измеряя его поглощение при 280 нм. Этот метод не приводит к разрушению образца, однако по своей чувствительности почти на порядок уступает колориметрическому тесту Лоури. Чувствительность прямых измерений поглощения можно увеличить, перейдя к длине волны 230 нм. Все остатки обладают в этой области молярной экстинкцией, примерно равной 300 (среднее от вклада, даваемого перекрывающимися полосами для боковых цепей и p à p *-полосы пептидной группы), так что оптическая плотность белкового раствора с концентрацией 1 мг×мл-1 составит А230 = 3. Однако многие из используемых растворителей также поглощают при этой длине волны, что существенно усложняет определение концентрации. Кроме того, нуклеиновые кислоты поглощают при 260 нм, что также осложняет анализ белков в присутствии НК.
УФ спектры Нуклеиновых кислот
Интенсивное поглощение всех нуклеиновых кислот в ближней УФ-области почти целиком обязано пуриновым и пиримидиновым основаниям. Сахарофосфатный остов РНК и ДНК дает незначительный вклад в спектр поглощения при длинах волн, превышающих 200 нм.
Спектры четырех нуклеозидов в воде при рН 7 выглядят, на первый взгляд, очень просто (рис. 2.3.7).
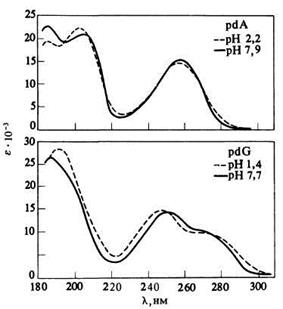
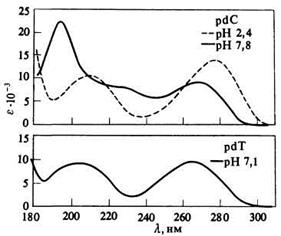
| А | Б |
Рис.2.3.7
Спектры поглощения четырех дезоксинуклеотидов как функция рН. Спектры рибонуклеотидов весьма близки к ним, за исключением спектра уридина (U), у которого lтах = 260, а не 268 нм, как для dT. [D.Voet, W.B.Gratzer, R.A.Cox, P.Doty, Biopolymers, 1, 193 (1963).]
Однако электронная структура пуринов и пиримидинов гораздо сложнее, чем белковых хромофорных групп. Основания имеют очень низкую симметрию и много несвязывающих электронов. Сопоставление со спектрами ряда более простых молекул показывает, что у всех оснований в области от 200 до 300 нм должно проявляться несколько разных n à p *- и p à p*-переходов. Кажущиеся простыми полосы поглощения аденина (A) и урацила (U) с l max = 260 нм, имеющие вид гауссовых кривых, в действительности порождаются более чем одним переходом. G и С имеют по две полосы. На самом деле они, вероятно, обладают большим числом неразрешенных полос.
Свободное основание, нуклеозид (основание, присоединенное к сахару), нуклеотид (основание, присоединенное к фосфату сахара) и денатурированный полинуклеотид все они имеют очень похожие спектры поглощения в этой области (см. табл. 2.3.2).
Таблица 2.3.2
Полосы поглощения нуклеотидов
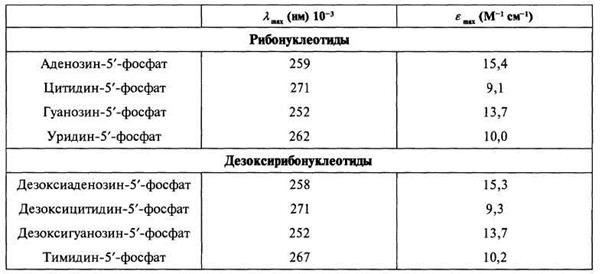
Спектры всех четырех нуклеозидов чувствительны к рН. Протонирование С и G приводит к значительному сдвигу поглощения в сторону больших длин волн (красное смещение). Депротонирование U или Т при щелочных рН также приводит к существенному красному смещению максимума поглощения. Протонирование А сопровождается гораздо меньшими спектральными изменениями. Все эти эффекты весьма полезны для определения степени ионизации отдельных составляющих нуклеиновых кислот, однако в полимерах они становятся более сложными из-за сильного электронного взаимодействия между основаниями. Присутствие фосфатных групп, по-видимому, не сказывается сколько-нибудь заметно на молярной экстинкции различных составляющих нуклеиновых кислот.
Энергия длинноволновых, достаточно интенсивных электронных переходов пяти наиболее распространенных оснований почти одинакова. Это служит серьезным препятствием для детального анализа электронных спектров ДНК и РНК. Полосы поглощения отдельных хромофоров типичной нуклеиновой кислоты сливаются и дают простую на вид полосу с l max» 260 нм (см. рис. 2.3.8).
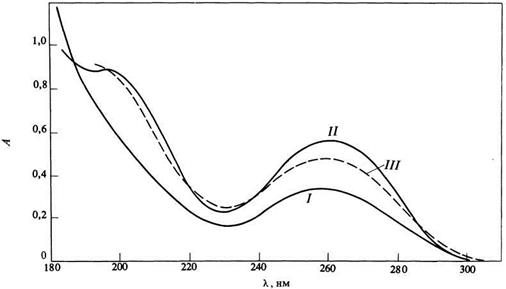
Рис. 2.3.8
Спектр поглощения ДНК как функция температуры. После расщепления ДНК ферментами в растворе должны присутствовать только мононуклеотиды и, возможно, небольшое количество коротких олигомеров. Спектр, измеренный при высокой температуре, очень близок к спектру препарата, обработанного ферментами. I - нативная ДНК, 25°С; II - препарат, обработанный ферментами; III - ДНК Rcoli, 82°С.
[D.Voet, W.B.Gratzer, R.A.Cox, P.Doty, Biopolymers, 1, 193 (1963).]
Свойства отдельных оснований оказываются весьма близкими, так что даже в отсутствие достаточно сильного взаимодействия между основаниями трудно представить полосу поглощения с l max = 260 нм для нуклеиновой кислоты в виде суммы четырех составляющих с определенными весами.
Средний коэффициент молярной экстинкции при 260 нм в расчете на моль нуклеозидов равен примерно 1,0 × 104.
В общем, поленуклеотиды и нуклеиновые кислоты поглощают меньше в расчете на нуклеотид, чем сумма составляющих их нуклеотидов. Таким образом, природная двухспиральная ДНК поглощает меньше на нуклеотид, чем денатурированная («расплавленная») нить ДНК, т.е. и здесь, как и в белках, наблюдается гипохромизм.
Рис. 2.3.9
Гиперхромный эффект при денатурации нуклеиновых кислот.
Гипо- и гиперхромизм полинуклеотидов или нуклеиновых кислот относительно нуклеотидов в первую очередь является следствием взаимодействий между соседними основаниями при их упорядоченном размещении в спиральном полимере. Изменения при денатурации в одиночных спиралях или при гидролизе мононуклеотидов легко измеряются (обычно они составляют 30 - 40%) и часто используются для наблюдения за кинетикой или термодинамикой процесса денатурации НК или определения температуры плавления вторичной структуры (см. рис. 2.3.10).
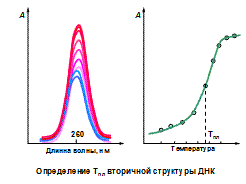
Рис. 2.3.10
Определение температуры плавления вторичной структуры ДНК методом электронной спектроскопии, основанном на гиперхромном эффекте.
Гипохромность полинуклеотидов или нуклеиновых кислот относительно мономерных нуклеотидов является следствием взаимодействий между соседними основаниями при их упорядоченном расположении в спиральной цепи полимера. Происхождение гипохромизма по своей природе электромагнитно. Оно включает взаимодействия между переходными дипольными моментами индивидуальных оснований и их соседей. Таким образом, оно зависит не только от внутренних переходных моментов каждого основания, которые для химически различных оснований отличаются по величине и направлению, но также от относительной ориентации взаимодействующих оснований. Упорядоченные основания поглощает слабее в расчете на нуклеотид, чем неупорядоченные. Стопка из двух оснований имеет немного меньшую оптическую плотность, чем удвоенная оптическая плотность одного основания; и так далее. Таким образом, пары контактирующих оснований в двойной спирали поглощают меньше, чем частично контактирующие основания в одиночной спирали, которые поглощают слабее, чем мононуклеотиды.






