

Скорость ферментативной реакции подчиняется закону действующих масс: F+S 2ó1FS→3F + P. 1- образование фермент-субстратного комплекса, 2- распад фермент – субстратного комплекса, 3 – распад фермент-субстратного комплекса с образованием продуктов реакции.
V1 = К1 [F]* [S]
V2=K2 * [FS]
V3 = K3 *[FS]
В момент равновесия скорость реакции образование FS равна сумме скорости его распада. V1=V2+V3. Из этих этапов наиболее важным и медленным является V3 так как она связана с образованием продуктов. По этой форму найти третью скорость невозможно так как фермент субстратный комплекс очень неустойчив в образовании. В связи с этим Михаэлис-Ментон преобразовал уравнение в котором присутствуют реально измеримые величины:

Кm – констатнта Михаэлиса. F0 – исходная концентрация фермента.
Физический смысл Кm: Кm = (К2+К3)/К1.
Уравнение М-М является универсальным оно показывает:
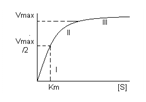
1. Зависимость скорости реакции от S. Эта зависимость выявляется при малых концентрациях зубстрата [S]<Km. Тогда в уравнении ею можно пренебречь: V3=(K3*[F0]*[S])/Km. При уменьшении концентрации субстрата скорость реакции прямомпрпорциональна этой концентрации, это соответствует первому участку графика.
2. Зависимость скорости от концентрации фермента, проявляется при высокой концентрации субстрата. S≥Km. V3=K3*(([F0]*[S])/[S])=K3[F0]=Vmax. При высокой концентрации субстрата скорость реакции определяется концентрацией фермента и достигает максимального значения (третий участок графика).
3. V3 = Vmax/2; Vmax/2=((Vmax*[S])/(Km+[S]))
Km=[S]
Кm численно равна концентрации субстрата при скорости реакции равной половине максимального Кm очень важная характеристика фермента она измеряется в молях 10-2 – 10-6 моль и характеризуют специфичность фермента чем ниже Km тем выше специфичность фермента.
Графическое определение константы Михаэлиса.
Удобнее график представляющий прямую линию. Такоей график предложил Лайнуивер – Бекк (график двойных обратных связей):


4. Зависимость активности от присутствия активаторов и ингибиторов.
Активаторы – вещества повышающие активность ферментов. Различают специфические активаторы – одно вещество для одного фермента (НСl активатор пепсиногенов) и неспецифические активаторы – увеличивают активность целого ряда ферментов (ионы Mg – гексагенызу, К, Na – атефазу). Активаторами могут быть ионы металлов, метаболиты, нуклеатиды.
Механизм действия активаторов.
- Достраивание активного центра фермента, в результате чего облегчается взаимодействие фермента с субстратом. Таким механизмом обладают ионы металлов.
- Аллостерический активатор взаимодействует с аллостерическим участком - субъединицей фермента и через него меняет структуру активного центра и увеличивает активность фермента. Аллостерическим эффектом обладают метаболиты АТФ. Аллостерический механизм может сочетаться с изменением олигомерности фермента. Под действием активатором происходит объединение нескольких субъединиц в олигомерные формы, и это резко увеличивает активность фермента. Например изоцитрат является активотором фермента ацетил-КоА карбоксилазы.
- Фосфолирирование, дефосфолирирование ферментов. Обратимая модификация ферментов. Чаще присоединение Н3РО4 резко увеличивает активность фермента. Наприме два димера фермента фосфорилазы соединются с четырьмя молекулами АТФ-неактивной и образуют активную тетрамерную фосфолирированную форму. Фосфолирирование ферментов может сочетаться с изменением его олигомерности.
- Частичный протеолиз (необратимая модификация) при этом механизме от неактивной формы фермента (профермента) отрывается фрагмент молекулы блокирующий активный центр фермента. Пример пепсиноген неактивный под действием HCL переходит в пепсин активный.
Ингибиторы – вещества понижающие активность фермента. По специфичности делится на специфичные и неспецифичные, по обратимости обратимые и необратимые. По месту действия: на активный центр и вне активного центра. По механизму действия на конкурентные и неконкурентные.
Конкурентное ингибирование.
Ингибиторы этого типа имеют структуру близкую к структуре субстрата поэтому ингибиторы и субстрат конкурируют за связывание активного центра. Конкурентное ингибироние это обратимое ингибирование:
Неконкурентное ингибирование.
Структурно непохожи на субстраты реакций и поэтому не могут вытеснятся при высокой концентрации субстрата. Существует несколько вариантов действия неконкурентного ингибирования:
- Блокирование функциональной группы активного центра фермента и вследствии этого уменьшение активности. Наприемр активность SН групп – могут связывать тиоловые яды обратимо (соли металлов, ртути, свинца) и необратимо (монойодацетат). Эффект ингибирования может быть уменьшен введением добавочных веществ богатых SH группами. Встречаются и используются сериновые ингибиторы, таким эффектом обладает органическое фосфо-фтор содержащее вещество. Эти вещества могут ингибировать ОН группы в ацетилхолинэстеразе.
- Могут блокировать ионы металлов входящих в состав активного центра ферментов например цианиды, которые блоркируют атомы железа, ЭДТА (этилен-ди-амин-тетраацетат) блокирует ионы Са, Mg.
- Аллостерический ингибитор взаимодействует с аллостерическим участком апосредованно через него по принципу кооперативности, меняется структура и активность каталитического участка. Графически:
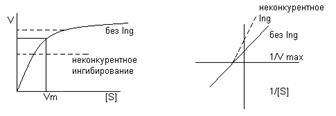
Мах скорость реакции не может быть достигнута путем повышенной концентрации субстрата.






