Влияние температуры
В ограниченном интервале температур до начала денатурации белка скорость ферментативной реакции увеличивается, подчиняясь обычному закону, выражаемому уравнением Аррениуса. Для многих ферментативных реакций характерен температурный коэффициент скорости Q10, близкий к двум. Это соответствует энергии активации Еа= 55 кДж/моль при 37°.
При приближении к температуре денатурации белка, прирост скорости замедляется, затем достигается максимальная скорость, и далее начинается резкое падение скорости, так как исчезают молекулы фермента, способные к катализу. Зависимость скорости каталитической реакции от температуры представлена на рисунке 1.
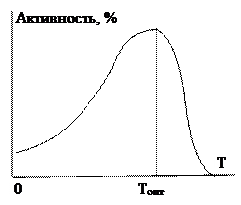
рис. 1
Зависимость от рН
При изменении рН смещаются равновесия переноса протонов, и соответственно заряды на молекулах фермента, а также нередко на молекулах субстрата. При низких значениях рН фермент протонируется и приобретает положительный заряд. При высоких – депротонируется, и приобретает отрицательный заряд. Это влияет на скорость ферментативных реакций. Если активность проявляет только одна из форм молекулы фермента с определенным значением заряда, то концентрация ее проходит через максимум при некотором значении рНМ, и активность будет проявляться в пределах рНМ±1. Получается зависимость активности от рН, представленная на рис. 2.
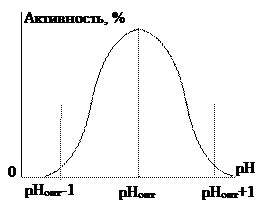
рис. 2
Для каждого фермента существует оптимальное значение рН, про котором проявляется наибольшая активность. При больших отклонениях рН от оптимального значения может происходить денатурация фермента.
Зависимость от концентраций
В математической форме зависимость скорости от концентрации представляется в виде кинетического уравнения. Скорость ферментативной реакции зависит как от концентрации субстрата, так и от концентрации фермента при прочих равных условиях (Т, рН). Необходимо учитывать, что фермент высокомолекулярное вещество, и его концентрация во много раз меньше, чем концентрация субстрата. Пусть в растворе содержатся субстрат с M r = 100 и фермент c M r = 100000. Массовые концентрации обоих реактантов 1 мг/л. Их молярные концентрации будут:
с(S) = 1×10–5 моль/л, с(E) = 1×10–8 моль/л
На 1000 молекул субстрата приходится одна молекула фермента. Реальное соотношение может быть значительно больше. Этим определяется форма кинетических уравнений в ферментативной кинетике.
Далее рассмотрим реакцию, в которой участвуют фермент и только один субстрат. Но выводы будут справедливы и для более сложных реакций, в которых участвуют субстрат и реагент, или два субстрата.
Типичной особенностью кинетики ферментативных реакций оказалось, что скорость пропорциональна концентрации субстрата при его малой концентрации, и становится независимой от концентрации при большой концентрации. Эти результаты эксперимента графически изображаются кривой линией на рис. 3.

Рис. 3
Для объяснения этой зависимости была предложена схема реакции в две стадии. В начале по обратимой реакции образуется фермент-субстратный комплекс S … E, в котором происходит преобразование молекулы субстрата. На второй стадии связь изменившейся молекулы субстрата с ферментом разрывается, и появляется свободная молекула продукта P. Каждое превращение характеризуется своей константой скорости.
k 1 k 2
 S + E S .... E ® E + P
S + E S .... E ® E + P
k –1
Для процесса с таким механизмом Л. Михаэлисом и Ментен было выведено уравнение зависимости скорости от концентрации S, получившее название уравнения Михаэлиса-Ментен.
(Далее вывод уравнения при чтении лекции может быть пропущен.)
Напишем кинетические уравнения для образования конечного продукта и фермент-субстратного комплекса:
v =  = k2c (S×××E) (1)
= k2c (S×××E) (1)
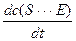 = k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) (2)
= k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) (2)
Общая (начальная) концентрация фермента всегда много меньше концентрации субстрата, что отмечено выше. В ходе реакции концентрация свободного фермента c (E) уменьшается вследствие образования комплекса
c (E) = co (E) - c (S×××E) (3)
В стационарном состоянии концентрация комплекса остается постоянной:
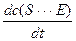 = 0
= 0
Из этого условия получаем
k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) = 0 (4)
Подставляем выражение (3) в (4)
k1 c(S)[ co (E) - c (S×××E)] - k-1c (S×××E) - k2c (S×××E) = 0 (5)
В уравнении (5) раскрываем квадратные скобки и преобразуем его для нахождения концентрации фермент-субстратного комплекса S×××E:

Делением числителя и знаменателя на k 1, получаем
 (6)
(6)
Выражение, состоящее из констант, в знаменателе уравнения называют константой МихаэлисаKM:
 (7)
(7)
Подставляем полученное выраженеие в ур. 1:
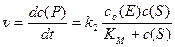 (8)
(8)
Полученное ур. 8 – одна из форм записи уравнения Михаэлиса-Ментен. Проанализируем это уравнение. Во многих ферментативных реакциях константа второй стадии k 2 значительно меньше констант образования k 1 и распада k –1 фермент-субстратного комплекса. В таких случаях константа Михаэлиса приблизительно равна константе равновесия распада комплекса на исходные молекулы:
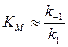
При большой концентрации субстрата, когда c (S)>> KМ, константой KМ можно пренебречь, и тогда c (S) в ур. 8 сокращается; при этом скорость принимает максимальное значение:
v макс = k 2 c o(E) (9)
Максимальная скорость зависит от концентрации фермента и не зависит от концентрации субстрата. Это означает, что реакция идет по нулевому порядку относительно субстрата.
При малой концентрации субстрата, когда c (S)<< KМ, реакция идет по первому порядку относительно субстрата:
v = 
Таким образом, при увеличении концентрации субстрата порядок реакции изменяется от первого (область I на рис. 4) до нулевого (область III).
|

рис. 4
Уравнение Михаэлиса-Ментен можно записать с использованием максималоной скорости:
 (10)
(10)
Эта форма уравнения удобна для представления результатов эксперимента, когда не известна концентрация фермента.
Если скорость реакции равна половине максимальной скорости, то из ур. 10 следует, что константа Михаэлиса равна соответствующей концентрации субстрата (рис. 4):
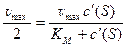 , откуда K M = c '(S)
, откуда K M = c '(S)
Для более точного определения константы Михаэлиса графическим методом было предложено преобразование ур. 10 через обратные значения переменных. Меняем местами числитель и знаменатель в ур. 10:
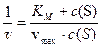 или
или 
Графическое представление уравнения Михаэлиса-Ментен в обратных координатах 1/ v – 1/ c (S) называют графиком Лайнуивера-Бёрка (рис. 5). Это график прямой линии, которая отсекает на оси 1/ v отрезок, равный обратному значению максимальной скорости. Продолжение прямой линии в отрицательную область до пересечения с горизонтальной осью дает отрезок, абсолютное значение которого равно 1/ K M. Таким образом, из графика определяются обратные значения параметров 1/ v max и 1/ K M, а затем и сами параметры.

рис. 5
Есть ферменты, действие которых не строго подчиняется ур. Михаэлиса-Ментен. При высокой концентрации субстрата максимальная скорость достигается, но при низкой концентрации график зависимости v – S принимает так называемый сигмоидный вид. Это означает, что сначала скорость увеличивается с ускорением (выгнутость кривой направлена вниз, см. рис. 6), а затем после точки перегиба скорость увеличивается с замедлением и приближается к максимальной скорости. Это объясняется кооперативным влиянием субстрата при наличии в ферменте нескольких центров связывания. Связывание одной молекулы S способствует связывания второй молекулы на другом центре.

Рис. 6
Ингибирование ферментов
На активность сложных молекул фермента влияют различные вещества, не обязательно все, присутствующие в окружающей среде. Молекулы этих веществ могут образовывать связи с различными участками молекулы фермента. При этом возникают два основных варианта ингибирования.
Конкурентное (изостерическое) ингибировагие – молекула ингибитора I образует связь с активным центром фермента, мешая связыванию субстрата S. Концентрация фермент-субстратного комплекса понижается, и скорость ферментативной реакции уменьшается.
|
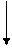

|
 E …. I
E …. I
|
|
 E
E
E … S
Однако при большой концентрации субстрат полностью вытесняет молекулы ингибитора, в результате чего достигается та же самая максимальная скорость. В координатах Лайнуивера-Бёрка график зависимости скорости от концентрации субстрата проходит через ту же точку на оси ординат (1/ v max), но с большим углом наклона (см. рис. 7). Следовательно, при конкурентном ингибировании изменяется константа Михаэлиса. Роль конкурентного ингибитора может выполнять продукт реакции. Если при участии фермента значительно повышается концентрация продукта, то он, занимая активный центр, препятствует образованию комплекса E … S, и приостанавливает дальнейшее образование собственных молекул.
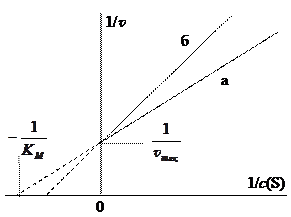
Рис. 7. Зависимости для реакции без ингибитора (а) и с ингибитором (б)
Возможно также взаимодействие разных молекул не с активным центром фермента, а с другими группами его молекулы. Эти молекулы не имеют структурного сходства с субстратом. При таком воздействии на фермент также может понижаться его активность. Этот вид ингибирования называется неконкурентным или аллостерическим. Независимо от концентраций, такой ингибитор не может быть вытеснен субстратом. Он может связываться как со свободной молекулой фермента, так и с фермент-субстратным комплексом. Такие воздействия на фермент следует иметь в виду при эпизодах заболеваний, в которых проявляется понижение активности фермента. Не исключается и ингибирующее действие субстрата на активность данного фермента. Легко себе представить, что субстрат связывается не только с активным центром фермента, но и с каким-то еще участком этой молекулы, становясь ингибитором.
Фермент, имеющий аллостерический центр, участвующий в изменении его активности, называют регуляторным или аллостерическим. Такие ферменты автоматически управляют биохимическими процессами клетки.
Так в чем же сущность такого ингибирования? Связывание молекулы ингибитора вызывает изменение конформации фермента. В определенной степени меняется взаимное расположение функциональных групп в активном центре. Это не препятствует образованию E … S-комплекса, но препятствует превращению субстрата в продукт реакции. Неконкурентное ингибирование может быть как обратимым, зависящим от концентрации ингибитора, так и необратимым в случае образования прочной связи E … I. Ядами для ферментов могут быть ионы тяжелых металлов (Cd2+, Ag+, Hg2+, Tl+ и др), окислители, сильные донорные молекулы и т. д.
Для обратимого неконкурентного ингибирования характерно уменьшение максимальной скорости реакции при постоянстве константы Михаэлиса. На графике Лайнуивера-Бёрка это проявляется следующим образом:

Рис. 8. а – реакция без ингибирования, б – реакция с неконкурентным ингибированием.
Известно, что для некоторых белков существуют активаторы ферментативной активности, называемые коферментами. Ферментом оказывается не белок как таковой, а его комплекс с коферментом.
Ферментативные процессы с участием ингибиторов подчиняются более сложным кинетическим уравнениям, чем уравнение Михаэлиса-Ментен.
Ферментативные процессы, описываемые уравнением Михаэлиса-Ментен достаточно типичны, но существуют и более сложные процессы, знакомство с которыми у вас состоится при дальнейшем изучении медицинских наук.






