Ингибиторы ферментов
Ингибиторы – это вещества полностью или частично подавляющие активность ферментов.

Обратимые ингибиторы присоединяются к ферменту слабыми связями и могут легко отделяться от фермента.
Обратимые конкурентные ингибиторы:
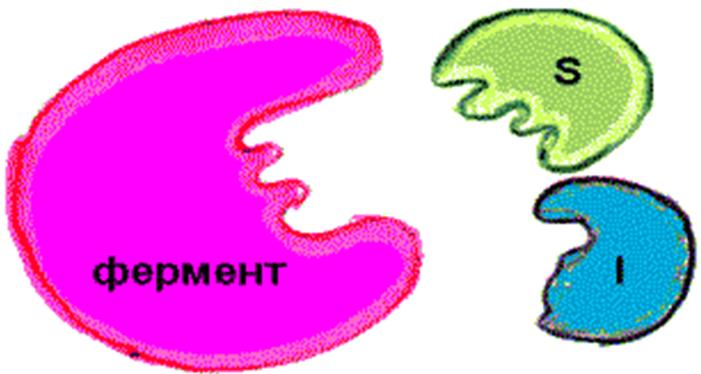
Являются структурными аналогами субстрата;
Конкурируют с S за связывание с активным центром E;
При увеличении концентрации субстрата степень ингибирования уменьшается.
А при избытке субстрата действие ингибитора на фермент практически полностью прекращается.
Пример:
 |
Зависимость скорости реакции от концентрации S в присутствии и отсутствии обратимого конкурентного ингибитора:

! При обратимом конкурентном ингибировании возрастает KM, но, как правило, не меняется максимальная скорость р-ции.
KM возрастает, т.к. как бы снижается сродство E к S, поскольку присоединению S к АЦ фермента мешает ингибитор.
V max, как правило, не меняется, т.к. при большом избытке S происходит вытеснение I из АЦ фермента и может быть достигнута максимально возможная скорость реакции.
Обратимые неконкурентные ингибиторы
Присоединяются к ферменту в участке, расположенном вне области активного центра => меняется конформация E => меняется структура активного центра E => уменьшается активность E.

! При обратимом неконкурентном ингибировании уменьшается V max, но, как правило, не меняется KM.
V max уменьшается, т.к. ¯ кол-во активных молекул E, т.к. часть из них, связанных с I, на время полностью исключаются из катализа.
У тех молекул E, которые не связаны с ингибитором, сродство к S остается прежним.
Поэтому, KM, как правило, меняться не будет.
Хотя, в ряде случаев, KM может возрастать.
Необратимые ингибиторы – присоединяются к ферменту, образуя прочную ковалентную связь с его функциональными группами. Или вызывают необратимую денатурацию фермента.
Необратимые специфические ингибиторы – присоединяются к строго определённой группе в области активного центра E, образуя с ней прочные ковалентные связи.
Пример: Ацетилхолинэстераза ингибируется фосфорорганическими соединениями.
Например: диизопропилфторфосфат (ДФФ), зарин и др.

Необратимые неспецифические ингибиторы.
Существует 2 разновидности:
1) ингибиторы, образующие прочную ковалентную связь с группами, расположенными в любом участке фермента (довольно часто: вне области активного центра).
Они не специфичны к определенным ферментам.
Пример:

n -Хлормеркурибензоат присоединяется к свободным SH-группам любых ферментов. Его действие неспецифично.
2) ингибиторы, которые присоединяются к молекуле фермента вне области активного центра и образуют с ней плохо растворимые комплексы (H2S, соли тяжелых металлов).






