Значение десмозина и лизиннорлейцина. В межклеточном пространстве молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны множеством жёстких поперечных сшивок в разветвлённую сеть. В образовании этих сшивок участвуют остатки лизина двух, трёх или четырёх пептидных цепей. Структуры, образующиеся при этом, называются десмозинами (десмозин или изодесмозин). Предполагают, что эти гетероциклические соединения формируются следующим образом: вначале 3 остатка лизина окисляются до соответствующих ε-альдегидов, а затем происходит их соединение с четвёртым остатком лизина с образованием замещённого пиридинового кольца. Окисление остатков лизина в ε-альдегиды осуществляется медьзависимой ли-зилоксидазой, активность которой зависит также от наличия пиридоксина
Десмозин (образован четырьмя остатками лизина). Кроме десмозинов, в образовании поперечных сшивок может участвовать лизиннорлейцин, который образуется двумя остатками лизина
Лизиннорлейцин (образован двумя остатками лизина). Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности. Следует отметить, что эластин синтезируется как растворимый мономер, который называется "тропоэластин". После образования поперечных сшивок эластин приобретает свою конечную внеклеточную форму, которая характеризуется нерастворимостью, высокой стабильностью и очень низкой скоростью обмена.
157. Гликозаминогликаны и протеогликаны. Строение и функции. Роль гиалуроновой кислоты в организации межклеточного матрикса.
Гликозаминогликаны - линейные отрицательно заряженные гетерополисахариды. РаНbше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие, смазочные свойства. Эти свойства обусловлены тем, что гликозаминогликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Протеогликаны - высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных протеогликанов разные. Протеогликаны отличаются от большой группы белков, которые называют гликопротеинами. Эти белки тоже содержат олигосахаридные цепи разной длины, ковалентно присоединённые к полипептидной основе. Углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков - ферментах, гормонах, транспортных, структурных белках и др. Представители гликопротеинов - коллаген и эластин, иммуноглобулины, ангиотензиноген, трансферрин, церулоплазмин, внутренний фактор Касла, тиреотропный гормон. Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей. Благодаря особенностям своей структуры и физико-химическим свойствам, протеогликаны и гликозаминогликаны могут выполнять в организме человека следующие функции:
- они являются структурными компонентами межклеточного матрикса;
- протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса;
- все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Na+, K+, Са2+) и таким образом участвовать в формировании тургора различных тканей;
- протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов;
- гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах;
- гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках;
- кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
- гепарин - антикоагулянт;
- гепарансульфаты - компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических и других пузырьков.
Строение и классы гликозаминогликатов. Гликозаминогликаны представляют собой длинные неразветвлённые цепи гетерополиса-харидов. Они построены из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая), вторым мономером - производное аминосахара (глюкоз- или галактозамина). NH2-rpynna аминосахаров обычно ацетилирована, что приводит к исчезновению присущего им положительного заряда. Кроме гиалуроновой кислоты, все гликозаминогликаны содержат сульфатные группы в виде О-эфиров или N-сульфата.
Гиалуроновая кислота находится во многих органах и тканях. В хряще она связана с белком и участвует в образовании протеогликановых агрегатов, в некоторых органах (стекловидное тело глаза, пупочный канатик, суставная жидкость) встречается и в свободном виде. Предполагается, что в суставной жидкости гиалуроновая кислота выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями. Повторяющаяся дисахаридная единица в гиалуроновой кислоте имеет следующую структуру:

Гиалуроновая кислота содержит несколько тысяч дисахаридных единиц, молекулярная масса её достигает 105 - 107 Д.
Хондроитинсульфаты - самые распространённые гликозаминогликаны в организме человека; они содержатся в хряще, коже, сухожилиях, связках, артериях, роговице глаза. Хондроитинсульфаты являются важным составным компонентом агрекана - основного протеогликана хрящевого матрикса. В организме человека встречаются 2 вида хондроитинсульфатов: хондроитин-4-сульфат и хондроитин-6-сульфат. Они построены одинаковым образом, отличие касается только положения сульфатной группы в молекуле N-ацетилгалактозамина.
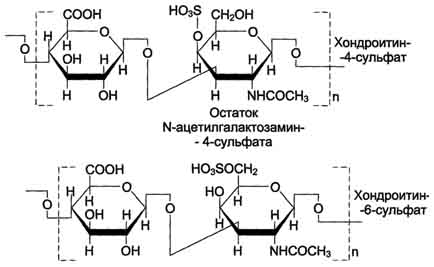
Одна полисахаридная цепь хондроитинсульфата содержит около 40 повторяющихся дисахаридных единиц и имеет молекулярную массу 104 - 106 Д.
Кератансульфаты - наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. Кератансульфат I находится в роговице глаза и содержит кроме повторяющейся дисахаридной единицы L-фукозу, D-маннозу и сиаловую кислоту. Кератансульфат II был обнаружен в хрящевой ткани, костях, межпозвоночных дисках. В его состав помимо Сахаров дисахаридной единицы входят N-ацетилгалактозамин, L-фукоза, D-манноза и сиаловая кислота. Кератансульфат II входит в состав агрекана и некоторых малых протеогликанов хрящевого матрикса. В отличие от других гликозаминогликанов, кератансульфаты вместо гексуроновой кислоты содержат остаток галактозы.
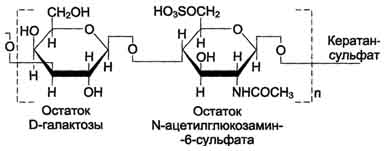
Молекулярная масса одной цепи кератансуль-фата колеблется от 4 × 103 до 20 × 103 Д.
Дерматансульфат широко распространён в тканях животных, особенно он характерен для кожи, кровеносных сосудов, сердечных клапанов. В составе малых протеогликанов (бигликана и декорина) дерматансульфат содержится в межклеточном веществе хрящей, межпозвоночных дисков, менисков. Повторяющаяся дисахаридная единица дерматансульфата имеет следующую структуру.
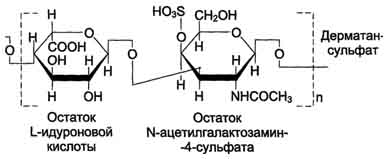
Молекулярная масса одной цепи дерматансульфата колеблется от 15 × 103 до 40 × 103 Д.
Гепарин - важный компонент противосвёртывающей системы крови (его применяют как антикоагулянт при лечении тромбозов). Он синтезируется тучными клетками и находится в гранулах внутри этих клеток. Наибольшие количества гепарина обнаруживаются в лёгких, печени и коже. Дисахаридная единица гепарина похожа на дисахаридную единицу гепарансульфата. Отличие этих гликозаминогликанов заключается в том, что в гепарине больше N-сульфатных групп, а в гепарансульфате больше N-ацетильных групп. Молекулярная масса гепарина колеблется от 6 × 103 до 25 × 103 Д

Гепарансульфат находится во многих органах и тканях. Он входит в состав протеогликанов базальных мембран. Гепарансульфат является постоянным компонентом клеточной поверхности. Структура дисахаридной единицы гепарансульфата такая же, как у гепарина. Молекулярная масса цепи гепарансульфата колеблется от 5 × 103 до 12 × 103 Д.
Cтроение и виды протеогликанов. В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные - например агрекан и версикан. Кроме них, в межклеточном матриксе имеется целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там самые разнообразные функции. Основной протеогликан хрящевого матрикса называется агрекан, он составляет 10% по весу исходной ткани и 25% сухого веса хрящевого матрикса. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. По форме молекула агрекана напоминает бутылочный "ёршик". В хрящевой ткани молекулы агрекана собираются в агрегаты с гаалуроновой кислотой и небольшим связывающим белком. Оба компонента присоединяются к агрекану нековалент-ными связями в области домена G1. Домен G1 взаимодействует примерно с пятью дисахаридными единицами гиалуроновой кислоты, далее этот комплекс стабилизируется связывающим белком; домен G1 и связывающий белок вместе занимают 25 дисахаридных единиц гиалуроновой кислоты. Конечный агрегат с молекулярной массой более 200 × 106 Д состоит из одной молекулы гиалуроновой кислоты и 100 молекул агрекана (и такого же количества связывающего белка). Координация сборки этих агрегатов является центральной функцией хондроцитов. Агрекан и связывающий белок продуцируются этими клетками в необходимых количествах. Эти компоненты могут взаимодействовать друг с другом внутри клетки, но процесс агрегации полностью завершается в межклеточном матриксе. Показано, что гиалуроновая кислота образуется на поверхности хондроцитов специфической синтетазой и "выталкивается" в межклеточное пространство, чтобы связаться с агреканом и связывающим белком. Созревание функционально активного тройного комплекса составляет около 24 ч.
Малые протеогликаны. Малые протеогликаны - протеогликаны с низкой молекулярной массой. Они содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани. Эти протеогликаны имеют небольшой коровый белок, к которому присоединены одна или две цепи гликозаминогликанов. Наиболее изучены декорин, бигликан, фибромодулин, люмикан, перлекан. Коровые белки бигликана и декорина похожи по размерам и структуре (молекулярная масса 36 000 и 38 000 Д, соответственно). Они имеют несколько тандемных повторов, богатых лейцином, которые образуют α-спирали или β-структуры. На N- и С-концах этих белков имеются домены, содержащие S-S-связи. Ко'ровые белки значительно различаются по первичной структуре в N-концевых областях, что определяет различия в присоединении гликозаминогликанов. Бигликан содержит серии в положениях 5 и 11, что обеспечивает присоединение двух полисахаридных цепей. Декорин содержит один серии в положении 4, поэтому к нему присоединяется одна полисахаридная цепь. У этих протеогликанов полисахаридные цепи представлены дерматансульфатом с молекулярной массой ~ 30 000 Д.Ко́ровый белок фибромодулина (молекулярная масса ~ 40 000 Д) тоже имеет области тандемных повторов, богатые лейцином, но его N-концевая область отличается тем, что не содержит серина, а имеет несколько сульфатированных остатков тирозина, поэтому одна или две цепи кератансульфата присоединяются к ко'ровому белку фибромодулина не в N-концевой, а в области, богатой лейцином, через NH2-группу аспарагина. Малые протеогликаны являются мультифункциональными макромолекулами. Они могут связываться с другими компонентами соединительной ткани и оказывать влияние на их строение и функции. Например, декорин и фибромодулин присоединяются к фибриллам коллагена II типа и ограничивают их диаметр (т.е. препятствуют образованию толстых фибрилл). Декорин и бигликан, присоединяясь к фибронектину, подавляют клеточную адгезию, а присоединяясь к фактору роста опухолей (3, снижают его митогенную активность. Кроме этого, имеется большое количество данных о том, что малые протеогликаны играют важную регуляторную роль в процессах развития и восстановления соединительной ткани.
158. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Роль этих белков в межклеточных взаимодействиях и развитии опухолей.
К первой группе белков с выраженными адгезивными свойствами относят фибронектин, ламинин, нидоген, фибриллярные коллагены и коллаген IV типа; их относят к белкам "зрелой" соединительной ткани.
Фибронектин. Фибронектин - один из ключевых белков межклеточного матрикса, неколлагеновый структурный гликопротеин, синтезируемый и выделяемый в межклеточное пространство многими клетками. Он построен из двух идентичных полипептидных цепей, соединённых дисульфидными мостиками у своих С-концов. Полипептидная цепь фибронектина содержит 7-8 доменов, на каждом из которых расположены специфические центры для связывания разных веществ. Фибронектин может связывать коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, гепарин, фермент трансглутаминазу. Благодаря своей структуре фибронектин может выполнять интегрирующую роль в организации межклеточного вещества, а также способствовать адгезии клеток. Существует несколько форм фибронектина, которые синтезируются разными клетками. Растворимый, или плазменный, фибронектин синтезируется гепатоцитами. Нерастворимый, или тканевый фибронектин синтезируется в основном фибробластами или эндотелиоцитами, глиоцитами и эпителиальными клетками. Обе формы фибронектина вовлекаются в разнообразные процессы: способствуют адгезии и распространению эпителиальных и мезенхимальных клеток, стимулируют пролиферацию и миграцию эмбриональных и опухолевых клеток, контролируют дифференцировку и поддержание цитоскелета клеток, активно участвуют в воспалительных и репаративных процессах. Это связано с тем, что каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп (RGD), с помощью которой он может присоединяться к клеточным рецепторам (интегринам). Эти рецепторы опосредованно взаимодействуют с актиновыми микрофиламентами, которые находятся в цитозоле. В этом процессе участвуют так называемые белки прикрепления (от англ. attach - прикреплять proteins): талин, винкулин, α-актинин. С помощью таких белок-белковых взаимодействий информация может передаваться из межклеточного матрикса внутрь клетки, а также в обратном направлении - из клетки наружу, таким образом влияя на протекающие в клетке процессы. Известно также, что фибронектин участвует в миграции клеток, которые могут присоединяться к его RGD-участкам, и, таким образом, фибронектин как бы помогает им перемещаться в межклеточном матриксе. В межклеточном матриксе, окружающем трансформированные (или опухолевые) клетки, количество фибронектина заметно снижено, что может быть одной из причин появления метастазов.
Ламинин - наиболее распространённый некол-лагеновый гликопротеин базальных мембран. Он состоит из трёх полипетидных цепей: А, В1 и В2. Молекула ламинина имеет крестообразную форму с тремя одноцепочечными ветвями и одной трёхцепочечной ветвью. Каждая цепь ламинина содержит несколько глобулярных и стержневидных доменов, на которых имеются специфические центры связывания для различных веществ. Ламинин взаимодействует со всеми структурными компонентами базальных мембран, включая коллаген IV типа, нидоген, фибронектин, ГСПГ. Кроме того, молекула ламинина имеет несколько центров связывания с клетками. Главные функции ламинина определяются его способностью связывать клетки и модулировать клеточное поведение. Он может влиять на рост, морфологию, дифференцировку и подвижность клеток. Ламинин выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.
159. Структурная организация межклеточного матрикса. Изменения соединительной ткани при старении, коллагенозах. Роль коллагеназы при заживлении ран. Оксипролинурия.
Как уже говорилось, межклеточный матрикс представляет собой супрамолекулярный комплекс, образованный сложной сетью связанных между собой макромолекул. В организме человека межклеточный матрикс формирует такие высокоспециализированные структуры, как хрящ, сухожилия, базальные мембраны, а также (при вторичном отложении фосфата кальция) кости и зубы. Эти структуры различаются между собой как по молекулярному составу, так и по способам организации основных компонентов (белков и полисахаридов) в различных формах межклеточного матрикса.
Межклеточный матрикс костной и зубной ткани. Костная и зубная ткань - специализированный тип соединительной ткани. Эти ткани выполняют в организме человека следующие важные функции:
- из костей образуется скелет организма;
- кости защищают и поддерживают внутренние органы;
- кости служат местом депонирования кальция и неорганического фосфата;
- костный мозг входит в состав кроветворной и иммунной систем;
- зубы как часть жевательного аппарата входят в состав пищеварительной системы;
- зубы - часть речевого аппарата человека.
Замечательным свойством костей является сочетание в них таких качеств, как высокая прочность на разрыв с очень лёгким весом. Костная и зубная ткань отличаются высокой минерализацией (или кальцификацией) межклеточного матрикса и содержат по массе -50% неорганических соединений, 25% органических компонентов и 25% воды.
Неорганическая часть. В состав костей входит 99% всего кальция организма, 87% фосфора, ~ 60% магния и -25% натрия. Кальций в костях находится в форме минерала гидроксиапатита, примерный состав которого Са10(РО4)6(ОН)2. Гидроксиапатит образует кристаллы, имеющие обычно размер 20 × 5 × 1,5 нм. В костной ткани содержится много микроэлементов, таких как медь, стронций, барий, цинк, фтор и др., которые играют важную роль в обмене веществ в организме. Минеральная часть костей включает также карбонаты, гидроксиды и цитраты. Минеральный состав зуба различен в разных его частях. Твёрдые части зуба (эмаль, дентин и цемент) содержат от 70% (цемент и дентин) до 96 - 97% (эмаль) неорганических веществ. Основную часть этих веществ составляют фосфат кальция, входящий в состав кристаллов гидроксиапатита (75%), а также карбонат и фторид кальция. Мягкие части зуба (пульпа и периодонт) не относят к тканям с высокой степенью минерализации. Пульпа состоит из рыхлой волокнистой соединительной ткани (такая ткань находится практически во всех органах и образует их строму, или каркас), а периодонт образован плотной волокнистой соединительной тканью, которая также входит в состав сухожилий и связок.
Органическая часть. Органические вещества костного матрикса представлены белками, липидами и небольшим количеством протеогликанов. Основной белок костной ткани - коллаген I типа (90 - 95%). Кроме него, в матриксе костей присутствуют такие белки, как коллаген V типа, остеонектин, остеокальцин, так называемые морфогенетические белки кости (BMP) и ферменты - щелочная фосфатаза (в остеобластах) и кислая фосфатаза (в остеокластах). Оба эти фермента служат маркёрами соответствующих клеток костной ткани. Углеводная часть протеогликанов костного матрикса представлена дерматан- и кератансульфатами. Главный компонент органических веществ зубной ткани - коллаген I типа. Углеводы и липиды присутствуют в небольших количествах. Содержание органических веществ в твёрдых частях зуба варьирует от 2% (эмаль) до 30% (дентин и цемент). Содержание органических веществ в мягких частях зуба такое же, как в соответствующих видах соединительной ткани.
Mежклеточный матрикс суставного хряща. Основные компоненты межклеточного хрящевого матрикса - коллаген II типа, агрекан, гиалуроновая кислота и вода. Кроме них, в мат-риксе находятся малые протеогликаны, коллагены VI, IX, XI типов, связывающий белок, другие неколлагеновые белки (фибронектин, анкорин, хрящевой олигомерный белок, хонд-роадгерин), разнообразные ростовые факторы. "Эндоскелет" хрящевого матрикса образован фибриллярной сетью, которая состоит из коллагенов II, IX и XI типов и придаёт хрящу прочность. Коллаген XI типа находится внутри фибрилл, образованных коллагеном II типа, он играет определённую роль в сборке этих фибрилл. Коллаген IX типа антипараллельно присоединяется к фибриллам коллагена II типа. Его глобулярный НК4-домен - основный, он не связан с фибриллами коллагена II типа, и поэтому к нему может присоединяться такой компонент матрикса, как гиалуроновая кислота. Микрофибриллы, которые образуются тетрамерами коллагена VI типа, присоединяются к фибриллам коллагена II типа и к гиалуроновой кислоте. Кроме того, они могут присоединяться к клеткам, поэтому коллаген VI типа называют "мостовой" молекулой между поверхностью клетки и фибриллами коллагена во внеклеточном матриксе. Высокомолекулярные агрегаты, состоящие из агрекана и гиалуроновой кислоты, являются полианионами, так как содержат большое количество кислых групп. Это способствует высокой гидратации хрящевого матрикса и обеспечивает выполнение им рессорных функций. Содержание воды в суставном хряще непостоянно: при нагрузке жидкость вытесняется, пока давление набухания не уравновесит внешнюю нагрузку. Когда нагрузка прекращается, вода вновь возвращается в хрящ. Очень наглядно это проявляется в межпозвоночных дисках. Утром, после ночного сна, на долю воды приходится около 75% массы диска. При внешней нагрузке на диски в течение дня содержание воды уменьшается примерно на 20%. Вследствие того рост человека к вечеру на 1-2 см меньше, чем утром. У космонавтов в условиях невесомости отмечается увеличение роста даже на 5 см. Малые протеогликаны, например, декорин, присоединяются к фибриллам коллагена II типа; они влияют на фибриллогенез, так как ограничивают диаметр этих фибрилл. Важную роль в организации хрящевого межклеточного матрикса играет также фибронек-тин. Биологическое значение этих и других минорных компонентов хрящевого матрикса заключается в том, что они участвуют в сборке и организации высокомолекулярных компонентов межклеточного вещества и в регуляции функции хондроцитов.
Mежклеточный матрикс кожной ткани. Основной организующий компонент матрикса кожной ткани - коллаген VII типа. Пучки фибрилл, образованные димерами этого коллагена, своими С-концами могут присоединяться к lamina densa базальной мембраны (как бы "заякориваться" в ней) и образовывать петли в субэпидермисе. Такие "заякоренные" фибриллы могут соединять lamina densa базальной мембраны с "якорными дисками", которые находятся в более глубоких субэпителиальных слоях и по своему составу похожи на базальные мембраны (содержат коллаген IV типа). "Заякоренные" фибриллы также захватывают фибриллы коллагена I и III типов. Таким способом "заякоренные" фибриллы коллагена VII типа обеспечивают присоединение эпидермиса к дерме.
Базальные мембраны. Базальные мембраны - специализированная форма межклеточного матрикса. Они синтезируются различными клетками: эндотелиальными, эпителиальными, мышечными, нервными, жировыми. Базальные мембраны представляют собой тонкие слои, которые обычно отделяют клетки и клеточные слои от окружающей соединительной ткани. Например, они окружают отдельные мышечные волокна, жировые и шванновские клетки. В таких структурах, как почечные клубочки и лёгочные альвеолы, ба-зальные мембраны расположены между двумя различными слоями клеток и играют роль высокоселективного фильтрационного барьера. С помощью электронной микроскопии выявлена двухслойная структура базальных мембран: lamina mm, которая находится со стороны клеточной мембраны, и lamina densa, которая соединена с подлежащей соединительной тканью. Основными компонентами базальных мембран являются коллаген IV типа, ламинин, гепарансульфатсодержащие протеогликаны (ГСПГ). Нерастворимость и механическую стабильность базальных мембран обеспечивают молекулы коллагена IV типа, которые организуются в специальную опорную сеть. Эта эластичная трёхмерная сеть образует структурный остов, к которому прикрепляются другие компоненты базальных мембран. Ламинин взаимодействует практически со всеми структурными компонентами базальных мембран: коллагеном IV типа, нидогеном, ГСПГ.Нидоген формирует с ламинином нековалентно связанный комплекс. Кроме этого, нидоген имеет центр связывания коллагена IV типа и, таким образом, может играть роль "мостовой" молекулы между различными компонентами базальной мембраны.ГСПГ базальных мембран могут образовывать олигомеры, соединяясь концевыми доменами белкового ядра, а также связываться с ламинином и коллагеном IV типа. Базальные мембраны выполняют разнообразные и сложные функции. В почечных клубочках базальная мембрана служит полупроницаемым фильтром, препятствующим переходу макромолекул из плазмы в первичную мочу. Большое значение в этом процессе имеет высокий отрицательный заряд протеогликанов, который препятствует прохождению через базальную мембрану других отрицательно заряженных молекул (например, белков), а также отрицательно заряженных эритроцитов. Кроме этого, базальные мембраны играют важную роль в прикреплении и ориентации клеток в пространстве, в процессах эмбрионального развития и тканевой регенерации.
Известны 2 типа коллагеназ:
Тканевая коллагеназа присутствует у человека в различных органах и тканях. В норме она синтезируется клетками соединительной ткани, прежде всего, фибробластами и макрофагами. Тканевая коллагеназа - металлозависимый фермент, который содержит Zn2+ в активном центре. В настоящее время известно 4 изоформы этого фермента. Активность коллагеназы зависит от соотношения в межклеточном матриксе её активаторов и ингибиторов. Среди активаторов особую роль играют плазмин, калликреин и катепсин В (см. раздел 14). Тканевая коллагеназа обладает высокой специфичностью, она перерезает тройную спираль коллагена в определённом месте, примерно на 1/4 расстояния от С-конца, между остатками глицина и лейцина (или изолейцина). Образующиеся фрагменты коллагена растворимы в воде, при температуре тела они спонтанно денатурируются и становятся доступными для действия других протеолитических ферментов. Нарушение катаболизма коллагена ведёт к фиброзу органов и тканей (в основном печени и лёгких). А усиление распада коллагена происходит при аутоиммунных заболеваниях (ревматоидном артрите и системной красной волчанке) в результате избыточного синтеза коллагеназы при иммунном ответе.
Бактериальная коллагеназа синтезируется некоторыми микроорганизмами. Например, Clostridium histolyticum (возбудитель газовой гангрены) выделяет коллагеназу, расщепляющую пептидную цепь коллагена более чем в 200 местах. Этот фермент гидролизует следующую связь -X-Гли-Про-У- между звеньями X и Гли. Таким образом разрушаются соединительнотканные барьеры в организме человека, что обеспечивает проникновение (или инвазию) этого микроорганизма и способствует возникновению и развитию газовой гангрены. Сам возбудитель не содержит коллагена и поэтому не подвержен действию коллагеназы.






