СТРОЕНИЕ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ АЛКИНОВ
Алкины – ненасыщенные углеводороды с открытой цепью, содержащие в молекуле одну тройную связь. Простейшим представителем алкинов является ацетилен НС≡СН, поэтому соединения этого ряда называют ацетиленовыми углеводородами. Общая формула алкинов СnН2n-2.
Атомы углерода, образующие в алкинах тройную связь, находятся в sp-гибридизации. Тройная связь состоит из одной s–связи и двух π – связей.
1.1. sp –Гибридное состояние атома углерода,
свойства тройной С≡С связи
sp–Гибридное состояние четырехвалентного атома углерода в алкинах возникает при взаимодействии одной 2s–орбитали и одной 2px–орбитали. В результате образуются две гибридные sp–орбитали, расположенные в плоскости под углом в 180°, и направленные в противоположные стороны:

2рY и 2рz – орбитали остаются негибридизованными, они находятся на перпендикулярных оси Х осях Y и Z.
sp–Гибридные орбитали при перекрывании с электронными орбиталями соседних атомов образуют σ-связи. При боковом перекрывании р–орбиталей двух соседних атомов углерода образуются две p - связи, которые сливаются, образуя одно цилиндрическое p-электронное облако вокруг линии, соединяющей ядра.
Свойства С≡С связи:
- длина 0,120 нм;
- энергия Е С≡С» 829 кДж/моль;
- расположение – линейное, что делает невозможной геометрическую изомерию для соединений с тройной связью.
Гомологический ряд алкинов
Простейшим представителем ацетиленовых углеводородов является ацетилен. Другие члены ряда можно получить, замещая атомы водорода в ацетилене на радикалы, например:
HCºCH C2H2
H3CCºCH C3H4
H3C-CºC-CH3 C4H6
H5C2-CºC-CH3 C5H8
Номенклатура алкинов
1) По рациональной номенклатуре ацетиленовые углеводороды рассматриваются как производные ацетилена. В названии указывается наименование радикалов, а в конце ставится слово ацетилен.
СН3 – С ºСН метилацетилен
СН3 – СºС – СН3 α,β-диметилацетилен
С2Н5 – СºС – СН3 α-метил,β-этилацетилен
(СН3)2СН – СºС – СН3 α-метил,β-изопропилацетилен
2) По систематической номенклатуре пользуются теми же правилами, что и в случае алканов и алкенов, в названиях алканов суффикс АН заменяется на ИН. Главная цепь выбирается так, чтобы в нее попала тройная связь. Место тройной связи указывают цифрой.
СН3 – СН3 этан НС º СН этин
СН3-СН2-СН3 пропан СН3-СºСН пропин
СН3-СН2- СН2-СН3 бутан СН3-СºС-СН3 бутин
и тд.
CH3 CH3


CH3- C-CºC-C-CH3 - 2,2,5,5-тетраметилгексин-3
 | |||
 |
CH3 CH3
Изомерия
Для алкинов возможна только структурная изомерия: положения тройной связи и углеродного скелета.
Структурная изомерия положения тройной связи начинается с алкина с четырьмя атомами углерода:
СН3-СН2-СºСН - этилацетилен, бутин-1
СН3-СºС-СН3 - диметилацетилен, бутин-2
Изомерия углеродного скелета начинается с алкина, имеющего пять атомов углерода.
СН3-СН2-СН2-СºСН пентин-1, пропилацетилен
СН3-СН2-СºС-СН3 пентин-2, метилэтилацетилен
СН3-СН(СН3)-СºСН 3-метилбутин-1, изопропилацетилен
СПОСОБЫ ПОЛУЧЕНИЯ АЛКИНОВ
В природе ацетиленовые углеводороды не встречаются, их получают синтетическим путем.
1) В промышленности для получения ацетилена из метана или этана используется реакция пиролиза:


Время нагревания должно быть очень коротким, так как ацетилен при температуре 15000С быстро распадается на углерод и водород. Поэтому необходимо быстрое охлаждение продуктов.
2) Другим промышленным методом получения алкинов является реакция карбидов металлов с водой:

3) Метод Савича позволяет получать алкины из алкенов: к молекуле последнего присоединяют молекулу галоида и затем проводят отщепление двух молекул галогенводородов под действием концентрированной щелочи при повышенной температуре (используют также спиртовой раствор щелочи или амид натрия).

Отщепление идет в две стадии. Наиболее легко проходит первая стадия с образованием устойчивого винилгалогенида. Радикал СН2=СН- винил. Ненасыщенные галогениды с галогеном у двойной связи называются винилгалогенидами. Вторую молекулу НС1 отщепляют в более жестких условиях или при использовании более сильного основания – амида натрия.
4) Метод Фаворского позволяет получать алкины из кетонов. Действуя на кетон при 150-1700С пятихлористым фосфором, замещают кислород на два хлора и получают геминальные производные галогеналканов, т.е. имеющих два атома галогена у одного атома углерода. Затем, как в предыдущем способе, действуют спиртовым раствором КОН, отщепляя две молекулы НС1. Например:
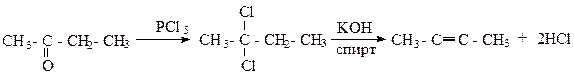
5) Алкины можно получать из тетрагалогенидов алканов при действии на них цинка. Метод малоприменим ввиду труднодоступности исходных соединений.

4) Гомологи ацетилена получают алкилированием ацетиленидов натрия или реактивов Гриньяра (полученных на основе ацетилена). Например:

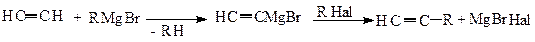
СВОЙСТВА АЛКИНОВ
Физические свойства
Температуры кипения, плавления алкинов обычно несколько ниже, чем у соответствующих алкенов и алканов. Ацетилен, метилацетилен – газы. Гомологи до С16 – жидкости, выше - твердые вещества. Все соединения бесцветны, нерастворимы в воде, растворяются в органических растворителях.
Общая характеристика химических свойств
Химические свойства алкинов обусловлены наличием тройной связи и подвижного (кислого) атома водорода, связанного с углеродом в sp-гибридизации. Алкины вступают в реакции электрофильного и, реже, нуклеофильного присоединения, а также в реакции замещения кислого атома водорода.
Кислые свойства ацетиленовых углеводородов невелики по сравнению с минеральными кислотами, но их кислотность в 1018 раз больше, чем кислотность водорода в алканах:
| Соединение | Константа диссоциации Ка |
| Н2О | 10-16 |
| НСºСН | 10-22 |
| СН3 –СН3 | 10-40 |
Причиной кислых свойств ацетилена является сильная поляризация связи С-Н благодаря тому, что в sp гибридной форме углеродный атом (ядро) значительно сильнее удерживает электроны, чем в sp2- и sp3-гибридизации.
Кроме того, для алкинов возможны реакции полимеризации, изомеризации и окисления.






