Токсичные элементы (в частности, некоторые тяжелые металлы) составляют обширную и весьма опасную в токсикологическом отношении группу веществ. Обычно рассматривают 14 элементов: Hg, Pb, Cd, As, Sb, Sn, Zn, Al, Be, Fe, Cu, Ba, Cr, Tl. Разумеется, не все перечисленные элементы являются ядовитыми, некоторые из них необходимы для нормальной жизнедеятельности человека и животных. Поэтому часто трудно провести четкую границу между биологически необходимыми и вредными для здоровья человека веществами.
В большинстве случаев реализация того или иного эффекта зависит от концентрации. При повышении оптимальной физиологической концентрации элемента в организме может наступить интоксикация, а дефицит многих элементов в пище и воде может привести к достаточно тяжелым и трудно распознаваемым явлениям недостаточности.
Зависимость вредного или полезного действия некоторых элементов от концентрации показана на рис. 11.3.
Для веществ, относящихся к так называемым супертоксикантам, плато, характеризующее норму, отсутствует (или очень короткое), а крутизна нисходящей ветви характеризует токсичность вещества (рис. 11.4).

Рис. 11.3. Зависимость влияния некоторых элементов от концентрации на организм человека:
I - угрожающее действие; II - дефицитное действие; III - физиологическое действие; IV - токсичное действие; V - летальное действие
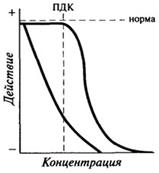
Рис. 11.4. Действие токсичных элементов
Загрязнение водоемов, атмосферы, почвы, сельскохозяйственных растений и пищевых продуктов токсичными металлами происходит за счет:
-выбросов промышленных предприятий (особенно угольной, металлургической и химической промышленности);
-выбросов городского транспорта (имеется в виду загрязнение свинцом от сгорания этилированного бензина);
-применения в консервном производстве некачественных внутренних покрытий и при нарушении технологии припоев;
-контакта с оборудованием (для пищевых целей допускается весьма ограниченное число сталей и других сплавов).
Для большинства продуктов установлены предельно-допустимые концентрации (ПДК) токсичных элементов, к детским и диетическим продуктам предъявляются более жесткие требования.
Наибольшую опасность из вышеназванных элементов представляют ртуть (Hg), свинец (Рb), кадмий (Cd).
Ртуть. Ртуть - один из самых опасных и высокотоксичных элементов, обладающий способностью накапливаться в растениях и в организме животных и человека, т. е. является ядом кумулятивного действия.
Токсичность ртути зависит от вида ее соединений, которые по-разному всасываются, метаболизируются и выводятся из организма. Наиболее токсичны алкилртутные соединения с короткой цепью - метилртуть, этилртуть, диметилртуть. Механизм токсического действия ртути связан с ее взаимодействием с сульфгидрильными группами белков. Блокируя их, ртуть изменяет свойства или инактивирует ряд жизненно важных ферментов. Неорганические соединения ртути нарушают обмен аскорбиновой кислоты, пиридоксина, кальция, меди, цинка, селена; органические - обмен белков, цистеина, аскорбиновой кислоты, токоферолов, железа, меди, марганца, селена.
Защитным эффектом при воздействии ртути на организм человека обладают цинк и, особенно, селен. Предполагают, что защитное действие селена обусловлено деметилированием ртути и образованием нетоксичного соединения - селено-ртутного комплекса.
О высокой токсичности ртути свидетельствуют и очень низкие значения ПДК: 0",0003 мг/м3 в воздухе и 0,0005 мг/л в воде. Безопасным уровнем содержания ртути в крови считают 50-100 мкг/л. Человек получает с суточным рационом около 0,05 мг ртути, что соответствует рекомендациям ФАО/ВОЗ.
В организм человека ртуть поступает в наибольшей степени с рыбопродуктами, в которых ее содержание может многократно превышать ПДК. Мясо рыбы отличается наибольшей концентрацией ртути и ее соединений, поскольку активно аккумулирует их из воды и корма, в который входят различные гидробионты, богатые ртутью. Например, хищные пресноводные рыбы могут содержать от 107 до 509 мкг/кг, нехищные пресноводные рыбы от 78 до 200 мкг/кг, а океанские нехищные рыбы от 300 до 600 мкг/кг Hg. Организм рыб способен синтезировать метил-ртуть, которая накапливается в печени. У некоторых видов рыб в мышцах содержится белок - металлотионеин, который с различными металлами, в том числе и с ртутью, образует комплексные соединения, способствуя тем самым накапливанию ртути в организме и передаче ее по пищевым цепям. У таких рыб содержание ртути достигает очень высоких концентраций: рыба-сабля содержит от 500 до 20 000 мкг/кг, а тихоокеанский марлин от 5000 до 14 000 мкг/кг. Для других продуктов характерно следующее содержание ртути (мкг/кг). В продуктах животноводства: мясо 6-20, печень 20-35, почки 20-70, молоко 2-12, сливочное масло 2-5, яйца 2-15; в съедобных частях сельскохозяйственных растений: овощи 3-59, фрукты 10-124, бобовые 8-16, зерновые 10-103; в шляпочных грибах 6-447, в перезрелых до 2000 мкг/кг, причем в отличие от растений в грибах может синтезироваться метилртуть. При варке рыбы и мяса концентрация ртути в них снижается, при аналогичной обработке грибов остается неизменной. Это различие объясняется тем, что в грибах ртуть связана с аминогруппами азотсодержащих соединений, в рыбе и мясе - с серосодержащими аминокислотами.
Свинец. Свинец один из самых распространенных и опасных токсикантов. История его применения очень древняя, что связано с относительной простотой его получения и большой распространенностью в земной коре (1,6 · 10-3%). Соединения свинца - Рb3О4 и PbSO4 - основа широко применяемых пигментов: сурика и свинцовых белил. Глазури, которые используются для покрытия керамической посуды, также содержат соединения РЬ. Металлический свинец со времен Древнего Рима применяют при прокладке водопроводов. В настоящее время перечень областей его применения очень широк: производство аккумуляторов, электрических кабелей, химическое машиностроение, атомная промышленность, производство эмалей, замазок, лаков, хрусталя, пиротехнических изделий, спичек, пластмасс и т. п. Мировое производство свинца составляет более 3,5 · 106т в год. В результате производственной деятельности человека в природные воды ежегодно попадает 500-600 тыс. т, а в атмосферу в переработанном и мелкодисперсном состоянии выбрасывается около 450 тыс. т, подавляющее большинство которого оседает на поверхности Земли. Основным источником загрязнения атмосферы свинцом являются выхлопные газы автотранспорта (260 тыс. т) и сжигание каменного угля (около 30 тыс. т). В тех странах, где использование бензина с добавлением тетраэтилсвинца сведено к минимуму, содержание свинца в воздухе удалось многократно снизить. Следует подчеркнуть, что многие растения накапливают свинец, который передается по пищевым цепям и обнаруживается в мясе и молоке сельскохозяйственных животных, особенно активное накопление свинца происходит вблизи промышленных центров и крупных автомагистралей.
Ежедневное поступление свинца в организм человека с пищей - 0,1- 0,5 мг, с водой - 0,02 мг. Содержание свинца (в мг/кг) в различных продуктах таково: фрукты 0,01-0,6; овощи 0,02-1,6; крупы 0,03-3,0; хлебобулочные изделия 0,03-0,82; мясо и рыба 0,01-0,78; молоко 0,01-0,1. В организме человека усваивается в среднем 10% поступившего свинца, у детей - 30-40%. Из крови свинец поступает в мягкие ткани и кости, где депонируется в виде трифосфата.
Механизм токсического действия свинца имеет двойную направленность. Во-первых, блокада функциональных SH-групп белков и, как следствие, - инактивация ферментов, во-вторых, проникновение свинца в нервные и мышечные клетки, образование лактата свинца, затем фосфата свинца, которые создают клеточный барьер для проникновения ионов Са2+. Основными мишенями при воздействии свинца являются кроветворная, нервная и пищеварительная системы, а также почки. Свинцовая интоксикация может приводить к серьезным нарушениям здоровья, проявляющимся в частых головных болях, головокружениях, повышенной утомляемости, раздражительности, ухудшении сна, мышечной гипотонии, а в наиболее тяжелых случаях к параличам и парезам, умственной отсталости. Неполноценное питание, дефицит в рационе кальция, фосфора, железа, пектинов, белков (или повышенное поступление кальциферола) увеличивают усвоение свинца, а следовательно - его токсичность. Допустимая суточная доза (ДСД) свинца составляет 0,007 мг/кг; величина ПДК в питьевой воде - 0,05 мг/л.
Мероприятия по профилактике загрязнения свинцом сырья и пищевых продуктов должны включать государственный и ведомственный контроль за промышленными выбросами свинца в атмосферу, водоемы и почву. Необходимо существенно снизить или полностью исключить применение тетраэтилсвинца в бензине, свинцовых стабилизаторах, изделиях из поливинилхлорида, красителях, упаковочных материалах и т. п.
Кадмий. Кадмий широко применяется в различных отраслях промышленности. В воздух кадмий поступает вместе со свинцом при сжигании топлива на ТЭЦ, с газовыми выбросами предприятий, производящих или использующих кадмий. Загрязнение почвы кадмием происходит при оседании кадмий-аэрозолей из воздуха и дополняется внесением минеральных удобрений: суперфосфата (7,2 мг/кг), фосфата калия (4,7 мг/кг), селитры (0,7 мг/кг). Заметно содержание кадмия и в навозе, где он обнаруживается в результате следующей цепи переходов: воздух-почва-растения-травоядные животные-навоз. В некоторых странах соли кадмия применяют в качестве антисептических и антгельминтных препаратов в ветеринарии. Все это определяет основные пути загрязнения кадмием окружающей среды, а следовательно, продовольственного сырья и пищевых продуктов.
Содержание кадмия (в мкг/кг) в различных продуктах выглядит следующим образом. Растительные продукты: зерновые 28-95, горох 15- 19, фасоль 5-12, картофель 12-50, капуста 2-26, помидоры 10-30, салат 17-23, фрукты 9-42, растительное масло 10-50, сахар 5-31, грибы 100- 500; в продуктах животноводства: молоко - 2,4, творог - 6,0, яйца 23- 250. Установлено, что примерно 80% кадмия поступает в организм человека с пищей, 20% - через легкие из атмосферы и при курении. С рационом взрослый человек получает до 150 мкг/кг и выше кадмия в сутки. В одной сигарете содержится 1,5-2,0 мкг Cd. Подобно ртути и свинцу, кадмий не является жизненно необходимым металлом. Попадая в организм, кадмий проявляет сильное токсическое действие, главной мишенью которого являются почки. Механизм токсического действия кадмия связан с блокадой сульфгидрильных групп белков; кроме того, он является антагонистом цинка, кобальта, селена, ингибирует активность ферментов, содержащих указанные металлы. Известна способность кадмия нарушать обмен железа и кальция. Все это может привести к широкому спектру заболеваний: гипертоническая болезнь, анемия, ишемическая болезнь сердца, почечная недостаточность и другие. Отмечены канцерогенный, мутагенный и тератогенные эффекты кадмия. По рекомендациям ВОЗ допустимая суточная доза (ДСД) кадмия - 1 мкг/кг массы тела.
Большое значение в профилактике интоксикации кадмием имеет правильное питание (включение в рацион белков, богатых серосодержащими аминокислотами, аскорбиновой кислоты, железа, цинка, селена, кальция), контроль за содержанием кадмия (полярографический, атомно-абсорбционный анализы) и исключение из рациона продуктов, богатых кадмием.
Алюминий. Первые данные о токсичности алюминия были получены в 70-х гг. XX в., и это явилось неожиданностью для человечества. Будучи третьим по распространенности элементом земной коры (8,8% массы земной коры составляет А1) и обладая ценными качествами, металлический алюминий нашел широкое применение в технике и быту. Поставщиками алюминия в организм человека является алюминиевая посуда, если она контактирует с кислой или щелочной средой, вода, которая обогащается ионами А13+ при обработке ее сульфатом алюминия на водоочистительных станциях. Существенную роль в загрязнении окружающей среды ионами А13+ играют и кислотные дожди. Не следует злоупотреблять содержащими гидроксид алюминия лекарствами: противогеморроидальными, противоартритными, понижающими кислотность желудочного сока. Как буферную добавку вводят гидроксид алюминия и в некоторые препараты аспирина и в губную помаду. Среди пищевых продуктов наивысшей концентрацией алюминия (до 20 мг/г) обладает чай.
Поступающие в организм человека ионы А13+ в форме нерастворимого фосфата выводятся с фекалиями, частично всасываются в кровь и выводятся почками. При нарушении деятельности почек происходит накапливание алюминия, которое приводит к нарушению метаболизма Са, Mg, P, F, сопровождающееся ростом хрупкости костей, развитием различных форм анемии. Кроме того, были обнаружены и более грозные проявления токсичности алюминия: нарушение речи, провалы в памяти, нарушение ориентации и т. п. Все это позволяет приблизить "безобидный", считавшийся нетоксичным до недавнего времени алюминий к "мрачной тройке" супертоксикантов: Hg, Pb, Cd.
Мышьяк. Мышьяк как элемент в чистом виде ядовит только в высоких концентрациях. Он принадлежит к тем микроэлементам, необходимость которых для жизнедеятельности организма человека не доказана, а его соединения, такие как мышьяковистый ангидрид, арсениты и арсенаты, сильно токсичны. Мышьяк содержится во всех объектах биосферы (в земной коре - 2 мг/кг, в морской воде - 5 мкг/кг). Известными источниками загрязнения окружающей среды мышьяком являются электростанции, использующие бурый уголь, медеплавильные заводы; он используется при производстве полупроводников, стекла, красителей, инсектицидов, фунгицидов и др.
Нормальный уровень содержания мышьяка в продуктах питания не должен превышать 1 мг/кг. Так, например, фоновое содержание мышьяка (мг/кг): в овощах и фруктах 0,01-0,2; в зерновых 0,006-1,2; в говядине 0,005-0,05; в печени 2,0; яйцах 0,003-0,03; в коровьем молоке 0,005- 0,01. Повышенное содержание мышьяка отмечается в рыбе и других гидробионтах, в частности в ракообразных и моллюсках. По данным ФАО/ВОЗ, в организм человека с суточным рационом поступает в среднем 0,05-0,45 мг мышьяка. ДСД - 0,05 мг/кг массы тела.
В зависимости от дозы мышьяк может вызывать острое и хроническое отравление, разовая доза мышьяка 30 мг - смертельна для человека. Механизм токсического действия мышьяка связан с блокированием SH-групп белков и ферментов, выполняющих в организме самые разнообразные функции.






