При небольших скоростях охлаждения кристаллизация чугунов происходит согласно стабильной диаграмме железо - графит с образованием в качестве одной из структурных составляющих графита. Это происходит потому, что температура эвтектического превращения по стабильному варианту диаграммы (линия Е¢C¢F¢) находится выше температуры эвтектического превращения для метастабильного варианта диаграммы (ЕСF).
Диаграмма состояния Fe - C нанесена на диаграмме Fe - Fe3C штриховыми линиями (рис. 67). Такой способ изображения системы Fe - C дает возможность сравнивать обе диаграммы.
Линия C'D' указывает изменение состава жидкой фазы во время кристаллизации первичного графита.
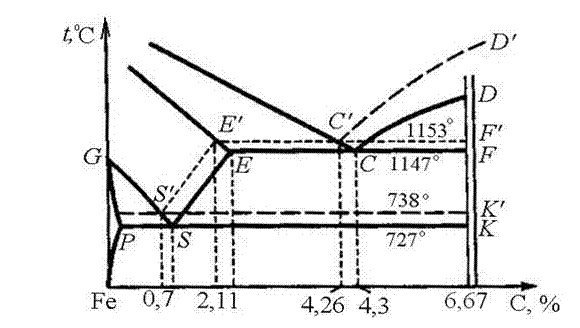
Рис. 67. Диаграммы состояния Fe – С
В системе Fe - C эвтектика образуется при 1153 °C. Она содержит 4,26 % С и состоит из аустенита и графита. Ее называют графитной эвтектикой. В образующейся согласно стабильной диаграмме аустенитно-графитной эвтектике графит является базовой фазой, на которой откладывается аустенит. Аустенитно-графитная эвтектика не имеет специального названия. В интервале 1153 – 738 °С из аустенита выпадает вторичный графит, при этом аустенит изменяет свой состав по линии E'S'.
Эвтектоидное превращение у сплавов системы Fe – С протекает при температуре 738 °С, причем эвтектоидная точка соответствует содержанию 0,7 % С. Структура эвтектоида состоит из феррита и графита. Вторичный графит, выделяющийся из аустенита, не образует самостоятельную структурную составляющую, а присоединяется к имеющемуся эвтектическому или первичному графиту.
Чтение диаграммы состояния Fe – С принципиально не отличается от чтения диаграммы состояния Fe – Fе3С, но во всех случаях из сплавов выпадает не цементит, а графит. Железоуглеродистые сплавы могут кристаллизоваться в соответствии с диаграммой Fe – Столько при весьма медленном охлаждении и наличии графитизирующих добавок (Si, Niи др.). Кристаллическая структура графита слоистая (рис. 68, а). Прочность и пластичность графита весьма низки.
В обычном сером чугуне, полученном при медленном охлаждении во время кристаллизации, графит похож на розетку с небольшим числом изогнутых лепестков. В сечении плоскостью шлифа такие лепестки имеют вид изогнутых пластинок, сужающихся на концах (рис. 68, б). Графит плохо полируется и, рассеивая свет, имеет темный оттенок на светлом фоне металлической матрицы нетравленого шлифа.
а б



Рис. 68. Структура графита: а - кристаллическая решетка графита;
б - пластинчатая форма графита в сером чугуне × 100
ГЛАВА 8. ВЛИЯНИЕ УГЛЕРОДА И ПОСТОЯННЫХ
ПРИМЕСЕЙ НА СВОЙСТВА СТАЛЕЙ
Стали - сложные по составу железоуглеродистые сплавы. Кроме железа и углерода - основных компонентов, а также возможных легирующих элементов, стали содержат некоторое количество постоянных и случайных примесей, влияющих на их свойства.
Углерод, концентрация которого в конструкционных сталях достигает 0,5 (0,6) %, оказывает определяющее влияние на их свойства. Степень его влияния зависит от структурного состояния стали, ее термической обработки.
После отжига углеродистые конструкционные стали имеют ферритно-перлитную структуру, состоящую из двух фаз - феррита и цементита. Количество цементита, который отличается высокой твердостью и хрупкостью, увеличивается пропорционально концентрации углерода. В связи с этим по мере повышения содержания углерода возрастают прочность и твердость, но снижаются пластичность и вязкость (рис. 69).

Рис. 69. Влияние углерода на механические свойства
горячекатаных сталей
Кроме того, углерод заметно повышает верхний порог хладноломкости, расширяя тем самым температурный интервал перехода стали в хрупкое состояние (рис. 70). Каждая 0,1 %С повышает верхнюю границу этого перехода примерно на 20°С. При 0,4 % С порог хладноломкости равен 0 °С, при большей концентрации углерода эта температура достигает 20 °С; такие стали менее надежны в работе.
Влияние углерода еще более значительно при неравновесной структуре стали. После закалки на мартенсит временное сопротивление сталей интенсивно возрастет по мере увеличения содержания углерода и достигнет максимума при 0,4 % С. При низком отпуске механические свойства сталей полностью определяются концентрацией углерода в твердом растворе.
Углерод изменяет технологические свойства стали. При увеличении его содержания снижается способность сталей деформироваться в горячем, особенно в холодном состояниях, затрудняется свариваемость.
Постоянные примеси в стали: Mn, Si, Р, а также газы О2, N2, H2.
Марганец - полезная примесь; вводится в сталь для раскисления и остается в ней в количестве 0,3-0,8 %. Марганец уменьшает вредное влияние серы и кислорода.
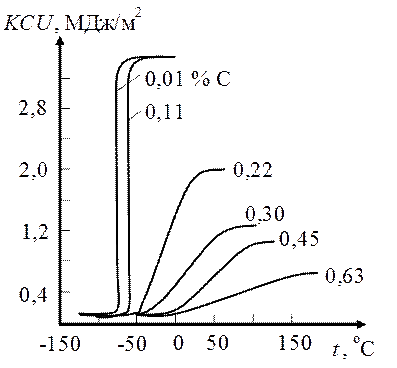
Рис. 70. Влияние содержания углерода на хладноломкость сталей
Кремний - полезная примесь; вводится в сталь в качестве активного раскислителя и остается в ней в количестве до 0,4 %, оказывая упрочняющее действие.
Сера - вредная примесь, вызывающая красноломкость стали - хрупкость при горячей обработке давлением. В стали она находится в виде сульфидов. Красноломкость связана с наличием сульфидовFeS, которые образуют с железом эвтектику, отличающуюся низкой температурой плавления (988 °С) и располагающуюся по границам зерен. При горячей деформации границы зерен оплавляются и сталь хрупко разрушается.
От красноломкости сталь предохраняет марганец, связывающий серу в сульфид MnS, который исключает образование легкоплавкой эвтектики.
Устраняя красноломкость, сульфид MnS, так же как и другие неметаллические включения (оксиды, нитриды и т. п.), служат концентраторами напряжений, снижают пластичность и вязкость сталей. Содержание серы в стали строго ограничивают. Положительное влияние серы проявляется лишь в улучшении обрабатываемости резанием.
Фосфор – вредная примесь. Он растворяется в феррите, упрочняет его, но вызывает хладноломкость – снижение вязкости по мере понижения температуры. Сильное охрупчивающее действие фосфора выражается в повышении порога хладноломкости (см. рис. 71). Каждая 0,01 % Р повышает порог хладноломкости на 25 °С. Хрупкость стали, вызываемая фосфором, тем выше, чем больше в ней углерода.
Фосфор - крайне нежелательная примесь в конструкционных сталях. Современные методы выплавки и переплавки не обеспечивают его полного удаления, поэтому основной путь его снижения - повышение качества шихты.
Кислород, азот и водород – вредные скрытые примеси. Их влияние наиболее сильно проявляется в снижении пластичности и повышении склонности стали к хрупкому разрушению. Кислород и азот растворяются в феррите в ничтожно малом количестве и загрязняют сталь неметаллическими включениями (оксидами, нитридами). Кислородные включения способствуют красно- и хладноломкости, снижают прочность. Повышенное содержание азота вызывает деформационное старение. Атомы азота в холоднодеформированной стали скапливаются на дислокациях, образуя атмосферы Коттрелла, которые блокируют дислокации. Сталь упрочняется, становится малопластичной. Старение особенно нежелательно для листовой стали (< 0,1 % С), предназначенной для холодной штамповки. Последствия старения - разрывы при штамповке или образование на поверхности листов полос скольжения, затрудняющих их отделку.

Рис. 71. Влияние фосфора на хладноломкость стали: 1 – 0,008 %; 2 – 0,06 %
Водород находится в твердом растворе или скапливается в порах и на дислокациях. Хрупкость, обусловленная водородом, проявляется тем резче, чем выше прочность материала и меньше его растворимость в кристаллической решетке. Наиболее сильное охрупчивание наблюдается в закаленных сталях с мартенситной структурой (см. дальше) и совсем отсутствует в аустенитных сталях.
Повышенное содержание водорода при выплавке стали может приводить к флокенам. Флокенами называют внутренние надрывы, образующиеся в результате высоких давлений, которые развивает водород, выделяющийся при охлаждении в поры вследствие понижения растворимости. Флокены в изломе имеют вид белых пятен, а на поверхности - мелких трещин. Этот дефект обычно встречается в крупных поковках хромистых и хромоникелевых сталей. Для его предупреждения стали после горячей деформации медленно охлаждают или длительно выдерживают при 250 °С. При этих условиях водород, имеющий большую скорость диффузии, не скапливается в порах, а удаляется из стали.
Наводороживание и охрупчивание стали возможны при травлении в кислотах, нанесении гальванических покрытий и работе в водородсодержащих газовых средах.
Случайные примеси - элементы, попадающие в сталь из вторичного сырья или руд отдельных месторождений. Из скрапа в стали попадает сурьма, олово и ряд других цветных металлов. Стали, выплавленные из уральских руд, содержат медь, из керченских - мышьяк. Случайные примеси в большинстве случаев оказывают отрицательное влияние на вязкость и пластичность сталей.
8.1. Влияние легирующих элементов на равновесную структуру сталей
В современном машино- и приборостроении широкое применение находят стали, в которых помимо железа, углерода и постоянных примесей содержатся специально вводимые добавки других элементов, чаще всего металлов. Эти добавки принято называть легирующими элементами; а стали соответственно легированными сталями.
В качестве легирующих элементов наиболее часто используют следующие: Сr, Ni, Mn, Si, Mo, W, V, Ti, Nb. Реже используются Co, Al, Cu, В и некоторые другие.
Почти все легирующие элементы изменяют температуры полиморфных превращений железа, температуру эвтектоидной и эвтектической реакций и влияют на растворимость углерода в аустените. Некоторые легирующие элементы способны, как и железо, взаимодействовать с углеродом и азотом, а также между собой или с железом, образуя промежуточные фазы - интерметаллиды.
Как было показано ранее, температуры равновесных превращений, совершающихся в железе и сталях в твердом состоянии, принято обозначать буквой А с соответствующим индексом. Температуры фазового равновесия указаны на диаграмме состояния Fe – Fе3С, поэтому обозначения связаны с линиями этой диаграммы (см. рис. 58).
Эвтектоидную температуру (линия PSK) обозначают А 1, температуру магнитного превращения (линия МО) - А 2, температуру линии GS - А 3, температуру полиморфного превращения Feg - Fed (линия NJ) - А 4, температуру линии SE - Аст.
Вследствие гистерезиса температуры превращений при нагреве всегда выше соответствующих температур при охлаждении, поэтому введена дополнительная индексация: при нагреве - индекс с, при охлаждении - индекс r.
Магнитное превращение не имеет гистерезиса.
Легирующие элементы при введении в сталь могут:
· образовывать с железом твердые растворы;
· растворяться в цементите, замещая атомы железа в решетке цементита, т. е образовывать так называемый легированный цементит или самостоятельные специальные карбиды;
· образовывать (при высоком содержании) с железом интерметаллические соединения.
Влияние легирующих элементов на полиморфные превращения железа
Все элементы, за исключением углерода, азота, водорода и отчасти бора, образуют с железом твердые растворы замещения. Растворяясь в железе, они влияют на положение точек А 3и A 4,определяющих температурную область существования α- и g-железа.
Легирующие элементы по влиянию на температурную область существования полиморфных модификаций железа можно разделить на две группы.
К элементам первой группы относятся никель и марганец, кобальт, палладий, платина; они понижают точку А 3 и повышают точку A 4. В результате этого на диаграмме состояния железо - легирующий элемент наблюдается расширение области g-фазы и сужение области существования α-фазы (рис. 72, а). Сплавы, имеющие концентрацию легирующего элемента больше указанной на рис. 72, а (точка n), не испытывают фазовых превращений g⇄α и при всех температурах представляют собой твердый раствор легирующего элемента в g-железе. Такие сплавы называются аустенитными.
Сплавы, частично претерпевающие превращение g⇄α, называют полуаустенитными.
Элементы второй группы (Сr, W, Mo, V, Si, A1 и др.) понижают точку А 4 и повышают точку А 3. Это приводит к тому, что при определенной концентрации легирующих элементов (см. точку m на рис. 72, б) критические точки, а точнее их интервалы А 4 и А 3, сливаются и область g-фазы полностью замыкается. При содержании легирующего элемента, большем, чем указано на рис. 78, в (точка m), сплавы при всех температурах состоят из твердого раствора легирующего элемента в α-железе. Такие сплавы называют ферритными, а сплавы, имеющие лишь частичное превращение, α ⇄g - полуферритными.
Влияние легирующих элементов на свойства феррита и аустенита
Легирующие элементы, растворенные в феррите, повышают его предел прочности (рис. 73, а), не изменяя существенно относительного удлинения (рис. 73, б), за исключением марганца и кремния при содержании их > 2,5 - 3,0 %.
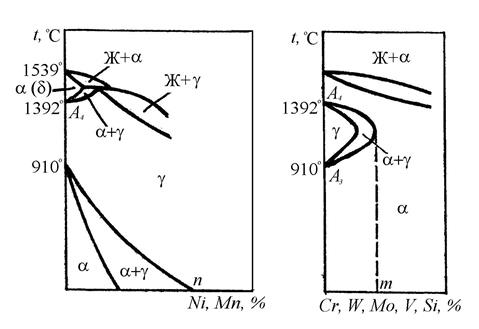
Рис. 72. Схемы влияния легирующих элементов на полиморфизм железа
Наиболее сильно упрочняют феррит, кремний, марганец и никель. Остальные элементы сравнительно мало изменяют прочность феррита.
Легирующие элементы при введении их в сталь в количестве > 1 - 2 % снижают ударную вязкость (см.рис. 73, в), а при более высоком содержании повышают порог хладноломкости. Исключение составляет никель, который, упрочняя феррит, одновременно увеличивает его ударную вязкость и понижает порог хладноломкости. Этим объясняются высокие вязкие свойства сталей, содержащих никель.
Легирующие элементы, растворяясь в g-железе, повышают прочность аустенита при нормальной и высоких температурах. Для аустенита характерен низкий предел текучести при сравнительно высоком пределе прочности. Аустенит парамагнитен, обладает большим коэффициентом теплового расширения. Аустенит легко наклёпывается, т. е. быстро и сильно упрочняется под действием деформации.
а б


в

Рис. 73. Влияние легирующих элементов на временное сопротивление разрыву (а), относительное удлинение (б) и ударную вязкость (в) феррита
Карбидная фаза в легированных сталях. По отношению к углероду легирующие элементы следует распределить на три группы:
· графитизирующие элементы: кремний, никель, медь и алюминий (эти элементы находятся в твердом растворе);
· нейтральные: кобальт, который в стали не образует карбидов и не вызывает графитизации;
· карбидообразующие расположены в следующем порядке по возрастающей степени сродства к углероду и устойчивости карбидных фаз: Fe → Mn → Cr → Мо → W → V → Zr → Ti.
Активность этих элементов как карбидообразователей тем сильнее, а устойчивость карбидов против диссоциации и растворения при нагреве в аустените тем больше, чем менее достроена электронная d -подгруппа соответствующего металла переходных групп.
При введении, например, ванадия в сталь, содержащую хром и молибден, более сильный карбидообразующий элемент ванадий при отсутствии достаточного количества углерода отнимает его сначала от карбида хрома, а затем от карбида молибдена. Хром и молибден в этом случае переходят в твердый раствор.
При малом содержании в стали таких карбидообразующих элементов, как Мn, Сr, W и Мо, последние растворяются в цементите, замещая в нем атомы железа. Состав цементита в этом случае может быть выражен формулой (Fe, М)3С, где М - легирующий элемент. Так, при растворении марганца в цементите образуются карбид (Fe, Mn)3C, при растворении хрома – карбид (Fe,Cr)3C.
Марганец может заместить в решетке цементита все атомы железа (Fe3C → Mn3C), хром – до 25 % (ат.), молибден -до 3 % (ат) и вольфрам лишь до 0,8 - 1,0 % (ат.). Более сильные карбидообразующие элементы (Ti, V, Nb, Zr) практически не растворяются в цементите и образуют самостоятельные специальные карбиды.
При повышенном содержании хрома, вольфрама, молибдена в зависимости от содержания углерода в стали могут образовываться специальные карбиды.
Карбиды, образующиеся в легированных сталях, можно разделить на две группы. К первой группе относятся карбиды типа М3С, М7С3, М23С6 и М6С (М4С), имеющие сложные кристаллические решетки. Карбиды этой группы сравнительно легко растворяются в аустените при нагреве.
Ко второй группе относятся карбиды типа МС: VC, TiC, NbC, TaC, в которых атомы металла расположены по типу кубической решетки; WC, в котором атомы металла расположены по типу объемноцентрированной кубической решетки; W2C и Мо2С, в которых атомы металла расположены по типу гексагональной решетки. Эти карбиды относятся к фазам внедрения. В отличие от карбидов первой группы, фазы внедрения в реальных условиях нагрева стали почти не растворяются в аустените. Фазы внедрения, как указывалось выше, обладают наиболее высокой твердостью и высокой температурой плавления. Чем дисперснее частицы карбидов в стали, тем выше ее прочность и твердость, так как частицы этих фаз повышают сопротивление пластической деформации.
Интерметаллические соединения. При высоком содержании легирующие элементы образуют с железом или друг с другом интерметаллические соединения. Примером таких соединений могут служить Fe7Mo6, Fe7W6, Fe3Nb2, Fe3Ti и др. Некоторые интерметаллические соединения относятся к фазам Лавеса (Fe2Nb, Fe2W, Fe2Mo, Cr2Ti и др.). В сплавах Fe - Сr и Fe – V образуется твердая и хрупкая σ-фазы, отвечающие соединению FeCr и FeV. В сплавах Fe - Сr - Мо (8 - 27 % Сrи > 5 % Мо), Fe - Cr - Ni - Мо (2-3 % Мо) может образовываться хрупкая χ-фаза состава Fe3CrMo (Fe36CrI2Mo10).
Наибольшее значение интерметаллидные фазы играют в малоуглеродистых железных сплавах, где их используют для получения эффекта дисперсионного твердения. σ- и χ-фазы охрупчивают сплав, поэтому их присутствие нежелательно.






