В периодической системе всего 14 s -элементов (включая водород и гелий). Это элементы I А и II А групп. Элементы I А группы – щелочные металлы Li, Na, K, Rb, Cs, Fr. Все они имеют на внешнем электронном уровне атома по одному электрону ns 1, сильно удаленному от ядра, с низким потенциалом ионизации. Всегда проявляют степень окисления +1.
Щелочные металлы активно окисляются кислородом воздуха при обычной температуре, поэтому их хранят под слоем керосина или бензина.
4Э+О2=2Э2О
Взаимодействуют с другими окислителями (галогенами, серой, фосфором), образуя соединения LiCl, Li2S, Li3P, NaBr, Na2S.
С азотом взаимодействует только литий при обычной температуре.
6 Li + N 2 =2 Li 3 N
Нагревая щелочной литий в струе газообразного водорода получают гидрид.
2 Li +Н2=2 LiH -.
С кислородом образуют оксиды, пероксиды.
Оксиды щелочных металлов Ме2О – кристаллические термически устойчивые вещества, при взаимодействии с водой образуют щелочи.
Ме2О + Н2О = 2МеО H
Гидроксиды щелочных металлов МеОН – твердые кристаллические вещества, легкоплавки, хорошо растворяются в воде с выделением тепла (кроме LiOH), полностью диссоциируют на ионы, сила оснований растет от Li к Fr.
ЭОH®Э++OH-
Более активно реагируют с водой непосредственно щелочные металлы.

Интенсивность взаимодействия с водой увеличивается в ряду Li - Cs, Rb и Cs реагируют с Н2О со взрывом.
Свойства гидроксидов
Все растворимы в воде – щелочи.
LiOH, NaOH, KOH, RbOH, CsOH, FrOH
реакционная способность увеличивается
1) реакция нейтрализации:
NaOH + HCl → NaCl + H 2 O
2) c кислотными оксидами:
NaOH + CO2→NaHCO3
2NaOH + CO2→Na2CO3 + H2O
3) самфотернымиоксидами:
2NaOH + BeO + H2O → Na2[Be(OH)4]
4) с неметаллами:
С l 2 + KOH → KCl + KClO + H 2 O
холодная
С l 2 + KOH → KCl + KClO 3 + H 2 O
горячая
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
5) с амфотерными металлами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
6) с солями:
2 AlCl 3 + 6 NaOH (недост.) → 2 Al (OH)3 + 6 NaCl
AlCl3 + 4 NaOH( избыт .) → Na[Al(OH)4] + 3NaCl
7) самфотернымигидроксидами:
Zn(OH)2 + 2NaOH →Na2[Zn(OH)4]
Щелочи жадно поглощают из воздуха влагу и СО2, т.е. содержат примесь Н2О (в виде кристаллогидратов NaOH×H2O) и карбонатов.
Твердые щелочи и их концентрированные растворы разрушают живые ткани, особенно опасно попадание частиц твердой щелочи в глаза (приводит к слепоте).
Не только с кислотами, но даже с водой большинство щелочных металлов реагируют со взрывом.
Биологическая роль щелочных металлов
Na и Li накапливаются во внеклеточной жидкости, калий, рубидий и цезий — во внутриклеточной, имеют близкое биологическое действие и чаще являются синергистами. Na и К, как правило, антагонисты, но могут и замещать друг друга; доказательство: при увеличении содержания Na в организме усиливается выведение почками калия.
Na и К — макроэлементы. Натрия (при массе 70 кг) содержится около 60 г (0,08 %). Из этого количества 44 % натрия находится во внеклеточной жидкости и 9 % – во внутриклеточной. Депонируется в костной ткани. В организме присутствует в виде иона.
Перенос К+ и Na+ через мембрану клеток осуществляется с помощью калий-натриевого насоса при гидролизе АТФ. При гидролизе 1 молекулы АТФ 3Na+ выводятся из клетки, а 2К+ поступают внутрь клетки.
Ионы калия и натрия участвуют в поддержании тонуса скелетных мышц и миокарда, возникновении мембранного потенциала, проведении нервных импульсов, в осмотических явлениях, являются активаторами ферментов.
Калия в организме содержится порядка 160 г (0,23 %), он играет роль в сокращении мышц, принимает участие в функционировании сердца, проведении нервных импульсов, обменных реакциях.
По содержанию в организме человека рубидий (10-5 %) и цезий (10-4 %) относятся к микроэлементам. Они постоянно содержатся в организме, роль пока не выяснена. Рубидий является полным аналогом калия и его синергистом во многих процессах (активация пируватфосфокиназы, альдегиддегидрогеназы и др.).
2. Водород (Hydrogenium – воду рождающий)
Имеет 3 изотопа: протий 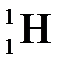 , дейтерий
, дейтерий 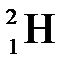 или Д и тритий
или Д и тритий 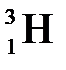 или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
Свободного водорода на Земле почти нет, в атмосфере его содержание не превышает 5×10-5%. Практически весь водород находится в связанном состоянии в составе многих минералов, углей, нефти, живых и растительных организмов, но самым распространенным его соединением является вода.
Водород – s-элемент, в различных вариантах периодической системы помещают его то в IA, вместе со щелочными металлами, то в VIIA вместе с галогенами, а иногда рассматривают отдельно.
Со щелочными металлами он сходен в том, что образует положительный ион Н+ и играет роль восстановителя.
Но с галогенами у него больше сходства: в гидридах активных металлов (CaH2, NaH), содержится ион Н-, подобный ионам Г- (NaCl, CaCl2). Молекулы водорода и галогенов двухатомны (Н2, Cl2, Br2). Для водорода, как и для фтора, хлора, характерны газообразное состояние и неметаллические свойства. Потенциалы ионизации водорода и галогенов близки. Атомы водорода легко замещаются атомами галогенов в органических соединениях. Поэтому вариант ПС, где Н возглавляет VII А группу более правилен.
Особенности водорода – единственный валентный электрон водорода находится непосредственно в зоне действия атомного ядра. Особенностями строения атома водорода обусловлено существование водородной связи.
Физические свойства. В обычных условиях водород – это самый легкий газ без цвета, запаха и вкуса, плохо растворим в воде.
Атомарный водород гораздо активнее молекулярного, для которого нужны дополнительные затраты энергии на расcпаривание электронов.
Химические свойства Н2
Водород легко соединяется с кислородом, горит на воздухе или в атмосфере чистого кислорода бледно-синим пламенем.
1) 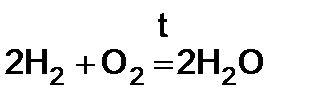
Если состав смеси приближается к стехиометрическому
(2 объема Н2 и 1 объем кислорода), то смесь называется “гремучим газом”, т.к. реакция имеет в этом случае взрывной характер.
Водородно-кислородное пламя, имеющее температуру 2500°-2800°С используют для плавления тугоплавких металлов и автогенной сварки.
2) 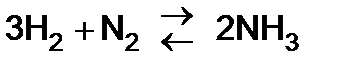 (при температуре 450 – 5000С и повышенном давлении, в присутствии катализатора).
(при температуре 450 – 5000С и повышенном давлении, в присутствии катализатора).
3) 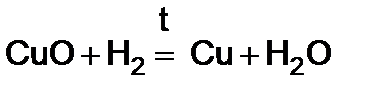 (при нагревании).
(при нагревании).
4)  (при повышении температуры и давления, в присутствии катализатора).
(при повышении температуры и давления, в присутствии катализатора).
5) 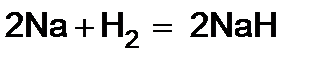 (с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н-(гидрид-ион).
(с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н-(гидрид-ион).
3. Вода и ее свойства. Экологическое и биологическое значение Н2О
Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
| 104°5’ |
Вода обладает аномально большой теплоемкостью равной 4,18, песок = 0,79, NaCl = 0,88 (Дж/(г×К).
Поэтому это имеет большое значение для жизни. При переходе от лета к зиме, ото дня к ночи она остывает медленно и является регулятором температуры на земном шаре.
Она имеет самую высокую температуру кипения в ряду
Н2О – Н2S – H2Se – H2Te,
Tкипения, °С 100 -60 -41 -2
Если от H2Te к Н2S температура кипения закономерно уменьшается, то при переходе от Н2S к Н2О резко увеличивается. Это объясняется наличием водородной связи между молекулами воды, вследствие кулоновского взаимодействия положительно заряженного атома водорода одной молекулы и электроотрицательным атомом кислорода другой
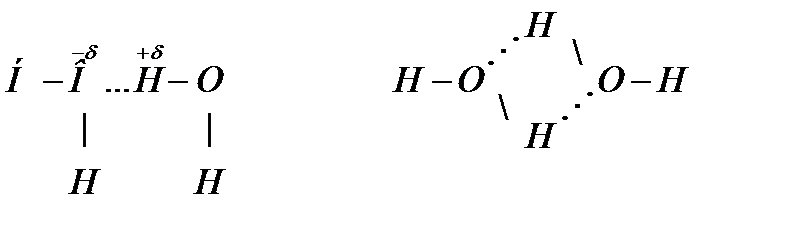
Такое взаимодействие затрудняет отрыв молекул друг от друга, т.е. уменьшает их летучесть, а, следовательно, повышает температуру кипения.
Химические свойства Н2О
1. При температуре выше 1000°С диссоциация водяного пара, но равновесие сдвинуто в сторону воды.
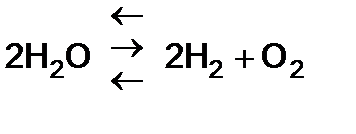 .
.
2. Оксиды металлов и неметаллов соединяются с водой, образуя основания и кислоты (гидрооксиды).
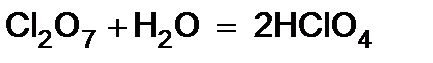
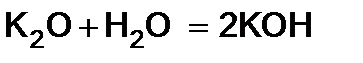
3. Некоторые соли образуют с водой кристаллогидраты. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения, т.е. за счет ион -дипольного взаимодействия.
Задания для самоконтроля:
1. Общая характеристика элементов I группы, главной подгруппы периодической системы Д. И. Менделеева.
2. Характеристика натрия и калия, исходя из их положения в периодической системе, с точки зрения теории строения атома, степени окисления, распространение в природе, получение, свойства.
3. Соединения натрия и калия. Оксиды, гидроксиды, соли
4. Качественные реакции на катионы кальция и магния.
5. Биологическая роль. Применение в медицине и народном хозяйстве соединений натрия и калия.
Задания для самостоятельной работы:
1. Почему натрий и литий накапливаются во внеклеточной жидкости, а калий, рубидий и цезий – во внутриклеточной?
2. Одинаковы ли концентрации ионов калия и натрия во внутриклеточной и внеклеточной жидкости? Каким образом поддерживается такое состояние?
3. Зачем человеку необходимо употреблять поваренную соль?
4. Препарат какого элемента можно использовать при избытке калия в организме (гиперкалиемии)? Почему?
5. Какие препараты натрия и для каких целей используются в медицине? Ответ обоснуйте.
6. Ионы каких s-элементов могут вызвать гипокалиемию? Почему?
7. Рассчитайте массы компонентов, необходимых для приготовления 2 л изотонического раствора. Плотность раствора принять равной единице. Какую воду необходимо при этом использовать? Почему?
8. Формирование костной ткани в организме является результатом протекания взаимно противоположных реакций осаждения и растворения, протекающих в остеобластах и остеокластах. Назовите основной компонент костной ткани и изобразите схему процесса минерализации и деминерализации.
9При действии избытка воды на 1,38 г металла выделился газ, занимающий при н.у. объем 672 мл. Определите металл.
10. Осуществите цепочку превращений:
Хлорид натрия  карбонат натрия
карбонат натрия  хлорид натрия
хлорид натрия  гидроксид натрия
гидроксид натрия  натрий
натрий  сульфат натрия
сульфат натрия  хлорид натрия
хлорид натрия
Хлорид натрия  гидроксид натрия
гидроксид натрия  карбонат натрия
карбонат натрия  гидроксид натрия
гидроксид натрия  натрий
натрий  нитрат натрия.
нитрат натрия.
Подготовьте доклад, реферат или презентацию на тему:
· «Калийные и натриевые удобрения».
· Биологическая роль. Применение в медицине и народном хозяйстве соединений натрия и калия.
Список рекомендуемой литературы:
1. Пустовалова Л.М., Никанорова И.Е. Неорганическая химия. Ростов-н/Д. Феникс, 2005
2. Бабков, А.В. Общая и неорганическая химия [Текст]: учебник / А.В. Бабков, Т.И. Барабанова, В.А. Попков. – М.: ГЭОТАР-Медиа, 2014. – 384 с.






