Детекторы изображений. Фиксируют в ходе процедуры анатомические снимки с высоким разрешением. Эти непрерывно формируемые изображения сравниваются с полученными ранее оцифрованными рентгенограммами с целью определения положения пациента в реальном времени. На основе этой информации робот-манипулятор немедленно реагирует на любое обнаруженное движение пациента.
Источники РИ. В течение всей процедуры с помощью источников РИ малой мощности выполняются снимки с целью определения положения ориентиров, формируемых костями. Для обеспечения наивысшей точности снимков источники рентгеновского излучения и детекторы изображений жестко фиксированы.
Процесс лечения начинается, как и в случае гамма-ножа, со сканирования. Перед лечением пациент проходит процедуру формирования изображения, в процессе которой определяются размер, форма и расположение опухоли. После сканирования данные изображения в цифровом виде передаются в рабочую станцию планирования лечения. Лечащий врач определяет точный размер, форму и расположение опухоли, подлежащей облучению, а также окружающие опухоль жизненно важные органы, облучения которых следует избегать. Затем квалифицированный врач или специалист по радиационной онкологии с помощью программного обеспечения разрабатывает план лечения, чтобы обеспечить достаточную селективность облучения. В рамках плана лечения программным путем автоматически определяются интенсивность, длительность и геометрия облучения.
Во время процедуры лечения пациент удобно лежит на процедурном столе с автоматическим позиционированием. Анестезия не требуется, поскольку процедура безболезненная и неинвазивная. Обычно процедура длится от 30 до 90 минут. За это время с различных направлений испускается от 100 до 200 доз облучения (аналогичных одному источнику гамма-ножа, см. рис. 3.25) длительностью по 10...15 секунд. Перед излучением каждой дозы снимаются одновременно два рентгеновских снимка, которые сравниваются с результатом изначального томографического сканирования. Благодаря системе контроля по изображению перемещения опухоли и пациента в ходе процедуры постоянно отслеживаются с целью осуществления необходимых корректирующих действий по обеспечению точности наведения. Обычно пациент может покинуть медицинское учреждение сразу по окончании процедуры.
6.7. Применение рентгеновских лазеров и g -лазеров
Рентгеновский лазер или лазер на свободных электронах (ЛСЭ) — один из многих перспективных лазеров, в основе работы которых лежит взаимодействие электронов высокой энергии с магнитным полем. В отличие от газовых, жидкостных или твердотельных лазеров, где электроны возбуждаются в связанных атомных или молекулярных состояниях — у лазера на свободных электронах источником излучения является пучок свободных электронов, проходящий сквозь ряд расположенных специальным образом магнитов — ондулятор (вигглер), заставляющий электронный пучок двигаться по синусоидальной траектории, теряя энергию, которая преобразуется в излучение (см. §2.1). На торцах вигглера установлены зеркала, образующие резонатор (рис. 6.28). Меняя энергию электронного пучка, а также параметры вигглера (напряженность магнитного поля и расстояние между магнитами), можно в широких пределах менять частоту лазерного излучения, вырабатываемого ЛСЭ. Это главное отличие ЛСЭ от лазеров других систем.
 |
Заметим, что длина волны излучения лазера на свободных электронах не обязана попадать в рентгеновский диапазон. Принцип работы такого лазера, основанный на взаимодействии излучения с электронным пучком, хорошо известен в электронике СВЧ и реализован в ряде приборов, появившихся задолго до лазера (например, лампы бегущей волны и подобные им). Если электрон пролетает через некоторую пространственно-периодическую систему, характеризуемую периодом
 , со скоростью v, то на него действует периодическая сила с временным периодом
, со скоростью v, то на него действует периодическая сила с временным периодом  . Следовательно, ускорение электрона меняется периодически с частотой
. Следовательно, ускорение электрона меняется периодически с частотой 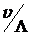 . Этому соответствует движение по пространственно-периодической траектории. При существенно дорелятивистских скоростях частота излучения равна частоте периодического движения
. Этому соответствует движение по пространственно-периодической траектории. При существенно дорелятивистских скоростях частота излучения равна частоте периодического движения 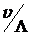 . Для макроскопических пространственных периодов
. Для макроскопических пространственных периодов 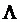 длина волны излучения
длина волны излучения  в нерелятивистском случае соответствует радиодиапазону. Так что ничего особо привлекательного с точки зрения ионизирующих излучений (в отличие от классических рентгеновских трубок) в этом случае не наблюдается. Видимо, это явилось главной причиной того, что лазеры на свободных электронах длительное время после своего появления (в микроволновом диапазоне подобные приборы, работающие на циклотронном резонансе, появились еще в 50-е годы в СССР, а в ИК диапазоне такой лазер был впервые создан в США в 1977 г. на базе Стэнфордского линейного ускорителя электронов) не привлекали внимания биологов и медиков.
в нерелятивистском случае соответствует радиодиапазону. Так что ничего особо привлекательного с точки зрения ионизирующих излучений (в отличие от классических рентгеновских трубок) в этом случае не наблюдается. Видимо, это явилось главной причиной того, что лазеры на свободных электронах длительное время после своего появления (в микроволновом диапазоне подобные приборы, работающие на циклотронном резонансе, появились еще в 50-е годы в СССР, а в ИК диапазоне такой лазер был впервые создан в США в 1977 г. на базе Стэнфордского линейного ускорителя электронов) не привлекали внимания биологов и медиков.Ситуация существенно изменяется, если радикально увеличить энергию электрона и работать в заведомо релятивистской области. Релятивистский эффект Доплера приводит к резкому уменьшению длины волны излучения по сравнению с характерными размерами излучающей системы. При скорости электрона, близкой к скорости света (v £ c), в силу релятивистского сокращения масштаба имеем 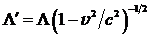 , при этом частота периодического воздействия на электрон в сопутствующей системе координат увеличивается до значения
, при этом частота периодического воздействия на электрон в сопутствующей системе координат увеличивается до значения  , где появляется релятивистский фактор
, где появляется релятивистский фактор 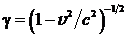 .В лабораторной системе координат обратное лоренцево преобразование приводит к релятивистскому доплеровскому увеличению частоты излучения в
.В лабораторной системе координат обратное лоренцево преобразование приводит к релятивистскому доплеровскому увеличению частоты излучения в 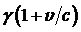 раз. Для ультрарелятивистских электронов (v» c) можно принять
раз. Для ультрарелятивистских электронов (v» c) можно принять 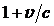 » 2, и в результате длина волны тормозного излучения в лабораторной системе координат может быть найдена по формуле:
» 2, и в результате длина волны тормозного излучения в лабораторной системе координат может быть найдена по формуле:
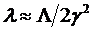 (6.10)
(6.10)
Для оценки величины γ удобна известная релятивистская связь между энергией 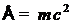 и массой ультрарелятивистской частицы
и массой ультрарелятивистской частицы 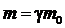 , где
, где 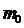 — масса покоя частицы. В физике электронных ускорителей энергию электрона принято измерять в электрон-вольтах, пользуясь соотношением
— масса покоя частицы. В физике электронных ускорителей энергию электрона принято измерять в электрон-вольтах, пользуясь соотношением 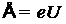 , где e — заряд электрона, U — разность потенциалов того электростатического поля, которое необходимо приложить, чтобы разогнать электрон до скорости v. Тогда для релятивистского фактора имеем:
, где e — заряд электрона, U — разность потенциалов того электростатического поля, которое необходимо приложить, чтобы разогнать электрон до скорости v. Тогда для релятивистского фактора имеем:
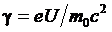 (6.11)
(6.11)
Пользуясь формулами (6.10) и (6.11), нетрудно оценить энергию электронов, при которой длина волны излучения попадет в рентгеновский диапазон. Следовательно, возможность создания соответствующих лазеров определяется как конструкцией вигглера, так и энергией пучка электронов, которые должны быть ультрарелятивистскими.
Устройство вигглера. Вигглер представляет собой магнит, создающий сильное поперечное (как правило, вертикальное) знакопеременное магнитное поле. Его можно представить себе как последовательность коротких дипольных магнитов, полярность каждого следующего из которых противоположна предыдущему. Вигглер устанавливается в прямолинейный промежуток электронного синхротрона, и ультрарелятивистский пучок проходит в нём по извилистой траектории, близкой к синусоиде, излучая фотоны в узкий конус вдоль оси пучка (см. рис.6.28). Типичный диапазон длин волн синхротронного излучения, генерируемого вигглером, — от жёсткого ультрафиолета до мягкого рентгена. Вигглер, помещённый в резонатор (например, два соосных зеркала), — простейшая модель лазера на свободных электронах. Магниты, из которых собран вигглер, могут быть обычными электромагнитами, сверхпроводящими, либо постоянными. Типичное магнитное поле вигглера — до 10 Тл. Выходная мощность получаемого излучения зависит как от тока пучка, так и от поля, а также от количества полюсов вигглера. Стремление получить как можно более коротковолновое излучение упирается в значительные конструктивные и технологические трудности, что приводит к большим затратам на разработку и изготовление рентгеновских лазеров. Так, первый в мире рентгеновский лазер, работающий в области жесткого ультрафиолета (0,15 нм), обошелся в 420 млн. долл. Сообщение о запуске такого лазера (LCLS — Lin e a r Coherent Light Source) появилось в апреле 2009 г. Он был создан в той же Стэнфордской национальной лаборатории, что и первый лазер ИК диапазона в 1977 г. Наиболее сложной и дорогостоящей частью установки явился уникальный линейный ускоритель электронов (рис. 6.29)
 |
На данный момент LCLS является источником самого коротковолнового импульсного рентгеновского излучения. На данную установку возлагаются большие надежды в части исследования атомно-молекулярной структуры вещества, особенно для анализа биоструктур на уровне отдельных белковых молекул и ДНК. Руководитель проекта Джон Галайда (John Galayda) охарактеризовал данный лазер как «наиболее технически сложный источник излучения из всех, что когда-либо приходилось создавать человеку». Экспериментальные исследования на этом лазере начались с сентября 2009 г.
На сегодня подобные установки создаются в Японии и в Европе, причем международный европейский проект предусматривает участие России. Проектируемая установка обещает еще более впечатляющие характеристики, чем LCLS, и получила аббревиатуру XFEL (X-Ray Free Electron Laser).
Рентгеновский лазер на свободных электронах XFEL длиной 3,4 км будет построен под землей в крупнейшем в Германии синхротронном центре DESY (г. Гамбург). Россия станет второй после Германии страной по объему инвестиций в международный проект, который позволит выйти на новый уровень в исследованиях в области физики, химии, материаловедения, наук о жизни, биомедицине и др. Для запуска проекта и обеспечения выполнения обязательств Российской Федерации предусмотрено определить Российскую корпорацию нанотехнологий в качестве организации-участника от России. В течение 2009...2016 годов РОСНАНО внесет в управляющую компанию проекта от имени Российской Федерации 250 млн. евро.
Проект создания в Европе рентгеновского лазера на свободных электронах начал разрабатываться в начале 1990-х. У истоков проекта стояли российские ученые из новосибирского Института ядерной физики. На сегодняшний день в рамках межправительственных соглашений в проекте участвуют 14 стран: Германия, Россия, Великобритания, Венгрия, Греция, Дания, Италия, Испания, КНР, Польша, Словакия, Франция, Швеция и Швейцария. Общая стоимость создания установки оценивается более чем в 1 млрд. евро. Сооружение, запуск и последующая эксплуатация установки возлагаются на управляющую компанию, создаваемую на территории Германии. Ее участником от России выступит Российская корпорация нанотехнологий, за которой будет закреплена доля, обеспечивающая контроль над наиболее существенными вопросами корпоративного управления (назначение директоров, распределение финансовых средств, использование пучкового времени лазера и другое). Кроме того, участниками проекта определены критерии научного применения установки, а также принципы охраны и регулирования прав интеллектуальной собствен-ности. Использование главного ресурса установки — пучкового времени — будет осуществляться с учетом вклада каждой страны в создание установки.
Полученные в рамках проекта XFEL ультракороткие рентгеновские импульсы когерентного излучения позволят буквально поэтапно «видеть» молекулярные и атомарные процессы в материалах и биомолекулах. Эксплуатация XFEL открывает огромные возможности для изучения химических и физических процессов в молекулах, а также создания новых материалов и наноструктур. Научное руководство реализацией проекта, а также формирование научно-исследовательской программы использования XFEL с российской стороны возложено на РНЦ «Курчатовский институт». По словам управляющего директора, члена правления РОСНАНО Д. Гордина, «российские ученые и инженеры получат доступ к исследовательскому инструменту, аналоги которого отсутствуют не только в России, но и в мире. Кроме того, российские научные и производственные организации будут активно задействованы при изготовлении оборудования и материалов установки». Россия стала участником проекта по инициативе директора РНЦ «Курчатовский институт», члена наблюдательного совета РОСНАНО М. Ковальчука и заместителя директора ИЯФ СО РАН Г. Кулипанова. Благодаря участию в проекте российские ученые смогут проводить уникальные эксперименты, тем самым обеспечивая возможность атомно-молекулярного конструирования новых биоматериалов.
В частности, с помощью рентгеновских лазеров могут быть решены проб-лемы количественного анализа содержания тяжелых элементов в биообъектах, для контроля динамики метаболических процессов на молекулярном уровне, флуороскопии нанообъектов биологической природы, но особый интерес представляет применение рентгеновских лазеров в непосредственном наблюдении процессов в живых биообъектах. Отклик биообъектов на короткие импульсы рентгеновского излучения может помочь найти ответы на ряд вопросов, много лет стоящих перед биологами, например:
а) каково расположение растворённых ферментов в цитоплазме, т.е. являются ли они свободно плавающими или связаны с цитоскелетом?
б) присутствуют ли белковые агрегированные структуры в живых клетках?
в) каким образом цитоскелет организует структуру липидных мембран?
Временнóе разрешение на микросекундном уровне позволяет визуали-зировать морфологию клетки и реорганизацию цитоскелета во время деления. Благодаря когерентности излучения рентгеновских лазеров с их помощью мож-но получать трёхмерные голографические изображения с пространственным разрешением до единиц нанометров, например, структуры цитоскелета.
Таким образом, рентгеновские лазеры позволят изучать клетку с высоким пространственным разрешением и в живом виде.
Гамма-лазер, в отличие от рентгеновских, пока еще не создан в виде эксплуатируемой установки, хотя теоретические и лабораторные исследования возможностей его создания ведутся давно.
Под гамма-лазером понимается источник когерентного электромагнитного излучения γ-диапазона. Часто также используются сокращения «гразер» или «газер», являющиеся аббревиатурой английской фразы "Gamma Ray Amplification by Stimulated Emission of Radiation" («усиление γ-излучения с помощью вынужденного излучения»). Получение генерации в γ-диапазоне открыло бы новые перспективы в исследовании биологических структур на молекулярном и субмолекулярном уровнях.
Идея гамма-лазера возникла в связи с появлением лазера (источника когерентного излучения оптического диапазона) и открытием эффекта Мёссбауэра, заключающегося в излучении γ-квантов без отдачи. Открытие эффекта Мёссбауэра поставило вопрос о реализации вынужденного излучения системы возбуждённых ядер. Впервые на эту возможность указал советский физик Л. А. Ривлин в 1961 г. В 1961...65 гг. одновременно и независимо друг от друга несколько советских и и американских групп физиков занимались разработкой схем гамма-лазера на эффекте Мёссбауэра. Для создания активной среды предполагалось использовать радиохимические методы выделения долгоживущих ядерных изомеров с последующим введением их в кристалл (кристаллическую матрицу) или выращиванием из этих ядер активных кристаллов.
Для возникновения нарастающей лавины когерентных γ-квантов необходимо, во-первых, чтобы в среде было больше возбуждённых ядер, чем невозбуждённых, и, во-вторых, чтобы вероятность вынужденного излучения была выше вероятности поглощения или рассеяния γ-квантов ядрами среды. Tаким образом, возникшее в среде γ-излучение (в результате спонтанного распада отдельных ядер) будет усиливаться, если концентрация возбуждённых ядер превышает некоторое пороговое значение N*, определяющееся из условия равенства коэффициента μ резонансного вынужденного излучения (или коэффициента квантового усиления) и коэффициента δ нерезонансных потерь энергии.
Коэффициент усиления μ определяется формулой:
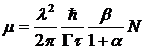 (6.12)
(6.12)
Здесь λ- длина волны γ-излучения, Г — спектральная ширина резонансного перехода ядра в кристалле, τ — время жизни ядра в изомерном состоянии, α — коэффициент внутренней конверсии, β — коэффициент ветвления, учитывающий возможность перехода ядра на другие уровни, лежащие выше нижнего рабочего, если генерация идёт с более высоких уровней, чем первый возбуждённый (β = 1, если генерация идёт с первого возбуждённого уровня ядра). Нерезонансные потери в области энергий γ-квантов, при которых вероятность эффекта Мёссбауэра велика, определяются в основном фотоэффектом, т. е. процессом, при котором атом поглощает γ-квант и испускает электрон. Для лёгких матриц μ» 10 см-1. Полагая в (3.12) λ = 10 нм, α = β» 1, получим для N* следующее значение:
N * (см-3) = 1,3×1017 Gt (6.13)
Таким образом, при естественной ширине линии Gt = 1 критическая плотность возбуждённых изомерных ядер составляет незначительную часть плотности атомов в твёрдом теле (~1023 атом/см3). Из (6.13) видно, что немёссбауэровский вариант γ- лазера нереален. Действительно, для ядер со средними атомными номерами Z доплеровское уширение линии GД = 1013 с-1. Следовательно, согласно (6.13), пороговая плотность изомерных ядер выходит за пределы плотности твёрдого тела уже при τ = 10-7 с.
С ростом энергии γ-квантов вероятность безотдачного излучения резко падает. Вероятность эффекта Мёссбауэра близка к 1 только при значениях энергии перехода 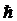 w» 150 кэВ. Это ограничивает верхнее значение величины энергии γ-квантов, достижимое в γ-лазере на ядерных переходах. Нижнее значение энергии радиационых переходов ядер, пригодных для генерации γ-излучения, определяется быстрым ростом сечения фотоэффекта с уменьшением энергии γ-квантов. Поэтому область пригодных энергий радиационных переходов ядер определяется неравенством: 10 кэВ <
w» 150 кэВ. Это ограничивает верхнее значение величины энергии γ-квантов, достижимое в γ-лазере на ядерных переходах. Нижнее значение энергии радиационых переходов ядер, пригодных для генерации γ-излучения, определяется быстрым ростом сечения фотоэффекта с уменьшением энергии γ-квантов. Поэтому область пригодных энергий радиационных переходов ядер определяется неравенством: 10 кэВ < 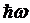 <150 кэВ.
<150 кэВ.
 Предложенные модели γ-лазера на ядерных переходах можно разделить на две группы: гамма-лазер на короткоживущих (
Предложенные модели γ-лазера на ядерных переходах можно разделить на две группы: гамма-лазер на короткоживущих (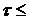 10-5 с) и долгоживущих (
10-5 с) и долгоживущих (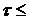 10-5 с) изомерах. Граничное значение
10-5 с) изомерах. Граничное значение 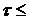 =10-5 с обусловлено тем, что при
=10-5 с обусловлено тем, что при 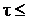 10-5 с ширина мёссбауэровской линии γ-перехода близка к естественной ширине, когда выполнено соотношение Gt» 1. При
10-5 с ширина мёссбауэровской линии γ-перехода близка к естественной ширине, когда выполнено соотношение Gt» 1. При 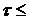 10-5 с ширина линии не зависит от времени жизни и равна приблизительно 105 Гц, следовательно, Gt >> 1 (рис. 6.30). Последнее обстоятельство и определило основные трудности первых моделей g-лазера на долгоживущих изомерах.
10-5 с ширина линии не зависит от времени жизни и равна приблизительно 105 Гц, следовательно, Gt >> 1 (рис. 6.30). Последнее обстоятельство и определило основные трудности первых моделей g-лазера на долгоживущих изомерах.
Неизбежные нарушения правильности (идеальности) кристаллической решётки, и другие неидеальности кристалла приводят к уширению линий γ-резонанса. Кроме того, причиной уширения линии, неустранимой даже в идеальных кристаллах, является магнитное диполь-дипольное взаимодействие ядер, т. к. спины возбуждённых и невозбуждённых ядер различны, а координаты ядер, высветившихся в процессе генерации, случайны.
Значительный прогресс в разработке схем гамма-лазеров на долгоживущих изомерах был достигнут благодаря работам P. В. Хохлова с сотрудниками, которые предложили применить методы ЯМР-спектроскопии твёрдых тел для сужения линии γ-резонанса. Использование специально подобранных последовательностей радиочастотных импульсов с частотой, соответствующей переходам между магнитными подуровнями рабочих уровней ядер, позволяет подавить эти механизмы уширения линии. Быстрая переориентация ядер радиочастотным полем ослабляет диполь-дипольное взаимодействие, усредняя его величину, имеющую различные знаки при различной ориентации спинов. Одновременно ослабляется магнитное взаимодействие ядер с соседними атомами и взаимодействие электрических квадрупольных моментов ядер с внутрикристаллическими электрическими полями. Tаким образом, искусственное сужение линии γ- резонанса позволяет приблизиться к созданию гамма-лазера на долгоживущих изомерах.
В схемах на короткоживущих изомерах основная проблема — механизм возбуждения (накачка) ядер. Накачка должна быть интенсивной и селективной. Эффективно возбуждая рабочие ядра, она должна минимально возмущать состояние решётки кристалла. Наиболее близки к выполнению указанных требований следующие виды возбуждения ядер: захват тепловых нейтронов, возбуждение синхротронным излучением, характеристическим излучением, рентгеновским излучением и т.п., а также возбуждение пучком заряженных частиц (адронов).
Исследовалась также возможность совмещения преимуществ двух схем: некритичности параметров накачки в схеме на долгоживущих изомерах и малости произведения Gt в схеме на короткоживущих изомерах. Это можно, например, осуществить при наличии двух близко лежащих ядерных уровней с различными временами жизни и энергетической разницей, соответствующей энергии кванта оптического или УФ-лазера, который может стимулировать переход с долгоживущего ядерного подуровня на короткоживущий. Tаким образом, накачка осуществляется на долгоживущем переходе, а генерация — на короткоживущем. Такая схема подобна традиционной лазерной трёхуровневой схеме с той разницей, что в последней накачивается широкий короткоживущий уровень, а генерация идёт на более долгоживущем узком переходе.
Применение рентгеновских и гамма-лазеров в медицине открывает совершенно новые горизонты возможностей, сравнимые с прорывами, совершенными в свое время открытием Вильгельма Конрада Рентгена и появлением ядерной медицины как самостоятельного направления. Эти перспективы представляются настолько захватывающими, что неимоверная на сегодня дороговизна установок в конечном счете окупится их уникальными возможностями.
[1] Внесистемная единица эффективного сечения ядерных процессов: 1 барн = 10-24 см2 [40]
[2] Паллиативная медицина – медицина тяжелых и неизлечимых заболеваний, преследующая целью не выздоровления больного, а возможного облегчения его состояния.






