6.4.5. Установки для однофотонной эмиссионной компьютерной томографии
В современных клинических учреждениях наблюдается интенсивный переход от применения классических гамма-камер к установкам для однофотонной эмиссионной компьютерной томографии (ОФЭКТ). Эти установки по существу являются теми же гамма-камерами, но с качественно новыми функциональными возможностями. ОФЭКТ-камеры, наряду с возможностью работы в обычном режиме (планарной сцинтиграфии), позволяют получать послойные изображения распределения РФП в параллельных друг другу плоскостях, перпендикулярных чувствительной поверхности детектора, с последующей реконструкцией трехмерного (3 D) изображения. Внешний вид некоторых ОФЭКТ-камер показан на рис. 6.8.
Для всех ОФЭКТ-камер характерно получение изображения всего тела. Конструкция штатива делается подвижной, обеспечивающей вращение вокруг продольной оси тела пациента, лежащего на специальном консольном ложе. Реконструкция 3 D -изображения производится по набору двумерных проекций (обычно от 32 до 128), представляющих собой обычное планарное изобра-жение, полученное при определенном угловом положении блока детектиро-вания на траектории его перемещения вокруг тела пациента. Полученные при каждом положении данные накапливаются в памяти компьютера, после чего программное обеспечение компьютера проводит реконструкцию 3 D -изображе-ния распределения РФП в организме подобно рентгеновской томографии.
 |
Основное отличие томографической гамма-камеры (ТГК) от рентгеновского томографа состоит в том, что нужное сечение выделяется не механически (позиционированием детекторов), а математически. Благодаря этому за один оборот детектора на 360о в памяти системы накапливаются все данные, необходимые для восстановления любого сечения в пределах поля зрения детектора. Эта особенность ТГК имеет принципиально важное значение для случаев, когда местоположение патологии априори неизвестно.
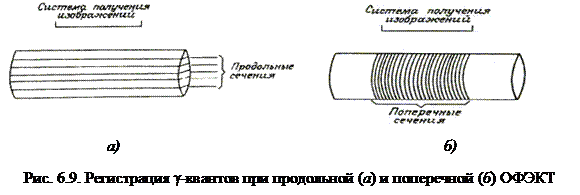 |
Метод ОФЭКТ можно также разделить на два основных типа: томографию с ограниченным углом обзора и поперечную томографию. При ОФЭКТ с ограниченным углом обзора (или продольной ОФЭКТ) регистрация гамма-квантов производится одновременно от некоторых сечений тела в ограниченном диапазоне углов. В этом случае плоскости реконструированного изображения будут параллельны поверхности детектора (детекторов) (рис. 6.9а). В поперечной (трансаксиальной)ОФЭКТ детектор совершает полное круговое (или некруговое) движение вокруг пациента, регистрируя g-излучение от одного (или нескольких) сечений тела. При этом плоскости реконструированного изображения перпендикулярны поверхности детектора (рис. 6.9б). В любом случае при сборе полной пространственной информации можно реконструировать изображение и в других ортогональных плоскостях.
Преимущество систем ОФЭКТ перед планарной сцинтиграфией состоит в улучшении контраста в изображении сред с различными физиологическими пока-зателями, в большем пространственном разрешении, в более надежном выявлении аномальных функций органов, а также в существенном увеличении объемов количественных исследований. Однако, во многих системах ОФЭКТ реализация этих преимуществ достигается за счет снижения пространственного разрешения.
По сравнению с планарными гамма-камерами к детекторам ТГК предъявляются повышенные требования к однородности чувствительности в пределах поля зрения. Это связано с тем, что неоднородность изображения после математической реконструкции возрастает и может привести к различного рода ошибкам. Поэтому все модели ТГК снабжены микропроцессорными системами цифровой коррекции неоднородности.
Важным достоинством ТГК является универсальность, поскольку при неподвижном детекторе можно проводить все статические планарные исследования подобно обычной гамма-камере. Однако качество этих исследований выше из-за повышенных требований к однородности. Это является, по-видимому, основной причиной вытеснения планарных гамма-камер из клинической практики и повсеместного перехода на ТГК, несмотря на более высокую стоимость установок для ОФЭКТ.
Отметим существенное отличие методики реконструкции 3 D -изображе-ния в ОФЭКТ от рентгеновской трансмиссионной компьютерной томографии (РКТ). По сравнению с методом РКТ, в котором in vivo регистрируется распре-деление линейного коэффициента ослабления m рентгеновского излучения, реконструкция методом ОФЭКТ более сложна, поскольку связана с задачей нахождения распределения активности при априори неизвестных коэффициен-тах m. ОФЭКТ-изображения, характеризующие физиологические и метаболи-ческие процессы в организме, имеют пространственное разрешение порядка 3...5 мм в ОФЭКТ-системах, что хуже разрешения систем РКТ, равного примерно 1 мм. Источники радиации при ОФЭКТ распределены в значительной части тела пациента и выводятся из организма в основном за время распада РФП, тогда как в РКТ доза облучения ограничена временем экспонирования одного сечения тела, а общая поглощённая при РКТ доза увеличивается кратно числу облучённых сечений. Следовательно, при обследовании одного и того же объема биоткани поглощенное излучение при ОФЭКТ обычно в 10 раз меньше, чем при РКТ.
3.4.6. Установки для позитронной эмиссионной томографии
Радионуклидная диагностика поднялась на качественно новую ступень с появлением серийно выпускаемых установок для позитронной эмиссионной томографии (ПЭТ). ПЭТ является одним из самых информативных методов, применяемых в ядерной медицине. Метод позволяет получать функциональные изображения, основанные на участиии РФП в различных метаболических процессах. Наиболее часто используемые позитронно-излучающие (β+-активные) радионуклиды (см. табл. 6.3), имеют малые периоды полураспада (от 2 до 110 мин). По  этому их необходимо синтезировать непосредственно в клиническом центре, поблизости от места диагностического применения. Например, для этой цели может использоваться малогабаритный циклотрон, на котором пучок ускоренных протонов или дейтонов бомбардирует изотопно-обогащенную мишень (рис. 6.10). Все технологические процедуры получения РФП автоматизированы и почти не требуют вмешательства оператора в процесс синтеза позитронных излучателей.
этому их необходимо синтезировать непосредственно в клиническом центре, поблизости от места диагностического применения. Например, для этой цели может использоваться малогабаритный циклотрон, на котором пучок ускоренных протонов или дейтонов бомбардирует изотопно-обогащенную мишень (рис. 6.10). Все технологические процедуры получения РФП автоматизированы и почти не требуют вмешательства оператора в процесс синтеза позитронных излучателей.
 При каждом акте распада позитронного излучателя испускается один пози-трон, который интенсивно замедляется в биотканях, удаляясь от места своей эмиссии не более, чем на 3 мм, чем и определяется разрешение ПЭТ томографа. В конце своего пробега позитрон аннигилирует с электроном, в результате чего испускаются два кванта с энергией 511 кэВ каждый, разлетающихся в строго противоположных направлениях. Далее аннигиляционные кванты регистри-руются детекторами аналогично описанным выше методикам. Общий вид ПЭТ показан на рис. 6.11.
При каждом акте распада позитронного излучателя испускается один пози-трон, который интенсивно замедляется в биотканях, удаляясь от места своей эмиссии не более, чем на 3 мм, чем и определяется разрешение ПЭТ томографа. В конце своего пробега позитрон аннигилирует с электроном, в результате чего испускаются два кванта с энергией 511 кэВ каждый, разлетающихся в строго противоположных направлениях. Далее аннигиляционные кванты регистри-руются детекторами аналогично описанным выше методикам. Общий вид ПЭТ показан на рис. 6.11.
ПЭТ обычно представляет собой совокупность кольцевых детекторных сборок, расположенных параллельно друг другу вдоль общей оси. Внутрь детекторного блока вдоль оси вводится консольное ложе с пациентом. Каждая сборка содержит несколько десятков сцинтилляционных детекторов, обычно с матрицей 8×8 кристаллов германата висмута и с четырьмя ФЭУ (в последнее время ФЭУ все чаще заменяются на высокочувствительные фотодиоды, почти не уступающие ФЭУ по обнаружительной способности). Противоположные детекторы в каждом кольце включены по схеме двойных совпадений. Благодаря такому включению на дальнейшую обработку пропускаются только те им-пульсы, которые возникают от пары соответствующих аннигиляционных фото-
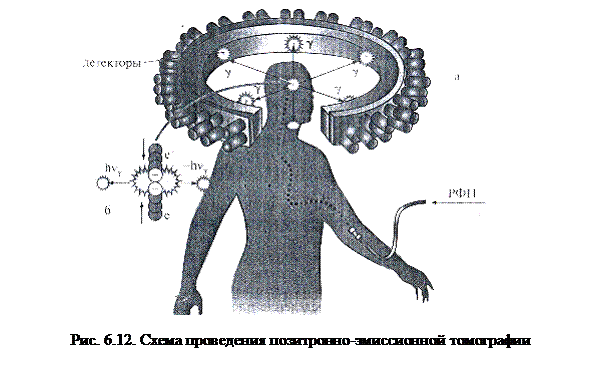 |
нов, полностью поглотившихся в сцинтилляционных кристаллах (рис. 6.12).
На компьютере, входящем в комплектацию ПЭТ, по совокупности всех зарегистрированных совпадений с полным поглощением энергии фотонов в детекторах производится реконструкция ПЭТ-изображений примерно по тем же алгоритмам, что и в ОФЭКТ. Результаты реконструкции могут быть представлены как в виде серии изображений последовательно расположенных поперечных срезов тела пациента, так и в виде единого 3 D -изображения исследуемого участка тела.
Наибольшее применение ПЭТ находит для неврологических исследований и изучения процессов метаболизма головного мозга, поэтому большинство систем рассчитано для томографии черепа и имеет небольшой диаметр кольца рабочей зоны. Пространственное разрешение в реконструированном изображении составляет 6 мм при толщине сечения 6,3 мм.
Метод постоянно совершенствуется: разработаны ПЭТ, комбинированные с РКТ, позволяющие за одно исследование получать функциональные (ПЭТ) и анатомические (РКТ-изображения) данные.
Легко видеть, что ввиду сложности конструкции детекторного блока и необходимости наличия независимого накопителя позитронно-излучающих радионуклидов стоимость ПЭТ выделяется даже на фоне дорогостоящих установок для ОФЭКТ. Поэтому в последнее время развернуты специальные исследования, направленные на поиск более дешевых ПЭТ-методов.
Одно из направлений таких исследований ориентировано на использовании типовых установок для ОФЭКТ в комбинации с РФП на основе относительно медленно распадающихся β+-активных радионуклидов, содержащих 18F (например, фтородеоксиглюкозы). Благодаря периоду полураспада в 110 мин (почти 2 часа) такие РФП можно доставить на расстояние до 50 км от накопителя. Для работы используются установки для ОФЭКТ с двумя детекторными головками, размещаемыми напротив друг друга и включаемыми по схеме парных совпадений. В таком режиме возникает проблема дискриминации большого числа ложных совпадений. Можно использовать однофотонный режим с жесткой дискриминацией регистрируемых фотонов по энергии (обычно используемые при ОФЭКТ радионуклиды дают фотоны с существенно меньшей, чем 511 кэВ, энергией). Но в этом случае резко падает чувствительность, и возможности ранней диагностики плохо соответствуют современным медицинским требованиям.
Другое направление усовершенствования ПЭТ в сторону удешевления — проведение так называемой мультиэмиссионной томографии. Идея метода — использование сэндвич-сцинтилляторов, в которых два разнотипных сцинтил-лятора находятся в оптическом контакте. Один из них, ближайший к источнику излучения, предназначен для регистрации фотонов от обычного РФП; другой, ближайший к детектору (матричная сборка из фотодиодных считывающих элементов), предназначен для регистрации прошедшего через сцинтиллятор аннигиляционного излучения. Сигналы от различных сцинтилляторов разделяются в электронном тракте по длительности высвечивания.
На рубеже ХХ-ХХI столетий радионуклидная диагностика достигла высокой степени развития. С использованием радионуклидов сегодня могут быть обследованы практически все органы и системы организма. На нужды ядерной медицины расходуется до 70% всей радионуклидной продукции, получаемой на реакторах, ускорителях и генераторах во всем мире.
В России к началу ХХI века функционировало свыше 300 подразделений ядерной медицины, где эксплуатировалось около 200 гамма-камер, из которых лишь 30% могли работать в режиме ОФЭКТ. К этому времени функционировали лишь 2 ПЭТ-центра. Перечисленное недопустимо мало для страны, претендующей на современный уровень здравоохранения. По числу радионуклидных процедур на одну тысячу населения Россия в 2002 г. отставала от Великобритании в 4 раза, от Японии — в 4,5 раза, от США — в 5,5 раз, от Канады — в 8,5 раз.
Радионуклидная диагностика занимает своё стабильное место среди других методов получения медицинских диагностических изображений. Основное преимущество РНД заключается в её физиологичности, что достигается за счет способности РФП накапливаться в определенных морфологических структурах организма или отражать динамику протекающих в органе биофизических или биохимических процессов. С точки зрения применения в тех или иных областях медицины, сегодня наиболее интенсивно развиваются кардиологические применения РНД, за ними идут онкология, неврология, пульмонология и т.д. Количество используемых методик очень велико, и более-менее обстоятельное их описание невозможно в рамках настоящего курса.
3.5. Аппаратура для лучевой терапии.
При лучевой терапии для воздействия на биообъект применяется сколлимированный поток ИИ, которое может иметь различный характер (как электромагнитное излучение различных длин волн, от рентгеновского до гамма-диапазона, так и излучение с ненулевой энергией покоя частиц (радионуклидная терапия, §6.4)). Лучевая терапия применяется в основном для лечения злокачественных опухолей.
Сущность метода состоит в использовании различий в чувствительности различных тканей к ИИ (радиочувствительности). Здесь количественные оценки затруднены, но большой практический опыт позволяет утверждать, что чувствительность возрастает с ростом скорости метаболизма (см. §5.6). Качест-венно связь метаболической активности клеток с повреждающим действием радиации объясняется на молекулярном уровне через действие кислородного механизма, т.е. преимущественное взаимодействие ИИ с молекулами воды, являющимися атрибутом метаболических процессов и образующими множество кислородсодержащих радикалов. Последние способны существенно повлиять на структуру и функции основных биомолекул в клетке, прежде всего ДНК, наиболее уязвимую в момент деления. Из нормальных тканей наивысшей радиочувствительностью обладают лимфоидная ткань и костный мозг, у которых скорость метаболизма (и скорость воспроизводства) максимальна. Злокачественные клетки также обладают повышенной скоростью метаболизма, имеющей тот же порядок, что и клетки костного мозга. При локальном облучении повреждающее действие ИИ причиняет злокачественным новообразованиям более серьезный вред, чем окружающим здоровым тканям.
Однако, поскольку скорость метаболизма не является постоянной величиной, чувствительность к ионизирующим воздействиям существенно меняется во времени. Если во время облучения злокачественные клетки находятся в интерфазе (т.е. в «состоянии покоя», когда момент деления еще не приближается), то их чувствительность мало отличается от здоровых клеток, следовательно, терапевтический эффект будет минимальным. Поэтому сеансы облучения часто проводятся не одномоментно, а несколькими «порциями», чтобы повысить вероятность «ловли» периода максимальной активности патологии. Следует также отметить существенное отличие проведения лучевой терапии для взрослых и детей. Дело в том, что для растущего детского организма скорость метаболизма велика, и в случае возникновения опухолей разница в чувствительности здоровых и патологических клеток не столь существенна, как у взрослых. Следовательно, лечебный эффект у детей чрезвычайно критичен к выбору дозы, поэтому методика лечения может содержать иммобилизацию (обездвиживание) облучаемых частей тела, тщательное экранирование для снижения дозовой нагрузки на здоровые ткани, а иногда и применение наркоза для исключения случайных или непроизвольных движений во время облучения. Движения во время облучения могут привести к уменьшению эффективности лечения, что повлечёт за собой дополнительное облучение, увеличив получаемую дозу.
Имея в виду, что для лучевой терапии может применяться излучение, кванты которого имеют как нулевую, так и ненулевую массу покоя, принято классифицировать лучевое воздействие на корпускулярное (α-терапия, β-терапия, нейтронная, протонная, π-мезонная терапия и т.п.) и волновое (рентгеновская и γ-терапия) (см. §5.1). По способу воздействия различают контактное и дистанционное. Из самого названия очевидным образом следует, что контактное воздействие, производимое при непосредственном соприкосновении источника излучения с объектом, имеет достаточно ограниченную сферу применения — либо при поверхностных новообразованиях, либо интраоперационно. Поэтому, несмотря на меньшее число побочных эффектов, контактное воздействие по широте охвата медицинских задач значительно уступает дистанционному, основным преимуществом которого является универсальность.
Поскольку в результате дистанционного облучения обязательно повреждаются здоровые ткани, наряду с рекомендациями к применению лучевой терапии разработана и классификация побочных эффектов, подразделяемых на локальные и системные. Локальные эффекты представляют собой совокупность повреждений непосредственно в зоне облучения (термические ожоги, повышенная ломкость стенок сосудов, мелкоочаговые кровоизлияния и т.п.). При контактном способе сюда могут быть добавлены ещё и изъязвления облучаемой поверхности. Это, безусловно, причиняет определенный дискомфорт пациенту и требует реабилитационных процедур, но на фоне успешного разрушения злокачественного новообразования может не рассматриваться как большая проблема. Более серьезными являются системные осложнения, обусловленные распадом клеток, подвергшихся облучению (так называемые лучевые реакции) (см. §5.6). У больного происходит угнетение кроветворения, вследствие этого сильно изменяется состав крови, появляется слабость, быстрая утомляемость, развитие рвотных реакций, ломкость ногтей, выпадение волос, локальные кровотечения из носа, возможны обострения желудочно-кишечных патологий вплоть до внутренних кровотечений и т.п. По сути дела, пациент после проведения курса дистанционной лучевой терапии переживает в качестве побочного явления лучевую болезнь, степень которой зависит от полученной дозы. В этом смысле назначение лучевой терапии, имеющее смысл борьбы против злокачественных новообразований, может вызвать рецидивы подобных же заболеваний как осложнений лучевых реакций. Вероятность таких рецидивов относительно мала, к тому же среднее время возникновения их составляет не менее 10 лет. Тем не менее, эту вероятность необходимо всемерно понижать. В связи с этим решающим при назначении лучевой терапии является фактор дозиметрии (особенно критичный, как уже указывалось выше, в случае лечения детей). Для детей в качестве типичного системного осложнения можно указать замедление роста и развития опорно-двигательного аппарата.
Лучевая терапия проводится как самостоятельный метод лечения (особенно эффективный на ранних стадиях заболевания), так и в составе комби-нированного лечения в сочетании с хирургическими или химиотерапев-тическими методами. Ввиду упомянутых выше особых ограничений для детей, она в этом случае практически никогда не применяется как самостоятельный метод, а только в сочетании, как правило, с химиотерапией. Как и фотодинамическая терапия (см. §4.3.2), лучевая терапия все шире применяется за пределами онкологии, например, в качестве одного из способов эпиляции, для лечения повышенной потливости, против пяточных шпор и т.п.
Лучевая терапия всегда начинается с планирования. Для этого выполня-ется ряд рентгенологических исследований, при которых определяется по воз-можности более точное расположение патологии. При необходимости облуче-ние проводится с нескольких точек, чтобы достигнуть максимально возмож-ного сосредоточения потока излучения на патологии и для максимальной селективности воздействия (здоровые ткани должны получить минимум дозы, а патология максимум). Как правило, применяется экранирование здоровых органов и тканей. Сеанс облучения обычно продолжается от 1 до 5 минут, весь курс облучения может продолжаться от 3...4 дней до 3...4 недель.
a -терапия относится к наиболее «мягким» из всех видов лучевой терапии. a-частицы поглощаются даже небольшим слоем воздуха, поэтому необходим контакт источника a-частиц с организмом или их введение внутрь организма. Характерным примером a-терапии является радоновая терапия, при которой в качестве источника радионуклидов используются минеральные воды, содержащие радон (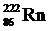 ) и его дочерние продукты. Радоновая терапия используется для воздействия на кожу (ванны), органы пищеварения (питьё), органы дыхания (ингаляции).
) и его дочерние продукты. Радоновая терапия используется для воздействия на кожу (ванны), органы пищеварения (питьё), органы дыхания (ингаляции).
Другой прием применения a-терапии заключается в том, что в опухоль предварительно вводят элементы, ядра которых под действием нейтронов вызывают ядерную реакцию с образованием a-частиц. Например, 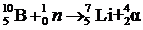 или
или  . Таким образом, a-частицы и ядра отдачи образуются прямо внутри органа, на патологию которого они должны оказывать разрушительное воздействие.
. Таким образом, a-частицы и ядра отдачи образуются прямо внутри органа, на патологию которого они должны оказывать разрушительное воздействие.
Для дистанционной корпускулярной терапии применяют ускорители заряженных частиц: бетатрон, синхротрон (для электронов), синхрофазотрон (для тяжелых частиц). Заряженные частицы наибольшую ионизацию производят перед остановкой. Поэтому при попадании пучка заряженных частиц в биообъект извне наибольшее воздействие будет оказано не на поверхностные слои тканей, а на патологические ткани, расположенные в глубине организма (пик Брэгга). Поверхностные слои при этом повреждаются минимально (рис. 6.13).
Следует подчеркнуть, что использование ускорителей делает лучевую терапию весьма дорогостоящей, что, безусловно, является сильным сдерживающим ее распространение фактором.
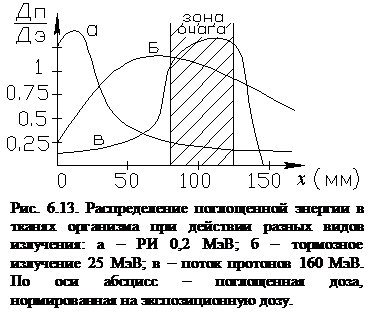 Волновая лучевая терапия главным образом использует g-излучение ввиду бόльшей проникающей способности, чем рентгеновское. При облучении организма ИИ в участках тканей, находящихся на разных глубинах, поглощается разная величина энергии, поэтому поглощенная доза (DП) для этих глубин будет разная. Для излучения с малой энергией фотона распределение DП по глубине будет определяться экспоненциальным законом ослабления интенсивности излучения (законом Бэра). Жёсткое излучение вызывает эффект вторичной ионизации, а это повышает локальное выделение энергии на глубинах, где возникает вторичная ионизация. Такие эффекты могут приводить к появлению на некоторых характерных глубинах максимума поглощенной дозы DП. Чем выше энергия фотона, тем глубже сдвигается максимум. При лечении опухолей подбором жёсткости излучения достигают выделения максимальной энергии в местах очага (см. рис.6.13).
Волновая лучевая терапия главным образом использует g-излучение ввиду бόльшей проникающей способности, чем рентгеновское. При облучении организма ИИ в участках тканей, находящихся на разных глубинах, поглощается разная величина энергии, поэтому поглощенная доза (DП) для этих глубин будет разная. Для излучения с малой энергией фотона распределение DП по глубине будет определяться экспоненциальным законом ослабления интенсивности излучения (законом Бэра). Жёсткое излучение вызывает эффект вторичной ионизации, а это повышает локальное выделение энергии на глубинах, где возникает вторичная ионизация. Такие эффекты могут приводить к появлению на некоторых характерных глубинах максимума поглощенной дозы DП. Чем выше энергия фотона, тем глубже сдвигается максимум. При лечении опухолей подбором жёсткости излучения достигают выделения максимальной энергии в местах очага (см. рис.6.13).
Рассмотрим установки для g-терапии подробнее.
γ-установка представляет собой направленный, регулируемый по сечению пучка источник g-излучения (чаще всего в качестве такового применяется 60Со, реже 137Сs, 192Ir). Излучающая головка снабжена защитным контейнером из свинца или вольфрама, имеющим окно со специальной диафрагмой. Регулируемое окно позволяет получать пучок излучения необходимой геометрии и регулировать интенсивность (плотность потока) в соответствующих пределах. В устоявшейся (несколько жаргонной) терминологии излучающая головка именуется как «кобальтовая пушка», хотя, как уже упоминалось выше, источником g-излучения не обязательно является радиоактивный кобальт. Различают длинно- и короткофокусные γ-установки, предназначенные для облучения поверхностных и глубоко залегающих патологий. Короткофокусные (расстояние от источника излучения до поверхности не более 25 см) не требуют больших уровней активности источников (до 100 Ки). Длиннофокусные, предназначенные для работы на расстояниях 70...100 см, имеют источник с активностью в несколько тысяч кюри, и здесь уже можно считать оправданным название «кобальтовая пушка», как с точки зрения «дальнобойности», так и с точки зрения большой плотности потока излучения, который наиболее удобно получать именно от 60Со. Длиннофокусные γ-установки различают на статические (источник излучения жестко зафиксирован) и для подвижного облучения; в последних источник излучения может либо вращаться вокруг выбранной оси, либо совершать колебания относительно этой оси на заданный угол (ротационные γ-установки). Увеличение степеней свободы для подвижного облучения с одновременным перемещением источника вокруг трех взаимно перпендикулярных осей позволяет описывать шаровую поверхность (ротационно-конвергентные γ-установки). Подвижным облучением (причем характер перемещений в ходе облучения задается программным образом в соответствии с индивидуальными особенностями пациента, установленными в процессе планирования) достигается оптимизация дозы с максимальной концентрацией в области патологии и минимизацией воздействия на здоровые ткани. Внешний вид современной установки для γ-лучевой терапии показан на рис. 6.14.
 Чаще всего дистанционное облучение применяется в виде длительных курсов продолжительностью от 3 до 8 недель. Ежедневные сеансы длятся обычно несколько минут. Характерной особенностью работы медицинского персонала при выполнении дистанционной лучевой терапии в отличие от аппликационной или внутритканевой является отсутствие необходимости выполнения ручных манипуляций с незащищенными источниками излучения.
Чаще всего дистанционное облучение применяется в виде длительных курсов продолжительностью от 3 до 8 недель. Ежедневные сеансы длятся обычно несколько минут. Характерной особенностью работы медицинского персонала при выполнении дистанционной лучевой терапии в отличие от аппликационной или внутритканевой является отсутствие необходимости выполнения ручных манипуляций с незащищенными источниками излучения.
При аппликационной лучевой терапии источники ИИ помещаются непосредственно на поверхности тела больного без нарушения целостности тканей. Этот вид терапии выполняется в течение 5...10 дней, причем дневные процедуры проводятся в течение нескольких часов. При этом неизбежными являются ручные манипуляции с радиоактивными источниками, естественно, при использовании защитного оборудования.
Чрескожное облучение осуществляется в статическом (неподвижном) или подвижном режиме. Для увеличения дозы в глубине тканей это облучение проводят через свинцовые решётчатые диафрагмы, что позволяет значительно повысить дозу под открытыми участками решётки в очаге поражения.
Внутриполостное и внутритканевое облучение представляет специальный интерес. Способы его применения различны. Применяют введение небольшого тубуса специального короткофокусного облучателя непосредственно в естест-венную полость тела (ротовая полость, влагалище, прямая кишка) или искусст-венно образованные полости. Оно делится на следующие варианты: внутрипо-лостная короткодистанционная рентгенотерапия; внутриполостная гамма-терапия; внутриполостная бета-терапия (контактное облучение). Применяется также введение в полостной или трубчатый орган (мочевой пузырь, матка, бронхи др.) резинового баллона, наполненного раствором радиоактивного вещества, металлического футляра с трубочками, содержащими радиоактивный изотоп, а также бус из 60Co. В полостной орган (мочевой пузырь) или полость тела (плевральная, брюшная и др.) можно впрыскивать раствор или взвесь радиоактивного изотопа. Внутритканевое облучение достигается и введением в ткани игл или трубочек, содержащих 60Co или 192Ir, керамических цилиндров, а также коллоидного раствора 198Au или гранул из 198Au. В большинстве случаев внутриполостное облучение дополняет дистанционный метод (сочетанная лучевая терапия рака шейки и тела матки, пищевода) или хирургическое вмешательство (комбинированное лечение опухолей носа, верхней челюсти).
При внутритканевой лучевой терапии источник излучения находится непосредственно в опухоли или тканях организма больного в течение всего процесса лечения. Терапия осуществляется путем обкалывания патологии излу-чающими иглами, внедрения излучающих стержней, гранул, зерен; прошивания опухоли радиоактивными нейлоновыми нитями с излучающими гранулами; используют также инъекционную имплантацию коллоидных растворов радио-нуклидов. При внутритканевой терапии существует необходимость ручных манипуляций с незащищенными источниками излучения, причем обязательно с соблюдением правил асептики, как и при хирургических операциях.
При внутреннем облучении перорально, внутримышечно или внутривенно (внутриартериально) вводятся органотропные радионуклиды или меченые соединения, которые избирательно поглощаются опухолью или другими патологически измененными тканями. В процессе курса лечения радионуклиды вводятся обычно несколько раз.
Все перечисленные способы лучевой терапии используют в трех основных функциональных подразделениях радиологических отделений онкологического диспансера: для дистанционной лучевой терапии, работы с закрытыми источниками излучения и для работы с открытыми жидкими радионуклидами. Каждый из этих кабинетов имеет свои особенности работы, защиты и ухода за больными, а также специальное оборудование и аппаратуру.
Адронная лучевая терапия представляет собой разновидность корпускулярной лучевой терапии, получившую особое развитие в последние десятилетия ХХ века. Это связано с относительно большим процентом неудач при волновой лучевой терапии (несмотря на огромные затраты при разработке соответствующего оборудования, смертность остается высокой: половина больных с 3-й стадией заболеваний погибает в течение года). Причиной неудач лучевого лечения опухолей в ряде случаев является относительная резистентность новообразования к излучениям с низкой линейной передачей энергии (ЛПЭ), невозможность подведения к опухоли необходимой дозы из-за риска повреждения нормальных окружающих тканей. К настоящему времени наиболее распространенные виды излучений ― фотонные пучки линейных ускорителей ― дошли до технологического предела усовершенствования. Когда рядом с мишенью, подлежащей облучению, расположены жизненно важные и радиочувствительные структуры и органы, традиционная радиотерапия часто оказывается бессильной. Это объясняется тем, что поражающее действие гамма-излучения спадает экспоненциально по мере проникновения в вещество, поэтому здоровые ткани, расположенные на пути пучка, облучаются большей дозой, чем сама мишень. Кроме того, облучению подвергаются также ткани и органы, находящиеся за мишенью. Второй недостаток гамма-лучей — это недостаточно резкий спад дозы по боковым границам пучка в силу специфики взаимодействия этого излучения с веществом. Поэтому не всегда удается сфокусировать дозовое распределение соответствующим образом на мишень, с чем в первую очередь, и связаны ограничения традиционной (фотонной) лучевой терапии.






