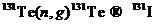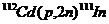· хранение результатов измерений.
Применение цифровых систем для регистрации g-квантов существенно улучшает качество результатов измерения и открывает неограниченные возможности для получения количественной информации об источнике излучения.
6.4.2. Способы получения радионуклидов
Одним из главных достоинств применения радионуклидов в медицине является возможность получения результирующего сигнала большой амплитуды при относительно малой массе вводимого радионуклида. Введение незначительных доз меченого препарата позволяет проводить неинвазивные исследования организма без возникновения вредных фармакологического и токсического эффектов. Ядерная медицина использует данную возможность для исследования различных физиологических процессов в организме с помощью разных радиоизотопных соединений — РФП.
Существуют четыре способа образования радионуклидов:
1) нейтронный захват (известный также как активация нейтронов);
2) деление ядра;
3) бомбардировка атома заряженными частицами и
4) использование радионуклидного генератора.
Каждый из упомянутых методов позволяет получать необходимое количество изотопов для ядерной медицины.
Нейтронный захват — это поглощение нейтрона ядром атома и образование нового радионуклида в соответствии со следующими ядерными реакциями:
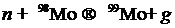 (6.3)
(6.3)
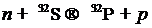 (6.4)
(6.4)
Чтобы получить радиоактивные элементы при нейтронном захвате, нейтроны должны иметь среднюю энергию от 0,03 до 100 эВ. Эти «тепловые» (находящиеся в термодинамическом равновесии с веществом) нейтроны являются наиболее подходящими для взаимодействия с ядрами атомов и поглощения в них. Самым эффективным средством получения радиоизотопов является использование ядерного реактора. В нём для получения радиоактивного препарата мишень из определенного элемента помещается в пучок тепловых нейтронов. Число образующихся в результате реакции атомов изотопа N g зависит от плотности потока падающих частиц j(см-2·с-1),числа доступных для взаимодействия ядер мишени (п t) и сечения (вероятности) реакции σ,измеряемой в барнах[1]:
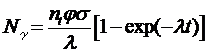 (6.5)
(6.5)
Здесь λ — постоянная радиоактивного распада, определяемая как величина, обратно пропорциональная периоду полураспада данного изотопа.
Полученный в соответствии с реакцией (6.3) или (6.4) радионуклид представляет собой изотоп материала мишени, т. е. оба ядра имеют одинаковое число протонов. Радионуклиды, полученные в реакции (n, γ),неотделимы от материала мишени и, таким образом, отношение числа радиоактивных атомов к числу стабильных атомов, т. е. удельная активность, относительно мало. Отделение полученного радионуклида от других радионуклидов мишени производится известными физическими или химическими методами. Радионуклиды, образующиеся в результате поглощения нейтронов, представлены в табл. 6.1.
Таблица 6.1. Радионуклиды, образующиеся при поглощении нейтронов
| Изотоп | Энергия γ-излучения, кэВ | Период полураспада | Сечение поглощения, барн |
| 51Cr | 320 | 27,7 сут | 17 |
| 59Fe | 1099 | 44,5 сут | 1,1 |
| 99Mo | 740 | 66,02 ч | 0,13 |
| 131I* | 364 | 8,05 сут | 0,2 |
| *Получается по схеме | |||
Ядерное деление — это процесс, в результате которого тяжелые ядра (235U, 239Pu, 237U, 232Th), облучаемые тепловыми нейтронами, поглощают их и становятся нестабильными, что приводит к их делению на два легких (приблизительно с одинаковыми атомными массами) ядра в соответствии, например, со следующей ядерной реакцией:
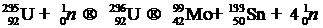 (6.6)
(6.6)
Отсюда мы видим, что в данной реакции образуются дополнительно четыре нейтрона, которые в свою очередь могут поглотиться другими тяжелыми ядрами, и процесс деления может продолжаться до истощения ядерного горючего.
К недостаткам данного способа относятся следующие моменты. Получаемые при делении тяжелых ядер нуклиды должны подвергаться тщательной очистке для выделения конкретного радионуклида из смеси продуктов деления. Процесс деления имеет высокую удельную активность из-за отсутствия материала мишени (нерадиоактивного изотопа того же элемента). Однако продукты деления обычно обогащены нейтронами и испытывают β – -распад с излучением b-частиц, физическое действие которых противопоказано при медицинской визуализации, хотя и представляет интерес для целей терапии.
В табл. 6.2 представлены нуклиды, получаемые в процессе ядерного деления, которые применяются в ядерной медицине.
Таблица 6.2. Радионуклиды, возникающие в процессе ядерного деления
| Изотоп | Энергия γ-квантов, кэВ | Период полураспада | Эффективность деления, % |
| 99Mo | 740 | 66,02 ч | 6,1 |
| 131I | 364 | 8,05 дня | 2,9 |
| 133Xe | 81 | 5,27 дня | 6,5 |
| 137Cs | 662 | 30 лет | 5,9 |
Бомбардировка заряженными частицами — это процесс получения радионуклидов посредством взаимодействия заряженных частиц (Н±, D+, 3Не2+, 4Не2+) с ядрами стабильных атомов. Частицы должны обладать достаточной кинетической энергией для преодоления сил электростатического отталкивания положительно заряженного ядра. Для этой цели применяют различные типы ускорителей заряженных частиц (УЗЧ). Примерами типичных реакций, протекающих при бомбардировке мишени, являются следующие:
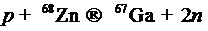 (6.7)
(6.7)
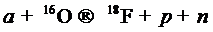 (6.8)
(6.8)
Для получения необходимых медицине радионуклидов обычно используют частицы с энергией от 1 до 100 МэВ на один нуклон. Одним из главных достоинств метода получения изотопов путем бомбардировки заряженными частицами (в большинстве случаев) является то, что атомный номер такого изотопа отличается от атомного номера материала мишени. Это теоретически позволяет получать радионуклиды с очень высокой удельной активностью и минимальной примесью посторонних радионуклидов. Однако получаемые на практике значения активности и чистоты определяются изотопной и нуклидной чистотой материала мишени, сечением соответствующей ядерной реакции и сечением любой вторичной реакции.
Ядерные реакции с участием заряженных частиц позволяют получать преимущественно радионуклиды с дефицитом нейтронов, и поэтому распад сопровождается β+-излучением или захватом электронов. Образующиеся таким образом радиоизотопы благодаря отсутствию собственного излучения особенно полезны для клинической визуализации. В табл. 6.3 представлены характеристики радионуклидов, получаемых с помощью ускорителей и нашедших применение в ядерной медицине.
Таблица 6.3. Радионуклиды, получаемые с помощью ускорителей
| Изотоп | Основная энергия γ-излучения, кэВ | Период полураспада | Реакция |
| 11C | 511 (β+) | 20,4 мин | 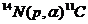
|
| 13N | 511 (β+) | 9,96 мин | 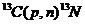
|
| 15O | 511 (β+) | 2,07 мин | 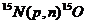
|
| 18F | 511 (β+) | 109,7 мин | 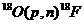
|
|
67Ga | 93 |
78,3 ч |
|
| 184 | |||
| 300 | |||
| 111In | 171 | 67,9 ч |
|
| 245 | |||
| 123I | 159 | 13 ч | 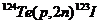
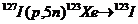
|
| 201Tl | 68 – 80,3 | 73 ч | 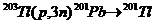
|
Радиоактивный распадможет сопровождаться образованием либо стабильного, либо радиоактивного нуклида. В любом случае вновь образованный нуклид в зависимости от типа распада может иметь тот же самый или другой атомный номер. Радиоактивный распад, сопровождающийся образованием «дочернего» радиоактивного продукта с иным атомным номером Z, позволяет простым химическим способом разделить дочерний и исходный продукты. Если дочерний радионуклид имеет необходимые для медицинской визуализации характеристики, а у исходного радионуклида достаточно большой период полураспада, чтобы его можно было использовать для получения, обработки и транспортировки, то разделение изотопов может проводиться непосредственно у потребителя и стать удобным источником короткоживущих радионуклидов медицинского назначения. Этот источник получения радионуклидов называют радионуклидным генератором.
Таким образом, радионуклидный генератор — это устройство для оперативного приготовления короткоживущего радионуклида путем химического отделения дочернего изотопа от исходного. Такое разделение можно выполнить с помощью методов хроматографии, дистилляции или фазового разделения. В настоящее время первый из методов изучен в наибольшей степени и используется в большинстве генераторов. Характеристики используемых радионуклидов приведены в табл. 6.4.
Таблица 6.4. Радионуклиды, получаемых с помощью радионуклидных генераторов
| Исходный изотоп Р | Период полураспада исходного изотопа | Тип распада * P→D | Дочерний изотоп D | Тип распада * D | Период полураспада D | Энергия γ-квантов от D, кэВ |
| 99Mo | 2,7 сут | β- | 99Tcm | ИП | 6 ч | 140 |
| 82Sr | 25 сут | ЗЭ | 82Pb | ЗЭ, β+ | 1,3 мин | 777, 511 |
| 68Ge | 280 сут | β+ | 68Ga | ЗЭ, β+ | 68 мин | 511 |
| 52Fe | 8,2 ч | β+ | 52Mnm | ЗЭ, ИП, β+ | 21 мин | 511 |
| 81Pb | 4,7 ч | ЗЭ | 81Krm | ИП | 13 с | 190 |
| 62Zn | 9,1 ч | β+ | 62Cu | ЗЭ, β+ | 9,8 мин | 511 |
| 178W | 21,5 сут | ЗЭ | 178Ta | ЗЭ | 9,5 мин | 93 |
| *ИП — изомерный переход, ЗЭ — захват электрона | ||||||
6.4.3. Выбор радиоизотопа для получения изображений
Радионуклиды, используемые для визуализации в ядерной медицине, должны иметь следующие физические характеристики:
1) необходимый физический период полураспада;
2) распад через испускание γ-квантов;
3) оптимальная энергия γ-квантов;
4) отсутствие испускания частиц, отличных от γ-квантов.
Эффективный период полураспада Т эРФП определяется физическим периодом полураспада Т ф и биологическим периодом полувыделения РФП из организма Т б, т.е.
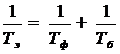 (6.9)
(6.9)
Тщательное согласование эффективного периода полураспада с длительностью исследования представляется весьма важной задачей дозиметрии, а также с точки зрения практического применения РФП, их доступности и возможности синтеза.
Энергия γ-квантов имеет важное значение по нескольким причинам. Именно, γ-квант должен эффективно проникать в ткани организма, а сцинтилляционный импульс видимого излучения, связанный с ним, должен легко отделяться от любого рассеянного излучения. Оба указанных требования обуславливают необходимость использования квантов с высокой энергией излучения, однако при слишком больших энергиях сильно снижается эффективность детектирования и соответственно чувствительность системы. Кроме того, γ-излучение высокой энергии труднее экранировать, что создает большие практические проблемы для обслуживающего персонала, работающего с радионуклидами.
Радионуклидом, в наибольшей степени удовлетворяющим перечисленным выше требованиям, является технеций-99m (99Tcm), который применяют более чем в 90% всех исследований в ядерной медицине. Физический период его полураспада составляет 6,02 ч, причем он получается в результате распада долгоживущего исходного радионуклида 99Мо с периодом полураспада Т 1/2 = 66 ч. Распад радионуклида 99Тс происходит посредством изомерного перехода к 99Тс, и при этом испускаются γ-кванты с энергией 140 кэВ. Короткий период полураспада 99Тсm и отсутствие β±-излучения гарантирует малую радиационную нагрузку на пациента. γ-кванты с энергией 140 кэВ ослабляются биотканью толщиной 4,6 см вдвое и хорошо коллимируются свинцовым коллиматором. При этом представляется весьма важным то, что этот радиоизотоп может быть синтезирован генератором, который в течение недели при необходимости может выделять РФП для целей визуализации.
Из других радиоизотопов в ядерной медицине используются 123I, 111In, 67Ga, 201Tl и 81Krm. Радиоизотоп 123I способен успешно заменить 131I, поскольку первый распадается вследствие электронного захвата и испускает γ-кванты энергией 159 кэВ с периодом полураспада 13 ч. Указанный изотоп легко связывается протеинами и фармпрепаратами, которые могут быть йодированы. Однако, как и большинство перечисленных радиоизотопов, 123I синтезируют с помощью циклотрона, и поэтому в настоящее время он имеет еще очень большую стоимость в очищенном от других изотопов йода виде.
Радионуклиды 111In и 67Ga химически весьма схожи друг с другом, поскольку оба распадаются посредством электронного захвата.
Радионуклид 111In является прекрасным изотопом для задач визуализации. Он испускает γ-кванты с энергиями, необходимыми для исследований на g-камерах. Недостатком его является высокая стоимость, поскольку он получается путем бомбардировки мишени заряженными частицами. Радионуклид 67Ga в форме цитрата галлия долгое время использовался в качестве радиоиндикатора при локализации опухолей и обнаружении абсцессов. Радионуклид 201Tl применяется для диагностики кровоснабжения миокарда, поскольку этот изотоп, подобно калию, накапливается сердечной мышцей. Однако здесь используется РИ с энергией 80 кэВ, что близко к энергии характеристического РИ свинца, исходящего от коллиматора. Последнее обстоятельство, а также большой период полураспада (73 ч) делают этот изотоп малоэффективным для визуализации.
Радиоизотопы, испускающие позитроны (см. табл. 6.3), нашли широкое применение для физиологических исследований. Радионуклиды 15О, 13N, 11С и 18F имеют много применений в области функциональной диагностики, однако из-за труднодоступности редко используются при проведении рутинных обследований в ядерной медицине, поскольку необходимо иметь поблизости циклотрон для их получения. Однако два позитронных излучателя 68Ga и 82Rb, синтезируемые с помощью генераторов, могут стать неоценимыми РФП в клинической позитронно-эмиссионной томографии (ПЭТ). В частности, радионуклид 68Ga может, подобно 99Тсm, использоваться для мечения многих веществ, тогда как 82Rb более целесообразно применять при диагностике кровоснабжения миокарда вместо 201Тl. Указанные радиоизотопы, а также разработка дешевых ПЭТ-камер (см. §6.4.6) могут обеспечить в клинической ядерной медицине давно ожидаемое сочетание высокой чувствительности и пространственного разрешения.
6.4.4. Гамма-камеры
Для обнаружения распределения радионуклидов в разных органах используют гамма-топограф (сцинтиграф ), который автоматически регистрирует интенсивности радиоактивного препарата (сцинтиграмму). Это сканирующий счетчик, который постепенно проходит большие участки над телом больного. Регистрация излучения фиксируется, например, штриховой отметкой на бумаге. Это дает сравнительно грубое распределение ИИ в органах. Более детальные сведения можно получить методом авторадиографии. На исследуемый объект наносится слой чувствительной фотопленки, в которой оставляют след содержащиеся в объекте радионуклиды. Полученный снимок называют радиоавтографом или авторадиограммой.
Установки, позволяющие проводить количественный анализ сцинтиграмм, получили, возможно, не очень точно отражающее их основное назначение, но общепринятое название гамма-камер.
Функционально гамма-камера представляет собой совокупность четырех основных блоков: коллиматора, позиционно-чувствительного детектора γ-квантов, электронной системы формирования координатных сигналов и устройства представления и регистрации изображения.
Позиционно-чувствительным детектором (ПЧД) γ-квантов называют детектор, который позволяет определять координаты попадания в него квантов γ-излучения и, как правило, одновременно и энергию, переданную квантом чувствительному объему детектора. ПЧД — основной, принципиально важный блок гамма-камеры, определяющий качество получаемого изображения и специфику прибора в целом. Наиболее общие требования, предъявляемые к характеристикам ПЧД и вытекающие из назначения и условий применения гамма-камер, касаются эффективности регистрации и площади чувствительной поверхности детектора. Для визуализации быстропротекающих процессов в организме, например, прохождения РФП через камеры сердца, требуется получать статистически достоверные изображения за время не более 0,1 с. Поэтому к детекторам гамма-камер предъявляются требования высокой эффективности регистрации в диапазоне энергий примерно до 500 кэВ. Максимальные требования к полезной площади детектора предъявляются при визуализации скелета пациента и выражаются в величине площади примерно 50×200 см. Для большинства исследований внутренних органов и систем, проводимых с помощью гамма-камер, достаточно иметь площадь детектора порядка 103 см2, позволяющую одновременно визуализировать, например, оба легких или легкое и печень. Указанное значение полезной площади обычно считается минимально допустимым при конструировании гамма-камеры.
Наибольшее распространение на практике получили сцинтилляционные позиционно-чувствительные детекторы (СПЧД). Сцинтилляционный метод регистрации удачно сочетает высокую эффективность регистрации и хорошее быстродействие с большой полезной площадью детектора. Тем самым все существующие диагностические методики обеспечиваются достаточным энергетическим и пространственным разрешением.
Основными метрологическими характеристиками гамма-камеры, опреде-ляющими информативность и эффективность диагностического процесса, являются чувствительность, пространственное и энергетическое разрешение, характеристика скорости счета, однородность и линейность изображения.
Все характеристики гамма-камеры можно разделить на системные и соб-ственные. Системные характеристики измеряются для гамма-камеры вместе с коллиматором, при этом значения характеристик для различных коллиматоров могут существенно различаться. Поскольку обычно гамма-камеры снабжаются несколькими сменными коллиматорами, целесообразно наряду с системными рассматривать собственные характеристики, измеряемые без коллиматора.
Блок-схема классической гамма-камеры (типа Ангера) состоит из корпуса детекторной головки, фотоэлектронных умножителей (ФЭУ), коллиматора, сцинтилляционного кристалла, линейного усилителя с сумматором, амплитудного селектора, системы представления данных, изображения исследуемого органа. γ-кванты, испускаемые РФП, распределенным в теле пациента, через коллиматор попадают на СПЧД. Параметры коллиматора обычно выбираются так, чтобы обеспечить попадание γ-излучения из каждого элементарного объема источника на соответствующий достаточно малый элемент чувствительной поверхности детектора. Тем самым осуществляется преобразование трехмерного распределения РФП в проекционное двумерное распределение частоты актов взаимодействия γ-квантов с веществом детектора, т.е. планарное распределение сцинтилляционных вспышек света.
При попадании γ-кванта в сцинтилляционный кристалл возникает вспышка света, под воздействием которой на анодах всех ФЭУ одновременно появляются импульсы тока, амплитуда которых тем выше, чем ближе расположен данный ФЭУ к точке сцинтилляции. Сигналы ФЭУ усиливаются зарядово-чувствительными предусилителями и поступают на резисторную матрицу. Выход каждого предусилителя подключается ко входам сумматоров позиционных сигналов через сопротивления резисторной матрицы, величина которых определяет вклад данного ФЭУ в суммарный сигнал. На выходе резисторной матрицы формируются четыре позиционных сигнала + X, - X, + Y, - Y и энергетический сигнал Z. Сопротивления матрицы рассчитываются так, чтобы позиционные сигналы + X, + Y линейно возрастали в положительном направлении соответствующих осей координат, а – X, – Y — в отрицательном. При этом разность позиционных сигналов + X и – X (+ Y и – Y) прямо пропорциональна одноименной координате сцинтилляции и меняет знак в центре сцинтилляционного кристалла. Энергетический сигнал формируется суммированием сигналов всех ФЭУ с равными весами на входе сумматора энергетического сигнала. При настройке детектора индивидуальной регулировкой чувствительности ФЭУ за счет изменения ускоряющего напряжения между динодами добиваются независимости амплитуды энергетического сигнала от местоположения сцинтилляций. Сформированный таким образом энергетичес-кий сигнал пропорционален энергии взаимодействия γ-кванта с веществом кристалла и может использоваться для дискриминации неинформативных событий. Координатные сигналы X и Y определяют местоположение каждого полезного акта взаимодействия в кристалле. Совокупность сигналов X, Y, Z позволяет сформировать изображение распределения РФП.
Основной характеристикой коллиматора и детектора в целом является чувствительность к точечному источнику γ-излучения, определяемая как средняя частота регистрируемых импульсов при размещении такого источника в точке непосредственно перед детектором. Не менее важным свойством гамма-камеры является способность передавать без искажений информацию обо всем характере пространственного распределения радионуклида в объекте, или пространственное разрешение, определяемое через функцию передачи модуляции. Требования высокой чувствительности и высокого пространственного разрешения противоречат друг другу, и для достижения оптимума используются коллиматоры различных конструкций.
Кроме чувствительности и пространственного разрешения, используются другие характеристики гамма-камер: пространственная неоднородность чувст-вительности, линейность функции отклика, размер поля зрения, быстродейст-вие и т.д. Современные гамма-камеры значительно отличаются от классической гамма-камеры типа Ангера по уровню характеристик и имеют существенные конструктивные и функциональные отличия. К основным изменениям, опреде-ляющим современный облик гамма-камеры, относятся: применение пороговой схемы формирования сигналов и световодов с переменной оптической плотно-стью; наличие микропроцессорной системы автоматической настройки и стаби-лизации блока детектирования; применение встроенных микропроцессорных систем коррекции неоднородности и нелинейности изображений и средств современной вычислительной техники для автоматизации сбора данных, представления, обработки и архивации изображений.
В результате функциональной специализации сложились следующие основные модификации гамма-камер: стационарные, сканирующие все тело человека; томографические; специализированные (передвижные, для кардиологических исследований).
Основными конструктивными элементами стационарной гамма-камеры являются блок детектирования, штатив и контрольно-измерительный пульт. Помимо этих основных элементов в комплект гамма-камеры входят ряд вспо-могательных приспособлений, поставляемых по желанию заказчика, как-то: сменные коллиматоры, кровать-каталка, видеомонитор для контроля правиль-ности укладки пациента и т.п. Блок детектирования закрепляется на штативно-поворотном устройстве, управление перемещениями блока детектирования осуществляется с помощью выносного малогабаритного пульта.
Особое место среди прочих типов гамма-камер занимают камеры, сканирующие все тело (ВТ) человека (типа ВТ). Такие гамма-камеры снабжены устройством перемещения блока детектирования вдоль тела пациента и системой синхронного перемещения изображения относительно матрицы, на которой осуществляется регистрация изображения. В различных модификациях гамма-камер типа ВТ применяется как перемещение штатива с блоком детектирования относительно ложа пациента (ВТ типа 1), так и перемещение специального стола, на котором расположен пациент, относительно неподвиж-ного блока детектирования (ВТ типа 2). Достоинством камер типа 1 является относительно небольшая площадь, необходимая для размещения системы, не-достатком — необходимость значительных конструктивных изменений штати-ва и трудность обеспечения равномерного движения штатива с блоком детекти-рования из-за их значительной массы. Достоинствами камер типа 2 являются относительная простота и малая требуемая мощность электромеханических узлов, возможность использования стандартной гамма-камеры без каких-либо конструктивных изменений, зато безусловным недостатком является требование большой площади (примерно вдвое большей, чем для камер типа 1).
Для обследования нетранспортабельных больных используют передвижные гамма-камеры. Передвижные гамма-камеры по сравнению со стационарными имеют меньший диапазон энергий γ-излучения и меньший размер поля зрения, в остальном же они не отличаются от стационарных по метрологическим характеристикам.
Важную тенденцию, присущую современному приборостроению, отражает интенсивное внедрение в работу сцинтилляционных гамма-камер цифровых электронных устройств. Можно утверждать, что в ближайшем будущем все аналоговые гамма-камеры полностью трансформируются в цифровые. Первым шагом в этом направлении была замена аналогового осциллографического дисплея на цифровой графический и переход от аппаратного управления режимом исследования к диалоговому, т.е. к диалогу оператора с встроенной микропроцессорной системой. Изображение формировалось на матрице размером 256×256 элементов и воспроизводилось как минимум с 64 градациями яркости. Современные матрицы позволяют получать значительно более высокое разрешение и число градаций яркости, но главное здесь не в количественных показателях исследования (прогресс технологий может существенно расширять эти возможности), а в качественном изменении характера исследования. Переход к цифровой обработке информации позволяет резко сократить время обследования (повторные обследования не требуются), получать многочисленные копии изображений, изменять в широких пределах контраст изображения, вводить результаты исследования в компьютер для последующей всесторонней обработки в соответствии с имеющимся пакетом программ (следовательно, повышать надежность и воспроизводимость полученной информации) и т.п. Работа в диалоговом режиме позволяет резко снизить требования к технической подготовке оператора и тем самым многократно расширить сферу применения аппаратуры. В цифровых гамма-камерах блок детектирования можно рассматривать как устройство ввода данных в компьютер и управляемое от самого компьютера. Следовательно, цифровую гамма-камеру вполне логично объединить конструктивно с компьютерной системой обработки информации, превратив их в интегрированный измерительно-информационный комплекс.