Глава 1. Химический состав клетки
Урок 1. Неорганические соединения § 1
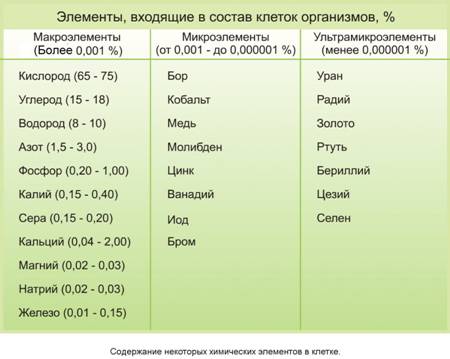
Химические элементы клетки.
Все клетки, независимо от уровня организации, сходны по химическому составу. В клетке содержится несколько тысяч веществ, которые участвуют в разнообразных химических реакциях. В живых организмах обнаружено около 80 химических элементов периодической системы Д.И.Менделеева. Для 24 элементов известны функции, которые они выполняют в организме, это биогенные элементы. По количественному содержанию в живом веществе элементы делятся на три категории:
|
O, C, H, N – около 98% от массы живого вещества, элементы 1-ой группы;
K, Na, Ca, Mg, S, P, Cl, F e – элементы 2-ой группы. (1,9% массы живого вещества).
Микроэлементы (Zn, Mn, Cu, Co, Mo и многие другие), доля которых составляет от 0,001% до 0,000001. Микроэлементы входят в состав биологически активных веществ – ферментов, витаминов и гормонов.
Ультрамикроэлементы (Au, U, Ra и др.), концентрация которых не превышает 0,000001%. Роль большинства элементов этой группы до сих пор не выяснена.
Макро- и микроэлементы присутствуют в живой материи в виде разнообразных химических соединений, которые подразделяются на неорганические и органические вещества.
Неорганические соединения клетки.
К неорганическим веществам относятся: вода, составляющая примерно 70-80% массы организма; минеральные вещества – 1-1,5%.
|
Без воды жизнь невозможна. Она не только обязательный компонент живых клеток, но и среда обитания организмов. Биологическое значение воды основано на ее химических и физических свойствах.
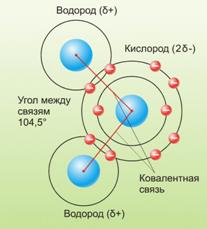
Химические и физические свойства воды объясняются, прежде всего, малыми размерами молекул воды, их полярностью и способностью соединяться друг с другом водородными связями. В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Молекула полярна: кислородный атом несет небольшой отрицательный заряд, а два водородных — небольшие положительные заряды. Это делает молекулу воды диполем. Поэтому при взаимодействии молекул воды друг с другом между ними устанавливаются водородные связи. Они в 15-20 раз слабее ковалентной, но, поскольку каждая молекула воды способна образовывать 4 водородные связи, они существенно влияют на физические свойства воды.
Большая теплоемкость, теплота плавления и теплота парообразования объясняются тем, что большая часть поглощаемого водой тепла расходуется на разрыв водородных связей между ее молекулами. Вода обладает высокой теплопроводностью. Вода практически не сжимается, прозрачна в видимом участке спектра. Наконец, вода – вещество, плотность которого в жидком состоянии больше, чем в твердом, при 4ºС у нее максимальная плотность, у льда плотность меньше, он поднимается на поверхность и защищает водоем от промерзания.
Физические и химические свойства делают ее уникальной жидкостью и определяют ее биологическое значение. Вода – хороший растворитель ионных (полярных), а также некоторых не ионных соединений, в молекуле которых присутствуют заряженные (полярные) группы. Любые полярные соединения в воде гидратируются (окружаются молекулами воды), при этом молекулы воды участвуют в образовании структуры молекул органических веществ. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами вещества, то вещество растворяется. По отношению к воде различают: гидрофильные вещества – вещества, хорошо растворимые в воде; гидрофобные вещества – вещества, практически нерастворимые в воде. Большинство биохимических реакций может идти только в водном растворе; многие вещества поступают в клетку и выводятся из нее в водном растворе. Большая теплоемкость и теплопроводность воды способствуют равномерному распределению тепла в клетке.
Благодаря большой потери тепла при испарении воды, происходит охлаждение организма. Благодаря силам адгезии и когезии, вода способна подниматься по капиллярам (один из факторов, обеспечивающих движение воды в сосудах растений). Вода является непосредственным участником многих химических реакций (гидролитическое расщепление белков, углеводов, жиров и др.). Определяет напряженное состояние клеточных стенок (тургор), а также выполняет опорную функцию (гидростатический скелет, например, у круглых червей).
Минеральные вещества клетки. В основном представлены солями, которые диссоциируют на анионы и катионы. Для процессов жизнедеятельности клетки наиболее важны катионы К+, Na+, Ca2+, Mg2+, анионы HPO42-, Cl-, HCO3-. Концентрации ионов в клетке и окружающей ее среде различны. Например, во внешней среде (плазме крови, морской воде) K+ всегда меньше, а Na+ всегда больше, чем в клетке. Существует ряд механизмов, позволяющих клетке поддерживать определенное соотношение ионов в протопласте и внешней среде.
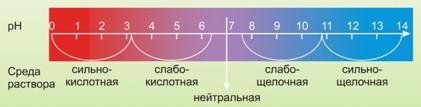
Различные ионы принимают участие во многих процессах жизнедеятельности клетки: катионы К+, Na+, Cl- обеспечивают возбудимость живых организмов; катионы Mg2+, Mn2+, Zn2+, Ca2+ и др. необходимы для нормального функционирования многих ферментов; образование углеводов в процессе фотосинтеза невозможно без Mg2+ (составная часть хлорофилла); буферные свойства клетки (поддержание слабощелочной реакции содержимого клетки) поддерживается анионами слабых кислот (НСО3-, НРО4-) и слабыми кислотами (Н2СО3);
Фосфатная буферная система:
Низкий pH Высокий pH
НРО42- + Н+ ←―――――――→H2PO4-
Гидрофосфат — ион Дигидрофосфат — ион
Бикарбонатная буферная система:
Низкий pH Высокий pH
НСО3- + Н+ ←―――――――→ H2СO3
Гидрокарбонат — ион Угольная кислота
|
Некоторые неорганические вещества содержатся в клетке не только в растворенном, но и в твердом состоянии. Например, Са и Р содержатся в костной ткани, в раковинах моллюсков в виде двойных углекислых и фосфорнокислых солей.
Карточка у доски:
1. Какие элементы относятся к элементам 1-й группы?
2. Какие элементы относятся к элементам 2-й группы?
3. Как заряжен кислород и атомы водорода в молекуле воды?
4. Какие связи удерживают молекулы воды друг около друга?
5. При какой температуре вода имеет максимальную плотность?
6. Каково соотношение ионов натрия и калия по обе стороны наружной клеточной мембраны?
7. В клетке поддерживается определенная концентрация водородных ионов, слабощелочная, почти нейтральная среда. Какие реакции поддерживают рН?
8. Верно ли утверждение: «Дигидрофосфат-ионы способны понизить рН клетки, превращаясь в гидрофосфат-ионы»?.
Письменная работа с карточками на 10 мин:
1. Биологически важные химические элементы.
2. Значение для клетки химических элементов.
3. Какие ионы содержатся в клетке? Их биологическая роль?
4. Вода и ее роль для живых организмов.
Тестовое задание:
**Тест 1. К империи Клеточные, надцарству Прокариоты относятся:
1. Вирусы.
2. Архебактерии.
3. Эубактерии.
4. Синезеленые.
**Тест 2. К империи Клеточные, надцарству Эукариоты относятся:
1. Вирусы. 5. Эубактерии.
2. Грибы. 6. Синезеленые.
3. Растения. 7. Животные.
4. Архебактерии.
**Тест 3. К элементам 1-й группы относятся:
1. Сера. 5. Водород.
2. Кислород. 6. Железо.
3. Углерод. 7. Азот.
4. Фосфор. 8. Кальций.
**Тест 4. Верные суждения:
1. Молекула воды не имеет заряда.
2. Молекула воды – диполь.
3. На кислороде в молекуле воды небольшой отрицательный заряд, на водороде – положительный.
4. На кислороде в молекуле воды небольшой положительный заряд, на водороде – отрицательный.
**Тест 5. Верные суждения:
1. Молекулы воды удерживаются друг около друга ковалентными связями.
2. Молекулы воды удерживаются друг около друга водородными связями.
3. Ковалентные связи прочнее в 15-20 раз водородных.
4. Водородные связи прочнее в 15-20 раз ковалентных.
Тест 6. Вода имеет максимальную плотность при:
1. 0ºС.
2. 4ºС.
3. 20ºС.
4. 25ºС.
Тест 7. Соотношение ионов натрия и калия по обе стороны наружной клеточной мембраны:
1. Снаружи клетки всегда больше калия и меньше натрия, чем внутри.
2. Снаружи клетки всегда больше натрия и меньше калия, чем внутри.
3. Натрия и калия снаружи клетки всегда больше, чем внутри.
4. Натрия и калия внутри клетки всегда больше, чем снаружи.
Тест 8. В клетке поддерживается определенная концентрация водородных ионов, слабощелочная, почти нейтральная среда. Поддерживают рН:
1. Реакции гидролиза.
2. Реакции гидратации.
3. Реакции конденсации.
4. Буферные реакции.
Тест 9. Утверждение: «Дигидрофосфат-ионы способны понизить рН клетки, превращаясь в гидрофосфат-ионы»:
1. Верно.
2. Ошибочно.
**Тест 10. Верные суждения:
1. Жиры относятся к гидрофильным веществам.
2. Вода обладает большой теплоемкостью и теплопроводностью.
3. Щелочная среда – если водородных ионов много.
4. Вода принимает участие в образовании структуры молекул растворенных веществ.