Выделяют местное и общее действие опухоли на организм. Местное действие четко связано с конкретной локализацией опухоли в организме. Примерами местного действия опухоли могут являться кишечная непроходимость при быстром экзофитном росте опухоли кишки, дыхательная недостаточность при обтурации опухолью просвета крупного бронха, развитие болевого синдрома при прорастании опухолью нервных стволов и сплетений, а также кровотечение при аррозии крупного сосуда. Однако, как правило опухоль оказывает влияние не только на функцию органа, из которого она происходит, но и на весь организм. Такие нарушения носят системный характер и не зависят от локализации опухоли. Системные изменения, возникающие в результате общего действия опухоли на организм, называют паранеопластическими синдромами (от греч. «para» - около + «neos» - новый + «plasma» - нечто образованное). Необходимо отметить, что в ряде случаев паранеопластические синдромы обнаруживаются раньше, чем признаки местного действия опухоли на организм. Это определяет большое диагностическое значение паранеопластических синдромов. К ним относятся раковая кахексия, изменения в системе крови, эндокринные, неврологические, кожные нарушения, а также нарушения функции почек и соединительной ткани. Необходимо отметить, что в основе патогенеза большинства паранеопластических синдромов лежит активация иммунной системы носителя опухоли и развитие аутоиммунного повреждения различных органов и тканей.
Ниже рассматривается патогенез наиболее часто встречающихся паранеопластических синдромов.
7.1. Раковая кахексия
Нередко развитие опухолей сопровождается истощением больного, мышечной слабостью и выраженной утомляемостью - раковой кахексией. Это связано со следующими причинами:
· Анорексией, часто развивающейся у онкологических больных. Анорексия развивается вследствие нарушения восприятия вкусовых рецепторов и пищевых центров в гипоталамусе под действием циркулирующих в крови продуктов распада опухоли. Нередко такие больные страдают от тошноты, особенно часто возникающей под действием медикаментозных препаратов, применяющихся для лечения.
· Повышением уровня провоспалительных цитокинов, стимулирующих катаболические процессы. При опухолевом росте макрофаги усиленно образуют фактор некроза опухолей-α (ФНО-α), который в высоких концентрациях способен вызывать кахексию (ФНО-α имеет второе название “кахектин”).
· Нехватка питательных веществ для организма на фоне “обкрадывания” его опухолью, поскольку последняя усиленно потребляет витамины, глюкозу, аминокислоты и другие нутриенты. Так, у онкологических больных скорость метаболизма глюкозы может в два раза превышать таковую у здоровых людей, что требует ее повышенного поступления в организм. В пересчете на энергетические запасы организма такой оборот глюкозы эквивалентен расщеплению 900 г жировой ткани в месяц.
7.2. Изменения в системе крови
Анемия. Анемия является наиболее частым системным проявлением опухолевого роста. Известно, что к моменту постановки диагноза около 40% пациентов со злокачественными опухолями имеют анемию. Анемия при опухолевом росте развивается в результате воздействия целого ряда патогенетических факторов:
· Наиболее часто при злокачественных опухолях развивается гипопластическая анемия, связанная с угнетением эритропоэза. Центральная роль в подавлении образования эритроцитов принадлежит активации иммунной системы. Реакция иммунной системы на опухолевые антигены сопровождается усиленным образованием таких провоспалительных цитокинов, как интерферон-γ, интерлейкин-1, интерлейкин-6 и фактор некроза опухолей-α (ФНО-α). Данные цитокины подавляют пролиферацию клеток эритроидного ростка на разных уровнях. Так, например, ФНО-α ингибирует пролиферацию на уровне колониеобразующей единицы эритроцитов. Кроме того, провоспалительные цитокины подавляют образование эритропоэтина в почках. Другие, более редкие механизмы развития гипопластической анемии включают активацию макрофагов красного костного мозга с фагоцитозом предшественников эритроцитов (гематофагоцитоз), а также разрушение клеток эритроидного ростка под действием аутоантител (парциальная красноклеточная аплазия) и множественное метастазирование опухоли в красный костный мозг.
· В некоторых случаях среди механизмов развития анемии у пациентов с опухолями может доминировать дефицит фолиевой кислоты и/или витамина В12, которые усиленно поглощаются опухолевыми клетками.
· Кровотечения из опухолей матки, выделительной системы и органов желудочно-кишечного тракта могут привести к развитию постгеморрагической анемии, а при хронической кровопотере - к железодефицитной анемии.
· Иногда при опухолевом росте возможно развитие гемолитической анемии. Это может быть связано с образованием антител, распознающих антигены эритроцитов (аутоиммунная гемолитическая анемия). Кроме того, гемолиз может быть спровоцирован активацией свертывающей системы крови и повреждением эндотелия при опухолевом росте (микроангиопатическая гемолитическая анемия). Значимое механическое повреждение эритроцитов встречается и при их прохождении через резко измененную сосудистую сеть редко встречающейся опухоли - гигантской гемангиомы.
Эритроцитоз является редким вариантом паранеопластических изменений и развивается в случаях появления эктопического очага образования эритропоэтина. Эритропоэтин иногда вырабатывается при гепатоцеллюлярных карциномах, опухолях почек, мозжечковых гемангиобластомах, реже при опухолях надпочечников, матки, легких.
Лейкопения. Лейкопения у онкологических больных возникает при метастазах опухоли в костный мозг. Изредка лейкопения возникает при гиперспленизме из-за поражения печени метастазами.
Лейкоцитоз. Нередко опухолевый процесс сопровождается развитием лейкоцитоза, что связано с повышенным образованием цитокинов TNF-a и ИЛ-1 макрофагами в ответ на стимуляцию опухолевыми антигенами. Наиболее часто отмечается нейтрофильный и моноцитарный лейкоцитоз.
Тромбоцитопении возникают у онкологических больных вследствие замещения костного мозга метастазами опухоли, а также из-за повышенного разрушения их при образовании аутоантител. Иногда развивается тромбоцитопения из-за повышенного потребления тромбоцитов при развитии ДВС-синдрома.
7.3. Нарушения гемостаза
В большинстве случаев при опухолевых заболеваниях отмечается повышенная активность свертывающей системы крови, что угрожает развитием тромбоза сосудов, в первую очередь вен, и возможным развитием тромбоэмболии. Периодическое повторяющееся тромботическое поражение вен (мигрирующий флеботромбоз) при злокачественных опухолях известно под названием синдрома Труссо. Последствия расстройств гемостаза являются опасными для жизни.
В основе гиперкоагуляции и тромбофилии при опухолевом росте лежат несколько механизмов. С одной стороны, происходит повышение концентрации в крови некоторых прокоагулянтов (в частности, факторов V, VIII, IX, XI) за счет усиленного их синтеза в печени. Следует также отметить, что клетки многих опухолей активно продуцируют тканевой фактор, запускающий внешний путь свертывания крови. Опухолевые клетки также могут стимулировать синтез тканевого фактора моноцитами. С другой стороны, может отмечаться относительная недостаточность активности антикоагулянтов. В частности, при множественной миеломе и при раке молочной железы возникает устойчивость к активному протеину С (АПС), снижается активность антитромбина III. Неоднозначные изменения наблюдаются в системе фибринолиза. Концентрация активаторов плазминогена выше при опухолевом процессе благодаря их местной продукции опухолевой тканью. Например у больных с раком желудка продукция урокиназного активатора плазминогена (uPA) и количество рецепторов к нему значительно выше в опухолевой ткани, чем в здоровой, что коррелирует со стадией процесса. В тех случаях, когда опухолевый процесс вызывает избыточную экспрессию uPA и рецепторов к uPA, значительно снижается выживаемость по сравнению с теми больными, у которых этого не наблюдается. Однако, при многих формах опухолей параллельно с активацией фибринолиза усиливается продукция PAI, что в итоге приводит к относительной недостаточности фибринолиза и способствует развитию тромбоза.
В некоторых случаях при опухолевом росте происходит насколько интенсивное поступление в кровь тканевого фактора, что развивается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром). Наиболее частым клиническим проявлением ДВС синдрома при злокачественных опухолях является кровотечение. Лабораторные тесты выявляют дефицит фибриногена, тромбоцитов и повышение D-димера, продуктов деградации фибрина и растворимого фибрина.
Различные механизмы гиперкоагуляции и тромбоза при опухолевом росте показаны на рис. 8.
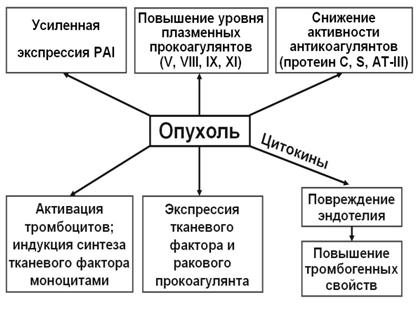
Рис. 8. Механизмы гиперкоагуляции и тромбоза при опухолевом росте.
Нарушения микроциркуляции. Нарушения микроциркуляции связаны с неспецифическим воздействием продуктов распада и метаболизма опухоли на состояние эндотелия на системном уровне. При опухолевом росте в микрососудах различных органов возрастает адгезивность эндотелия к лейкоцитам, повышается тромбогенность и снижается тромборезистентность сосудов, что приводит к развитию стаза в микрососудах и в последствии к капилляро-трофической недостаточности.
7.4. Эндокринопатии при опухолевом процессе
Эндокринопатии - классический паранеопластический процесс, если их причиной является эктопический очаг секреции гормонов. К эндокринопатиям, ассоциированным с опухолевым процессом, относятся:
· Синдром Иценко-Кушинга. Этот синдром часто связан с эктопической продукцией АКТГ или АКТГ-подобного пептида. Нередко этот синдром развивается при раке легкого, иногда сопровождает рак яичников, щитовидной железы, поджелудочной железы и других органов.
· Карциноидный синдром. Карциноидом называется опухоль, происходящая из клеток АPUD-системы. В 85% случаев опухоль локализуется в желудочно-кишечном тракте; в 10% - в легких; в 5% - в остальных органах. Основные вещества, вырабатываемые карциноидами - это серотонин, кинины и кишечные гормоны - гастрин, вазоактивный интестинальный полипептид (ВИП), соматостатин и др. При чрезмерном образовании этих веществ и гормонов возникают нарушения сердечно-сосудистой системы и желудочно-кишечного тракта: гиперсекреция желудочного сока, диарея, гипокалиемия и метаболический алкалоз, нарушения артериального давления и другие расстройства.
· Гиперкальциемия. Гиперкальциемия связана с несколькими механизмами:
a) Остеолизом (возникает у 10-20% больных при метастазировании опухоли в кости);
b) Эктопическим образованием паратгормона (ПТГ) или ПТГ- связанного протеина.
c) Повышенное образование ТФРa, a-TNF, простагландинов (PGE2), а также стабильных метаболитов витамина Д, что иногда наблюдается при раке молочной железы, легкого, почек. Эти факторы (ТФРa, a-TNF, PGE2) непосредственно стимулируют остеокласты, способствуя резорбции костной ткани и развитию остеопороза и гиперкальциемии.
7.5. Неврологические паранеопластические синдромы
Встречаются приблизительно у 7% онкологических больных. Они быстро проявляются, характеризуются тяжелым течением и могут поражать как вегетативную, так и соматическую нервную систему включая ее центральные и периферические отделы. Патогенез нарушений функции нервной системы связывают с выработкой аутоантител, направленных против опухолевых клеток и обладающих специфичностью по отношению к компонентам нервной ткани. Наиболее часто неврологические нарушения возникают при раке легкого, особенно мелкоклеточном, при раке молочной железы, яичников и лимфоме. Погибающие опухолевые клетки способны «упаковывать» свои внутриклеточные белки в окруженные мембраной везикулы, которые фагоцитируются дендритными клетками (АПК). Вскоре после этого, опухолевые белки процессируются лизосомами и презентируются в комплексе с MHC II Т-хелперам. В патогенезе неврологических паранеопластических симптомов могут играть роль как Т-хелперы 1 класса, так и Т-хелперы 2 класса. Первые стимулируют созревание цитотоксических CD8+ лимфоцитов, несущих на своей поверхности Т-клеточный рецептор против опухолевого антигена, обладающий при этом сродством и к собственным антигенам нервной ткани. Активированные Т-хелперы 2 запускают созревание В-лимфоцитов в плазмоциты и синтез последними антител, аффинных к аутоантигенам, локализованным преимущественно в периферической нервной системы. В роли последних могут выступать пресинаптические потенциал-зависимые кальциевые каналы, что приводит к развитию миастенического синдрома Ламберта-Итона. Образование аутоантител к олигодендроцитам, нейронам мозжечка, ствола мозга, спинного мозга и зрительного нерва, а также к компонентам цитоплазмы клеток Пуркинье и нервным элементам кишечника и почек приводит к нарушению вазомоторных рефлексов, аутоиммунным поражениям мезентериальных нейронов, ортостатической гипотензии, нарушению моторики желудочно-кишечного тракта, нарушению вегетативной регуляции сердца, нейрогенной дисфункции мочевого пузыря, импотенции, а также снижению секреции слезной жидкости и слюны. Характерными центральными проявлениями паранеопластического синдрома являются энцефаломиелит, мозжечковая атаксия и подострая сенсорная нейропатия.
7.6. Дерматологические паранеопластические синдромы
Встречаются в 1-10% случаев при онкологических заболеваниях и связаны либо с эндокринопатиями, либо с аутоиммунными нарушениями. Наиболее ранним кожным нарушением, распознаваемым как паранеопластический синдром, является черный акантоз или acanthosis nigricans. Хотя это нарушение может возникать самостоятельно, тяжелый acanthosis nigricans часто ассоциирован со злокачественными опухолями, особенно аденокарциномами желудочно-кишечного тракта. Акантоз проявляется в виде синюшно-фиолетовых бляшек на шее, межпальцевых промежутках или слизистой твердого неба. Механизм образования подобных бляшек связывают с усилением продукции при опухолевом росте ТФРα, стимулирующего рецепторы эпидермального фактора роста в эпидермисе.
Паранеопластическая пузырчатка (pemphygus) связана со многими лимфопролиферативными заболеваниями. Главными критериями для диагностики паранеопластической пузырчатки являются полиморфные кожные высыпания, неоплазия и позитивная серодиагностика. Гистологическими критериями пузырчатки являются акантолиз и наличие иммуноглобулина G и компонента комплемента С3. В основе развития паранеопластической пузырчатки лежит выработка аутоантител, направленных против десмоглеина 1 и 3, а также антител против белков семейства десмосом – периплакина и энвоплакина.
Генерализованный и трудноизлечимый зуд также может являться одним из проявлений паранеопластического синдрома при лимфоме.
7.7. Нарушения функции почек при опухолевом росте
Мембранозный гломерулонефрит является наиболее часто встречаемой причиной нефротического синдрома у взрослых. Морфологически представляет собой утолщение гломерулярной капиллярной мембраны за счет диффузно расположенных иммунных комплексов. Среди опухолей, обуславливающих появление мембранозного гломерулонефрита, можно отметить карциномы органов желудочно-кишечного тракта, урогенитального тракта, меланому, опухоли мозга, опухоли легких, бронхов и др. В механизме развития мембранозного гломерулонефрита считается необходимым присутствие антигенов, например, эмбрионального ракового антигена, специфического простатического антигена, меланомных антигенов и др. опухолевых маркеров. Существует структурное сходство между опухолевыми антигенами и антигенами клубочков и перекрестные реакции со специфическими антителами. При этом формируется комплекс антиген/антитело, откладывающийся в области гломерулярной мембраны. Цитокины (Il-2, Il-4, Il-13) и факторы роста (особенно СЭФР) играют важную роль в развитии мембранозного гломерулонефрита путем увеличения проницаемости гломерулярной базальной мембраны для белков. Повышение продукции СЭФР связано с пролиферацией подоцитов и гломерулопатией, сопровождающейся протеинурией.
IgA нефропатия. Отложения иммунных комплексов, содержащих IgA,были обнаружены при опухолях слизистой оболочки органов желудочно-кишечного тракта, респираторного тракта и легких. Вероятно, при инвазивном росте опухоли возникают условия для повышения в крови циркулирующего IgA, продуцируемого интерстициальными плазматическими клетками. В механизме развития этого ренального нарушения важно также увеличение числа активных В-лимфоцитов и плазмоцитов, продуцирующих IgA, а также гиперэкспрессия TGF-β, ИЛ-4. Зачастую наблюдается сочетание IgA нефропатии и паранеопластической пурпуры Шенляйн-Геноха.
При опухолях желудочно-кишечного тракта, раке молочной железы, меланоме, мезотелиоме и раке легкого возможно развитие фокально-сегментарного гломерулосклероза, мезангиокапиллярного гломерулонефрита (болезнь плотных мембран) и быстропрогрессирующего гломерулонефрита, которые сопровождаются развитием тяжелого нефротического синдрома и снижением выживаемости больных.
7.8. Нарушения соединительной ткани при опухолях
ревматоидные проявления при опухолевом процессе могут быть связаны как с интоксикацией, так и с иммунно-опосредованными механизмами. Как и другие паранеопластические синдромы, эти нарушения зачастую предшествуют клиническим проявлениям опухоли. Ревматоидно-подобный синдром и феномен Рейно могут манифестировать при опухолях легких, остеосаркомах у детей, опухолях толстой кишки, раке молочной железы, яичников, желудка, печени, яичников и яичек, при меланоме и лимфомах.
8. Методы Экспериментального Изучения опухолей
Существует несколько методов изучения опухолевого роста в эксперименте: трансплантация, индукция, а также использование линейных животных с повышенной частотой развития опухолей и генетически модифицированных животных.
Трансплантация опухоли. Впервые успешная трансплантация опухоли от взрослой собаки щенку была произведена отечественным ученым Н.М. Новинским в 1876 году. Метод трансплантации опухоли достаточно прост в воспроизведении, хотя требует соблюдения определенных правил.
· Опухоль практически не перевивается от одного вида животного к другому, слишком сильные видоспецифические антигены вызывают мощную иммунную реакцию и уничтожение опухолевых клеток.
· Животное, которому перевивается опухоль, должно иметь высокую степень реактивности, поскольку в канцерогенезе имеет значение не только влияние опухолевой клетки на окружающие ткани, но и реакция организма на эту клетку, наличие субстратов для адгезии, роста опухолевой ткани. Обычно этим требованиям отвечают молодые животные.
· Количество перевиваемой опухолевой ткани должно быть достаточно большим, т.к. одна или несколько опухолевых клеток будут уничтожены иммунной системой хозяина.
В последние годы в исследованиях все чаще используют ксенотрансплантацию, т.е. перевивку опухолей человека на животных. Для предотвращения иммунной деструкции трансплантированных клеток для ксенотрансплантации чаще всего используют мышей с выраженным иммунодефицитом, например, атимических безволосых мышей. Выделяют два варианта ксенотрансплантации опухолевой ткани: 1) ортотопическую, при которой фрагмент опухоли человека помещают в тот же орган мыши-реципиента, из которого произошла опухоль пациента, и 2) гетеротопическую, при которой опухолевую ткань трансплантируют подкожно.
К преимуществам использования модели ксенотрансплантации относятся:
· Возможность анализа опухолевой ткани человека, характеризующейся высокой степенью генотипической и фенотипической гетерогенности;
· Возможность персонализированного подбора противоопухолевой терапии;
· Результат относительно устойчивости опухолевых клеток к противоопухолевым препаратам может быть получен в течение всего нескольких недель от момента получения биопсийного материала у пациента.
Относительным недостатком классической модели ксенотрансплантации является наличие глубокого дефекта иммунной системы реципиента. Для решения этой проблемы предложено использовать для ксенотрансплантации атимических мышей, которым предварительно были введены гемопоэтические стволовые клетки человека. Эта процедура, называемая "гуманизацией", позволяет частично восстановить иммунный ответ у животного-реципиента.
Трансплантация опухоли является удобным методом для оценки опухолевой прогрессии, изучения влияния опухоли на организм, и особенно исследования методов лечения опухоли, подборе химиопрепаратов против конкретных видов опухолей.
Индукция опухолей. Данный метод предполагает воздействие на организм животного различными канцерогенными факторами с целью возникновения опухолей. Чаще используют вирусный и химический канцерогенез.
В 1908 году Ellermann и Bang первыми воспроизвели перевивку опухоли (лейкоза) в опытах на птицах с помощью бесклеточного фильтрата, что можно считать первой демонстрацией роли вирусов в канцерогенезе. Затем, аналогичные опыты в 1911 году были выполнены Rous, который путем введения бесклеточного фильтрата куриной саркомы индуцировал развитие этой же опухоли у здоровых птиц. Впоследствии была доказана вирусная природа этих опухолей. Вирус-индуцированные опухоли у лабораторных животных - явление очень частое. Существует множество вирусов, вызывающих опухоли различных локализаций у мышей, хомячков, крыс и т.д. Онкогенные вирусы представлены как ДНК-, так и РНК-содержащими вирусами. У животных опухоли вызываются преимущественно РНК-содержащими вирусами. Существуют линии животных с опухолями, возникающими вследствие зараженности онкогенными вирусами (вирусом рака молочной железы, вирусом лейкоза мышей и т.д.). Хорошо известен так называемый фактор молока Биттнера (онковирус), названный так в честь автора блестящей работы (Bittner, 1936), доказавшего возможность передачи рака молочной железы от мышей высокораковой линии новорожденным мышатам низкораковой линии через материнское молоко.
Индукция опухоли с помощью химических канцерогенов достаточно сложна в исполнении и нередко требует проведения длительного эксперимента. Так, первый удачный опыт по индукции опухоли химическим веществом был выполнен в 1915 году, когда японские исследователи Ямагива и Ишикава сумели вызвать развитие опухоли кожи на ухе кролика после 6-месячного втирания в нее каменноугольной смолы. В экспериментах на животных подтверждается прямой канцерогенный эффект некоторых веществ. Однократная подкожная инъекция бензпирена и других ПАУ в зависимости от дозы после длительного латентного периода (3-4 месяца) приводит к развитию саркомы преимущественно в месте введения. Многократное введение ПАУ приводит к развитию лейкозов, а также опухолей различной локализации с меньшим латентным периодом. Выраженным канцерогенным действием в экспериментальной практике обладают производные нитрозомочевины, вызывая у грызунов (крысы, мыши, морские свинки) опухоли печени, пищевода, желудка, поджелудочной железы.
В настоящее время любые химические вещества, с которыми контактирует человек, а особенно фармакологические препараты, должны испытываться на животных для оценки степени их канцерогенности.
Линейные животные с повышенной частотой развития опухолей. Большое значение в экспериментальной онкологии имеют линейные (инбредные) животные, полученные путем близкородственного скрещивания на протяжении многих поколений. Определенные линии таких животных имеют высокую частоту развития опухолей определенных локализаций, что обычно определяется полигенным наследованием. В качестве примера можно привести самок крыс линии BDII, у которых в 100% случаев развиваются аденокарциномы матки, или самцов линии Lobund-Wistar, c такой же частотой подверженных раку предстательной железы. У самцов мышей линии СВА с высокой частотой развиваются гепатокарциномы, тогда как у самок они выявляются в единичных случаях.
Модели опухолевого роста у генетически модифицированных животных. В последнее время широкое распространение во всем мире получили модели опухолевого роста с использованием генетически модифицированных мышей. Первое поколение таких моделей включало два варианта генетической модификации животных: 1) перманентное удаление (нокаутирование) одного или нескольких антионкогенов (например, Rb, Brca 1, PTEN, p 53 и др.) и 2) введение в геном дополнительных копий онкогенов (трансгенез, например, c - Myc). Однако, такие модели имели ряд недостатков:
· Высокая летальность животных на стадии эмбриона, существенные дефекты развития и стерильность взрослых особей;
· Усиление экспрессии (или удаление) гена во всех клетках организма не отражает реальной ситуации, когда измененные клетки окружены здоровыми клетками;
· В случае трансгенеза затруднен контроль над локализацией введенного гена и количеством его копий;
· Наличие выраженных компенсаторных изменений, влияющих на итоговый фенотип.
В связи с этим в последние годы разработаны усовершенствованные генетические модели опухолей у мышей. Так, например, технология Cre-Lox позволяет обеспечить высокоспецифическое «выключение» антионкогена в определенном органе или ткани в результате воздействия определенного внешнего физического фактора (например, излучения определенной длины волны). Такие животные получили название кондиционных нокаутов. Выключение функции гена при этом осуществляется необратимо в результате активизации внешним фактором рекомбиназы Cre, обеспечивающей исключение из генома гена-мишени, с двух сторон "промаркированного" lox P последовательностями. В то же время, конечной целью моделирования опухолей у генетически измененных животных является возможность обратимого «включения/выключения» любых генов, задействованных в развитии опухоли, в любой ткани и на любой стадии онтогенеза. Частично данную проблему решают тетрациклин-чувствительные генетические конструкции, позволяющие осуществлять обратимое ингибирование экспрессии определенного гена.
Рекомендуемая литература
1. Анисимов В.Н. Современные подходы к изучению канцерогенной безопасности, противоопухолевой, антиканцерогенной и геропротекторной активности фармакологических препаратов / В.Н. Анисимов и соавт. // Вопросы онкологии. - 2012. - Т. 58, №1. - С. 7-18.
2. Аничков Н.М. Биология опухолевого роста (молекулярно-медицинские аспекты) / Н.М. Аничков, И.М. Кветной, С.С. Коновалов. - М.: Олма-Пресс, 2004. - 216 с.
3. Имянитов Е.Н. Молекулярные механизмы опухолевого роста / Е.Н. Имянитов // Вопросы онкологии. - 2010. - Т. 56, № 2. - С. 117-128.
4. Pecorino L. Molecular biology of cancer. Mechanisms, targets, and therapeutics / L. Pecorino. - 3rd edition. - Oxford Press, 2012. - 360 p.
5. Weinberg R.A. The biology of cancer / R.A. Weinberg. - 2nd edition. - Garland Science, 2013. - 960 p.






