Самопроизвольному протеканию химических процессов в изобарно-изотермических условиях способствуют уменьшение энтальпии и увеличение энтропии системы. Первая тенденция характеризуется энтальпийным фактором и выражается через D Н, а вторая - характеризуется энтропийным фактором и количественно выражается через T × D S.
Совместное влияние энтальпийного и энтропийного факторов учитывает изменение энергии Гиббса D G ( )
)
D G = D Н - T × D S,
где Т - абсолютная температура, К.
Самопроизвольно при Р,Т = const в прямом направлении могут протекать реакции, для которых D G < 0. Если D G реакции больше нуля, то такой процесс может протекать самопроизвольно только в обратном направлении. Реакции, имеющие D G = 0, находятся в состоянии равновесия, то есть для них равновероятно прямое и обратное течение процесса.
Расчет изменения энергии Гиббса реакции в стандартных условиях D G  можно осуществить двумя способами:
можно осуществить двумя способами:
1. По уравнению D G  = D Н
= D Н  - Т × D S
- Т × D S  . Расчет D Н
. Расчет D Н  и D S
и D S  подробно рассмотрен ранее.
подробно рассмотрен ранее.
2. По формуле, аналогичной при расчете D Н  реакции через энтальпии образования участников реакции. В этом случае для реакции вида
реакции через энтальпии образования участников реакции. В этом случае для реакции вида
a A + b B = d D + f F
D G  = d D G
= d D G 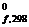 (D) + f D G
(D) + f D G 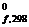 (F) - a D G
(F) - a D G 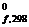 (A) - b D G
(A) - b D G 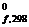 (B),
(B),
где D G 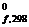 - стандартная энергия Гиббса образования вещества,
- стандартная энергия Гиббса образования вещества,  .
.
Стандартной энергией Гиббса образования вещества D G 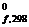 называют изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, находящихся в стандартных условиях. D G
называют изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, находящихся в стандартных условиях. D G 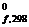 простых веществ равны нулю, а для сложных веществ - определены и содержаться в справочной литературе (см. приложение).
простых веществ равны нулю, а для сложных веществ - определены и содержаться в справочной литературе (см. приложение).
Направление химической реакции, прежде всего, определяется ее природой. Так, для экзотермических реакций (D Н < 0), сопровождающихся возрастанием числа моль газообразных веществ (D S > 0), при любой температуре изменение энергии Гиббса будет отрицательным. То есть независимо от температуры такие реакции могут протекать только в прямом направлении. Наоборот, эндотермические реакции (D Н > 0), сопровождающихся уменьшением числа моль газообразных веществ (D S < 0), независимо от значения температуры в системе могут протекать только в обратном направлении, так как в этом случае D G всегда положительное.
При сочетании D Н > 0, D S > 0 или D Н < 0, D S < 0 возможность протекания реакции в прямом направлении будет зависеть от температуры. При невысоких температурах  , поэтому энтальпийный фактор вносит больший вклад в значение D G. При высоких температурах, когда
, поэтому энтальпийный фактор вносит больший вклад в значение D G. При высоких температурах, когда  , знак D G будет определяться знаком энтропийного фактора.
, знак D G будет определяться знаком энтропийного фактора.
Пример 1. Вычислите D G  реакции двумя способами 2SO2 + О2 = 2SО3.
реакции двумя способами 2SO2 + О2 = 2SО3.
Р е ш е н и е
1. Вычислим D G  , используя справочные данные о D G
, используя справочные данные о D G 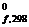 :
:
D G  = 2D G
= 2D G 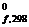 (SO3) - 2D G
(SO3) - 2D G 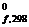 (SO2) - D G
(SO2) - D G 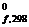 (O2) =
(O2) =
= 2(-371,17) - 2(-300,21) - 0 = -141,92 кДж.
2. Вычислим D G  , используя справочные данные об энтальпии образования и энтропии веществ:
, используя справочные данные об энтальпии образования и энтропии веществ:
D S  = 2 S
= 2 S  (SO3) - S
(SO3) - S  (O2) - 2 S
(O2) - 2 S  (SO2) = 2×256,7 - 205,0 -2×248,1 = -187,8
(SO2) = 2×256,7 - 205,0 -2×248,1 = -187,8  ;
;
D Н  = 2D Н
= 2D Н 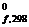 (SО3) - 2D Н
(SО3) - 2D Н 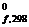 (SO2) = 2(-395,9) - 2(-296,9) = -198,0 кДж;
(SO2) = 2(-395,9) - 2(-296,9) = -198,0 кДж;
D G  = D Н
= D Н  - Т × D S
- Т × D S  = -198000 - 298×(-187,8) = -142036 Дж = -142,0 кДж.
= -198000 - 298×(-187,8) = -142036 Дж = -142,0 кДж.
Пример 2. Определите знак D G, не прибегая к расчетам для реакции
СаОт + СО2, г = СаСО3, т; D Н  = -178,1 кДж/моль.
= -178,1 кДж/моль.
Р е ш е н и е
Реакция экзотермическая, так как D Н  < 0. Протекает с уменьшением числа моль газообразных веществ, следовательно, D S
< 0. Протекает с уменьшением числа моль газообразных веществ, следовательно, D S  < 0. Тогда при невысоких температурах
< 0. Тогда при невысоких температурах  , а знак D G
, а знак D G  отрицательный (реакция протекает в прямом направлении). При высоких температурах
отрицательный (реакция протекает в прямом направлении). При высоких температурах  , следовательно, D G
, следовательно, D G  положительное.
положительное.
Пример 3. Определите температуру равновероятного протекания реакции в прямом и обратном направлении, если D Н = -235 кДж, а D S = -95  .
.
Р е ш е н и е
При равновероятном протекании реакции в прямом и обратном направлении D G = 0. Тогда D Н - T × D S = 0. Отсюда
T = 
 K.
K.
З А Д А Ч И
1. В каком направлении при стандартных условиях будет протекать реакция N2, г + О2, г = 2NO г? Ответ подтвердите расчетами.
2. В каком направлении при стандартных условиях будет протекать реакция N2О г + NО2, г = 3NO г? Ответ подтвердите расчетами.
3. В каком направлении при стандартных условиях будет протекать реакция N2O г + NО = NO2,г + N2, г? Ответ подтвердите расчетами.
4. Можно ли при стандартных условиях восстановить водородом оксиды CuO и PbO? Ответ объясните.
5. Возможно ли получение свинца из оксида свинца (II) путем его восстановления графитом и при какой температуре?
6. Вычислите изменение энергии Гиббса реакции при 1000 К, если D Н  = 131,3 кДж, а D S
= 131,3 кДж, а D S  = 133,6 Дж/К (влиянием Т на D Н и D S пренебречь).
= 133,6 Дж/К (влиянием Т на D Н и D S пренебречь).
7. Вычислите изменение D G реакции при 298 К 2Н2Ог + Сгр = 2Н2 + СО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак D G данной реакции?
8. Вычислите D S  , D Н
, D Н  и D G
и D G  для реакции NH4Clк = NH3, г + HClг. Как влияет температура на направление протекания данной реакции?
для реакции NH4Clк = NH3, г + HClг. Как влияет температура на направление протекания данной реакции?
9. Какая из приведенных реакций термодинамически более вероятна
1) 4NH3 + 3O2 = 2N2 + 6H2Oг; 2) 4NH3 + 5O2 = 4NO + 6H2Oг.
Ответ подтвердите расчетами.
10. Определите направление самопроизвольного протекания реакции при стандартных условиях SO2 + 2H2 = Sкр + 2H2Oг .
11. Вычислите изменение D G реакции при 298 К ZnS +  O2 = ZnO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак D G данной реакции?
O2 = ZnO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак D G данной реакции?
12. Вычислите изменение энергии Гиббса реакции при 1500 К, если D Н  = 221,0 кДж, а D S
= 221,0 кДж, а D S  = 53,2 Дж/К (влиянием Т на D Н и D S пренебречь).
= 53,2 Дж/К (влиянием Т на D Н и D S пренебречь).
13. Определите температуру равновероятного протекания реакции в прямом и обратном направлении, если D Н = 138 кДж, а D S = 105  .
.
14. Какая из приведенных реакций термодинамически более вероятна
1) N2 + O2 = 2NО; 2) N2 + 2O2 = 2NO2.
Ответ подтвердите расчетами.
15. Вычислите D S  , D Н
, D Н  и D G
и D G  для реакции СО2 = Сгр + О2. Как влияет температура на направление протекания данной реакции?
для реакции СО2 = Сгр + О2. Как влияет температура на направление протекания данной реакции?
16. Возможно ли получение цинка из оксида цинка (II) путем его восстановления графитом и при какой температуре?
17. При какой температуре начнется реакция PbOк + СО = Pbк + СО2? Влиянием температуры на D Н и D S пренебречь.
18. Определите направление самопроизвольного протекания реакции при стандартных условиях СO2 + 2H2 = Сгр + 2H2Oг.
19. Вычислите изменение D G реакции при 298 К FeS +  O2 = FeO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак D G данной реакции?
O2 = FeO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак D G данной реакции?
20. Вычислите D G  и D G
и D G  для реакции Н2Ог + Сгр = СОг + Н2, г. Как влияет температура на термодинамическую вероятность протекания процесса в прямом направлении?
для реакции Н2Ог + Сгр = СОг + Н2, г. Как влияет температура на термодинамическую вероятность протекания процесса в прямом направлении?
21. Можно ли при стандартных условиях восстановить водородом оксиды ZnO и NiO? Ответ объясните.
22. Вычислите D G  реакции двумя способами 2Fe + Al2O3 = Fe2O3 + 2 Al.
реакции двумя способами 2Fe + Al2O3 = Fe2O3 + 2 Al.
23. Определите температуру равновероятного протекания реакции в прямом и обратном направлении, если D Н = 38 кДж, а D S = 207  .
.
24. В каком направлении при стандартных условиях будет протекать реакция СН4, г + 2О2, г = СО2, г + 2Н2Ож? Ответ подтвердите расчетами.
25. Вычислите изменение энергии Гиббса реакции при 2000 К, если D Н  = 242,3 кДж, а D S
= 242,3 кДж, а D S  = 195,6 Дж/К (влиянием Т на D Н и D S пренебречь).
= 195,6 Дж/К (влиянием Т на D Н и D S пренебречь).
ПРИЛОЖЕНИЕ






