Ковалентная связь
ОБРАЗУЕТСЯ ЗА СЧЕТ ОБОБЩЕСТВЛЕНИЯ ЭЛЕКТРОНОВ
(образования общей электронной пары)
·  Неполярная ковалентная связь образуется между двумя одинаковыми атомами неметаллов:
Неполярная ковалентная связь образуется между двумя одинаковыми атомами неметаллов:
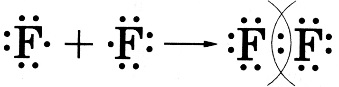
· Полярная ковалентная связь образуется между двумя разными атомами неметаллов:
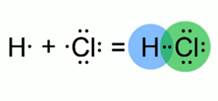

!!! Электроотрицательность – способность атомов перетягивать на себя общую электронную пару!!!
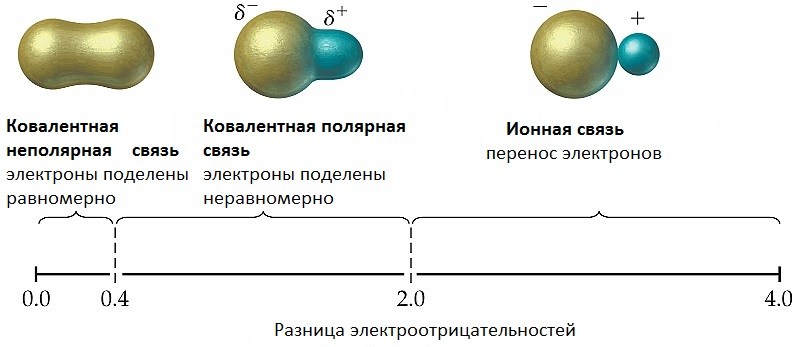
Образующиеся временные заряды (δ) и называют ПОЛЮСАМИ (как северный и южный полюса Земли). Отсюда название связи – ковалентная полярная.
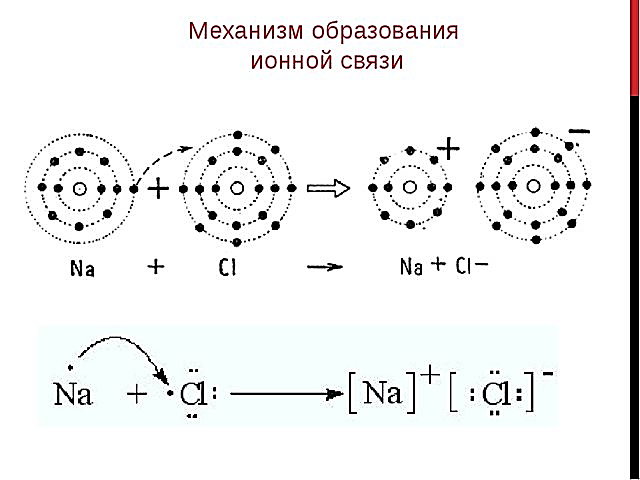
Ионная связь
ОБРАЗУЕТСЯ ЗА СЧЕТ ЭЛЕКТРОСТАТИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ МЕЖДУ РАЗНОИМЕННО ЗАРЯЖЕННЫМИ ЧАСТИЦАМИ
(катионами и анионами)
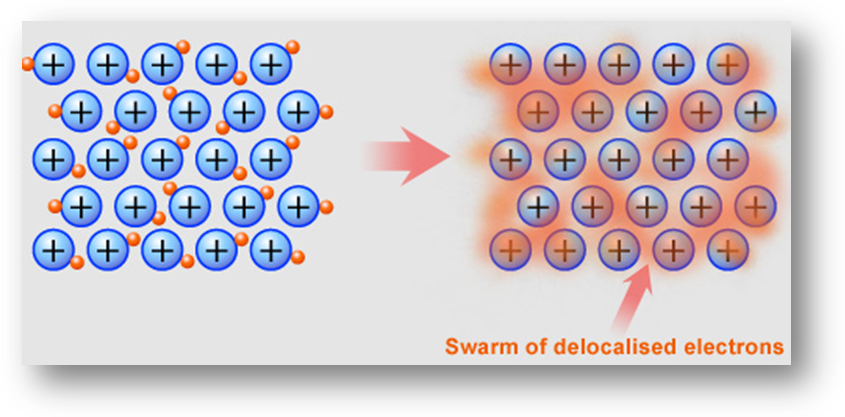
Металлическая связь
Эта связь образуется за счет того, что некоторые электроны свободно перемещаются между всеми атомами, образующими вещество, атомы при этом превращаются в катионы, а электроны образуют сплошной туман (или море).
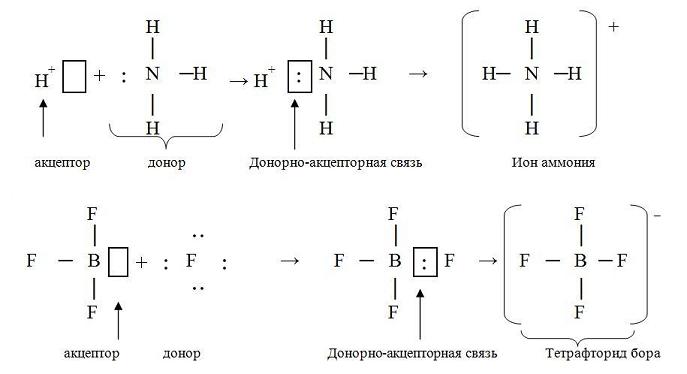
Донорно-акцепторные связи
*Более корректно: донорно-акцепторный механизм образования ковалентной связи.
Дело в том, что ковалентные связи могут образовываться не только по обменному механизму (каждый из атомов дает по одному электрону на связь), но и по донорно-акцеторному – один атом отдает в общее пользование два электрона, а другой – ни одного.
У донора есть НЕПОДЕЛЕННАЯ ЭЛЕКТРОННАЯ ПАРА
У акцептора есть ПУСТАЯ ОРБИТАЛЬ
ОБЯЗАТЕЛЬНЫЙ СПИСОК ВЕЩЕСТВ С ДОНОРНО-АКЦЕПТОРНЫМИ СВЯЗЯМИ (ДЛЯ ЕГЭ):
1) Ион аммония (NH4+);
2) Ион гидроксония (H3O+);
3) Оксид азота IV (NO2);
4) Азотная кислота (HNO3);
5) Все нитраты (NO3-);
6) Оксид углерода II (CO);
7) Комплексные соединения. Указатель – наличие […] (например, Na[Al(OH)4]).
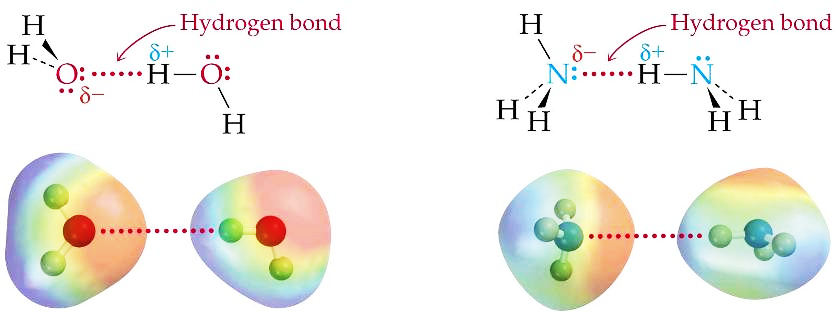
Водородные связи
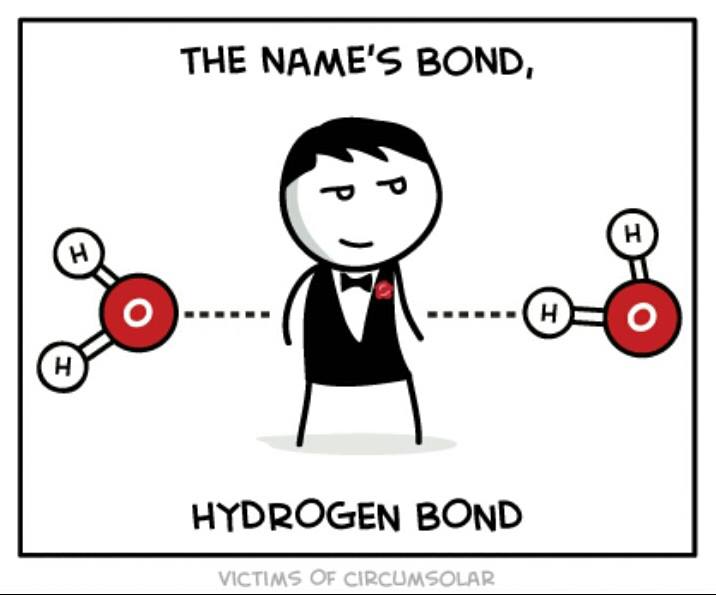
Образуются в тех случаях, когда атом водорода внутри полярной молекулы связан с сильно электроотрицательным атомом (фтор, кислород, азот).
Это связано с образованием на атоме водорода большого временного положительного заряда δ+, а на электроотрицательном атоме большого δ-.
Положительно заряженный атом одной молекулы притягивается к отрицательно заряженному атому другой молекулы, и их взаимное притяжение является причиной особо сильных межмолекулярных взаимодействий, для которых используют название ВОДОРОДНЫЕ СВЯЗИ.
Ван-дер-ваальсовы связи (силы)
САМЫЕ СЛАБЫЕ СВЯЗИ.
Электростатическое взаимодействие между атомными ядрами одной молекулы и электронами другой (притяжение) + взаимодействия ядро+ядро и электроны+электроны (отталкивание).
Бывает 3х типов:
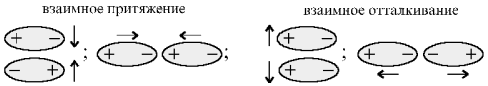
1. Ориентационное (диполь-дипольное) взаимодействие:
возникает между полярными молекулами.
2. Поляризационное взаимодействие:
возникает, например, при сближении полярной молекулы с неполярной.
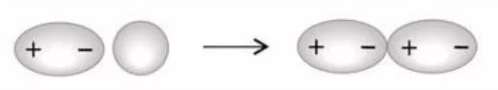
Электроны неполярной молекулы стремятся удалиться от отрицательного полюса полярной молекулы, за счет их смещения возникает искусственная поляризация неполярной молекулы и взаимодействие с исходно полярной молекулой.
3. Дисперсионное взаимодействие:
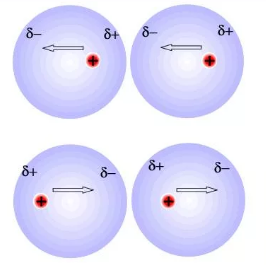
Это более сложный вариант. При сближении неполярных молекул электроны одной молекулы стремятся удалиться от электронов другой молекулы, возникает согласованное движение электронов и возникновение «мгновенных» диполей, что приводит к притяжению неполярных молекул.
Вероятность возникновения «мгновенных» диполей, а, следовательно, и энергия дисперсионного взаимодействия, растут с увеличением числа электронов в молекулах.
Так, энергия дисперсионного взаимодействия возрастает в ряду F2<Cl2<Br2<I2, поэтому фтор и хлор при стандартных условиях – газы, бром – жидкость, а иод- кристаллическое вещество.







