Знать
• разновидности термодинамических систем, термодинамических параметре: и функций состояния, суть понятий теплоемкости, экзо- и эндотермических, экз- и эндэргонических процессов;
• сущность понятий стандартного состояния вещества, стандартных теплотой образования и сгорания;
• первое и второе начало термодинамики;
• основной закон термохимии — закон Гесса и следствия из него;
• критерии возможности самопроизвольного протекания процесса;
Уметь
• рассчитывать изменения термодинамических функций состояния систем: в стандартных условиях по табличным данным;
• определять стандартную теплоту процесса по результатам калориметрического эксперимента;
• оценивать возможность самопроизвольного протекания процесса в изолированных системах;
Владеть
• способами расчета тепловых эффектов химических реакций, изменения энтропии и энергии Гиббса;
• методом определения стандартной энтальпии реакции опытным путем;
• техникой выполнения химических экспериментов;
• навыками работы с химическим оборудованием и реактивами.
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ.
Термодинамика — это наука о энергетических свойствах объектов, состоящих из очень большого числа частиц, в различных энергетических состояниях и их изменениях в результате процессов, в которых эти объекты участвуют. Термодинамику (от греч. therme — теплота, dinamis — сила) рассматривают как науку, изучающую взаимопревращения различных видов энергий.
Предмет химической термодинамики состоит в изучении превращений различных форм энергии при протекании химических реакций и способности химических систем выполнять полезную работу.
Фундаментальные положения химической термодинамики могут быть использованы для:
• предсказания принципиальной возможности протекания химически реакции;
• предсказания направления самопроизвольного протекания процесса до достижения равновесного состояния;
• определения количества энергии, теоретически необходимого для проведения реакции, или количества энергии, выделяющегося при ее самопроизвольном протекании.
Основным объектом изучения термодинамики является термодинамическая система.
Термодинамическая система — любая достаточно большая совокупность объектов, отделенная от окружающей среды реальной или воображаемой граничной поверхностью.
В соответствии с данным определением к термодинамической системе можно отнести живую клетку, химический реактор (рис. 4.1), человека и т.п.

Рис. 4.1. Примеры термодинамической системы: живая клетка (а), химический реактор (б)
Окружение или окружающая среда — это часть материального мира за пределами условно выделенной из него термодинамической системы. Окружение включает все остальные объекты, которые могут оказывать влияние на исследуемую систему.
По характеру взаимодействия с внешней средой различают изолированные, закрытые и открытые термодинамические системы (рис. 4.2).
Рис. 4.2. Примеры термодинамических систем: изолированной (а) закрытой (б) и открытой (в)
Изолированная система — система, не обменивающаяся с окружающей средой ни энергией (теплотой или работой), ни веществом. Несмотря на невозможность ее практического воплощения, понятие изолированной системы позволяет сформулировать основные законы термодинамики.
Закрытая система — система, способная обмениваться с окружающей средой энергией, но не веществом.
Открытая система — система, способная обмениваться с окружающей средой и энергией, и веществом.
Система может состоять из одной фазы (гомогенная система) или нескольких фаз (гетерогенная система).
Фазой называется совокупность однородных по составу и физико-химическим свойствам частей системы, отделенных от других частей системы поверхностью раздела. Важно отметить, что свойства системы при переходе через поверхность раздела фаз изменяются скачкообразно.
Состояние системы определяется совокупностью физико-химических свойств (термодинамических параметров и термодинамических функций), которыми она характеризуется в данный момент времени.
Термодинамические параметры (измеряемые величины) подразделяют на
· экстенсивные, которые прямо пропорциональны количеству вещества системы, т.е. складываются при объединении систем (масса, объем, площадь поверхности и т.п.),
· и интенсивные, которые не зависят от количества вещества системы и выравниваются при объединении систем (давление, температура, концентрация).
Термодинамические функции (неизмеряемые величины) зависят от термодинамических параметров системы. Среди них выделяют следующие функции.
Функции состояния, зависящие только от состояния, в котором находится система, и не зависящие от пути, по которому система пришла к данному состоянию (например, внутренняя энергия и энтальпия).
Функции перехода, зависящие от пути, по которому система перешла из одного состояния в другое (например, теплота и работа).
Внутренняя энергия системы (U, Дж) определяется всеми видами движений и взаимодействий, составляющих систему элементарных частиц, молекул, атомов и ионов, а именно: энергией поступательного, колебательной и вращательного движений, энергией электромагнитного, гравитационной и других силовых взаимодействий.
Во внутреннюю энергию не включаются кинетическая и потенциальная энергии, характеризующие всю систем как единое целое (перемещение всей системы в окружающей среде и взаимодействие с внешними силовыми полями).
Абсолютное значение внутренней энергии определить невозможно, так как нам неизвестны все возможные виды взаимодействий внутри системы. Однако можно определит ее изменение (∆ U) при переходе системы из начального состояния (1) в конечное (2):
∆U = U2-Uv
Энтальпия системы (Н, Дж) определяется соотношением
Н = U + pV,
где U — внутренняя энергия; р — давление; V — объем системы.
Абсолютное значение энтальпии определить также невозможно; определяют ее изменение (∆Н) при переходе системы из начального состояния (1) в конечное (2):
∆Н = Н 2 – Н1.
ТЕПЛОТА, ЭНЕРГИЯ И РАБОТА.
Передача энергии от одной системы к другой осуществляется в форме теплоты или работы. Теплота и работа не являются функциями состояния системы и зависят от пути протекания процесса.
Изменение внутренней энергии системы (∆ U) связано либо с переносом теплоты (Q), либо с совершением работы (А), поэтому все три функции выражаются в одних единицах — Дж (Дж = Н•м = кг•м2•с-2; 1 кал = 4,184 Дж).
Работа — одна из форм передачи энергии путем преодоления сил, действующих на систему со стороны окружающих тел или наоборот. Работа, совершаемая системой против внешних сил, считается положительной (А > 0), а работа, совершаемая над системой, — отрицательной (А< 0). Система выполняет работу, если она действует с некоторой силой, направленной на преодоление сопротивления. Величина произведенной работы равна произведению силы и расстояния, на котором эта сила преодолевает сопротивление. Работа, с которой чаще всего приходится иметь дело в химии, обусловлена изменением объема системы. Такое изменение происходит, например, при выделении газа в результате химического превращения при постоянном давлении. В этом случае работа А, выполняемая системой, может быть рассчитана по уравнению
А = p∆V,
где р — внешнее давление; ∆V — изменение объема системы.
Теплотой называется способ передачи энергии посредством хаотического движения молекул. Последнее носит название теплового движения. Количество энергии, передаваемой таким образом, обозначается Q. Теплота, полученная системой от окружающей среды, считается положительной (Q > 0), а теплота, отданная системой, — отрицательной (Q < 0).
Количество переданной теплоты пропорционально массе т системы и изменению температуры, происходящему вследствие передачи энергии:
Q ~ m ∆Т.
Удельная теплоемкость вещества (С), [Дж/(кг∙К)] — это теплота, необходимая для повышения температуры 1кг данного вещества на 1К. Удельная теплоемкость воды равна 4184Дж/(кг К). Значение Q можно рассчитать, зная теплоемкость С:
Q = m С∆Т.
Молярная теплоемкость вещества (Сm), [Дж/моль∙К)] — это теплота, необходимая для повышения температуры 1 моль данного вещества на 1 К.
ТИПЫ СОСТОЯНИЯ СИСТЕМЫ.
Равновесное состояние — макроскопическое состояние, к которому приходит изолированная система в результате самопроизвольно протекающих внутри нее процессов. В этом состоянии система характеризуется постоянством ее термодинамических параметров во времени. Параметры, при которых наблюдается такое состояние, называют равновесными.
Равновесное состояние — динамически сложившееся состояние, при котором происходящие внутри системы встречные процессы (испарена и конденсация, растворение и кристаллизация, прямая и обратная химическая реакции и т.д.) протекают с одинаковой скоростью, так что в целом система не изменяет своих макросвойств.
Стационарное состояние также характеризуется постоянством параметров системы, однако при этом, в отличие от равновесного состояния, происходит непрерывный обмен веществом и энергией с окружающей средой.
Переходное, или неравновесное, состояние — это такое состояние, при котором параметры системы изменяются во времени, стремятся достигнуть равновесных значений.
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ.
Изменение во времени любого из параметров, характеризующего систему, называется процессом.
Обратимые процессы — переход системы из одного состояния в друга и обратно осуществляется по одному и тому же пути, и после возвращения в исходное состояние в окружающей среде не остается макроскопических изменений.
При протекании равновесного процесса система последовательно проходит через бесчисленное множество близких равновесных состояний.
В случае осуществления необратимого процесса систему и ее окружение невозможно вернуть в исходное состояние без затраты энергии.
Реальные процессы, происходящие в природе, всегда необратимы.
Процессы, протекающие при постоянных температуре, давлении и объеме, называют изотермическими, изобарными (изобарическими) или изохорными (изохорическими) соответственно. Адиабатический процесс происходит без обмена теплотой между системой и окружающей средой (∆ Q = 0)
Самопроизвольный процесс может происходить без затраты энергии на его протекание за счет какого-либо другого процесса или без притока энергии извне.
Несамопроизвольный процесс может происходить только с затратой энергии, поступающей из окружающей среды или высвобождающейся за счет какого-либо другого процесса.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ.
Внутренняя энергия системы (U) в результате какого-либо процесса (в том числе и химического) может изменяться на величину ∆ U. Передача энергии системе или от нее может происходить в форме теплоты Q и (или) работы А. Эти величины связаны между собой следующим уравнением:
Q = ∆U + А,
где Q — теплота, поглощенная системой; ∆ U — изменение внутренней энергии системы; А — работа, совершаемая системой.
Это математическое выражение носит название первого закона термодинамики:
Поглощенная системой теплота расходуется на изменение внутренней энергии системы и на совершение ею работы против внешних сил.
По сути, первый закон термодинамики является не чем иным, как одной из формулировок закона сохранения энергии, в соответствии с которым энергия, потерянная системой, равна энергии, приобретенной внешней средой, или энергия, приобретенная системой, равна энергии, потерянной внешней средой. Энергия не может быть создана или уничтожена, а может лишь переходить из одной формы в другую (Р. Майер, 1842; Д. Джоуль, 1842; Г. Гельмгольц, 1847).
Если работа связана только с изменением объема системы при постоянном давлении, подстановка уравнения приводит к соотношению
∆U = Q – p∆V.
В изохорных процессах (реакции, проходящие без изменения объема системы ∆ V = 0) теплота, подведенная к системе, расходуется только на увеличение ее внутренней энергии:
∆ U=QV,
где QV — теплота, поглощаемая при постоянном объеме.
Чаще всего химические реакции проводят в открытых сосудах, например: в пробирках, химических стаканах, химических реакторах, сообщающихся с окружающей средой. В этом случае давление в системе остается постоянным и совпадает с атмосферным — это так называемые изобарные процессы (реакции, проходящие при постоянном давлении):
Qp = ∆U – А
где Qр — теплота процесса при неизменном давлении
Подставив, получим,
Qp = ∆U + p∆V.
Изменение энтальпии в процессе при постоянном давлении равно
∆Н = ∆U + p∆V.
Сравнивая эти уравнения, получим
∆Н = Qp
Таким образом, теплота, подведенная к системе в условиях изобарного процесса, расходуется только на увеличение ее энтальпии.
ТЕРМОХИМИЯ.
Раздел химии, занимающийся изучением тепловых эффектов, наблюдаемых при протекании химических реакций, называется термохимией.
Тепловой эффект — количество теплоты, выделяющееся или поглощающееся при протекании физико-химического процесса, если:
а) процесс протекает при р = const или V = const;
б) в системе совершается только работа расширения;
в) температура исходных веществ и продуктов реакции одинакова.
Экзотермическим называют процесс, сопровождающийся выделением теплоты, эндотермическим — процесс, сопровождающийся поглощением теплоты.
Если процесс протекает при постоянном давлении, то тепловой эффект представляет собой изменение энтальпии системы:
∆Н = ∆Н прод - ∆Н реаг.
Если ∆Н < 0 — это экзотермический процесс, ∆Н > 0 — эндотермический процесс (рис. 4.3).
Если процесс не сопровождается изменением объема, тепловой эффект процесса равен изменению внутренней энергии системы ∆ U. Если ∆ U < 0 - экзотермический процесс, ∆ U > 0 — эндотермический процесс.

Рис. 4.3. Экзотермическая (а) и эндотермическая (б) реакции
Термохимические уравнения реакции — уравнения реакции, в которых помимо формул исходных веществ и продуктов (с соответствующими стехиометрическими коэффициентами) указаны их агрегатные состояния и отвечающий этой реакции тепловой эффект (изменение энтальпии), на пример:
0,5N2(г.) + 1,5Н2(г.) = NH3(г.) + 46,2 кДж
(термохимическая форма записи)
или
0,5N2(г.) + 1,5Н2(г.) = NH3(г.); ∆Н = -46,2 кДж/моль.
(термодинамическая форма записи)
Рассмотрим стандартные изменения энтальпии.
Изменения энтальпии в ходе химической реакции зависят от температуры, давления и физического состояния веществ, участвующих в процессе. Величина ∆Н зависит также от количества этих веществ. Поэтому изменение энтальпии может быть характеристической величиной лишь в случае если ее измерение проводится при определенных условиях, называемых стандартными.
Стандартные условия:
· все вещества являются химически чистыми и соответствуют приводимой химической формуле;
· твердые и жидкие вещества находятся в устойчивых для данных условий агрегатных состояниях и аллотропных модификациях;
· количества веществ равны 1 моль или вещества в растворе содержатся в количествах 1моль на 1000 г растворителя;
· давление постоянно и равно 101,3 кПа, или 1 атм (ИЮПАК рекомендует использовать точное значение 100 кПа);
· температура постоянна и может иметь любое значение, но обычно выбирается равной 25°С (298 К).
Отношение количества растворенного вещества к массе растворителя, выраженной в килограммах, называется молялъностъю раствора. Таким образом, стандартное состояние относится к одномоляльным растворам всех растворенных веществ. На практике, особенно применительно к разбавленным водным растворам, каковыми являются физиологические жидкости, вместо моляльностей используют молярные концентрации. В этом случае стандартное состояние соответствует концентрациям растворенных веществ 1 моль/л.
Стандартная энтальпия образования (∆ f H 0 298) — это тепловой эффект реакции образования 1 моль какого-либо вещества из простых веществ в стандартных условиях при 298К. Стандартная энтальпия образования простого вещества в наиболее устойчивой аллотропной модификации равна нулю.
Стандартная энтальпия образования аммиака соответствует тепловому эффекту реакции
1,5Н2(г) + 0,5N2(г) = NH3(г) + 45,94 кДж
при постоянном давлении (298 К) ∆ f H 0 298 = -45,94 кДж/моль.
Энтальпии образования твердых соединений, как правило, имеют большие (по абсолютной величине) отрицательные значения, по сравнению с энтальпиями образования газов.
Стандартная энтальпия сгорания (∆с H 0 298) — это тепловой эффект реакции сгорания в избытке кислорода 1 моль вещества в его стандартном состоянии при температуре 298 К и давлении 101,3 кПа (1 атм).
Стандартная энтальпия сгорания этилового спирта соответствует тепловому эффекту реакции
С2Н5ОН(ж) + 3,5О2(г) = 2СО2(г) + 3Н2О(ж) + 1638 кДж
при постоянном давлении (298 К) ∆с H 0 298 = -1638 кДж/моль.
Стандартные энтальпии образования и стандартные энтальпии сгорания различных веществ сведены в соответствующие таблицы, которые имеются в справочной литературе.
Стандартная энтальпия реакции (∆ r H 0 298) это изменение энтальпии при 298К в стандартных условиях в расчете на количества веществ, соответствующие стехиометрическим коэффициентам.
Калориметрия — совокупность экспериментальных методов измерения тепловых эффектов, сопровождающих различные физико-химические и биологические процессы.
Калориметр — изолированный сосуд для измерения количества теплоты, высвобождаемой или поглощаемой в результате химической реакции или фазового превращения (рис. 4.4).

Рис. 4.4. Схема калориметра
Суть эксперимента состоит в измерении изменения температуры реакционной смеси в результате химического или иного превращения. В некоторых случаях изменение температуры определяется в охлаждающей реакционный сосуд жидкости, например воде. Калориметр представляет собой прочный закрывающийся сосуд, окруженный теплоизолирующей водяной рубашкой. Образец известной массы помещается внутри бомбы в атмосфере чистого кислорода под давлением 25 атм. Затем образец поджигают с помощью электрической искры. За счет выделяющейся при горении энергии происходит нагрев водяной рубашки. Поскольку сгорание вещества в калориметрической бомбе происходит при постоянном объеме, выделяющая тепловая энергия численно равна изменению внутренней энергии U.
Выделяемая в ходе эксперимента энергия может быть рассчитана и следующему уравнению:
Q = (С сосуд + m ∙ C содерж) ∆ T
где Q — энергия, передаваемая в форме тепла сосуду и его содержимом; С сосуд — теплоемкость сосуда; т — масса содержимого сосуда (вода или реакционная смесь); С содерж — удельная теплоемкость содержимого; ∆ T — измеренное изменение температуры содержимого сосуда.
Энтальпии реакций, которые невозможно провести в лабораторных условиях, могут быть вычислены по известным энтальпиям других реакций.
Основной закон термохимии — закон Гесса (закон постоянства сумм теплот реакции):
тепловой эффект реакции не зависит от пути проведения процесса, а определяется только начальным и конечным состоянием системы.
Таким образом, если какую-либо реакцию теоретически представить в виде определенного числа последовательных стадий, то изменение энтальпии реакции будет равно сумме изменений энтальпий на каждой стадии (рис. 4.5)
∆ НА = ∆ НВ = ∆ HBl + ∆Н В2.
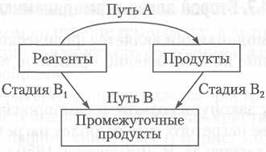
Рис. 4.5. Стадии реакции
Несмотря на то что закон Гесса был установлен опытным путем, он непосредственно вытекает из свойств функций состояния системы: внутренняя энергия U и энтальпия H являются функциями состояния системы, следовательно, их изменение ∆ U и ∆ Н не зависит от пути процесса, а равно разности ∆ U = U2 – U 1; ∆ Н = H 2 – H1 между значениями U2 и Н2 в конечном состоянии и значениями U1 и Н1 в начальном состоянии системы.
Следствия из закона Гесса.
1. Тепловой эффект химической реакции (∆ r H 0) равен разности между суммой теплот образования продуктов реакции (∑ ∆ f H 0 прод) и суммой теплот образования исходных веществ (∑ ∆ f H 0 реаг) с учетом их стехиометрических коэффициентов. Для теплового эффекта реакции, проводимой при постоянном давлении
∆ rH 0 = ∑ ν j ∆fH 0 прод - ∑ ν i ∆fH 0 реаг.
Пример. Рассчитаем тепловой эффект реакции образования мочевины (одного из важнейших продуктов жизнедеятельности организма) из аммиака и диоксида углерода:
2NH3(r) + СО2(г) = CO(NH3)2(k) + Н2О(ж)
∑ ∆ fH 0 -45,94 -393,51 -333,1 -241,83
∆ rH 0 = (-333,1 – 241,83) - (-45,94∙2 – 393,51) = -88,54 кДж.
2. Тепловой эффект химической реакции (∆ r H 0) равен разности между суммой теплот сгорания исходных веществ (∑ ∆ C H 0 реаг) и суммой теплот сгорания продуктов реакции (∑ ∆ C H 0 прод) с учетом их стехиометрических коэффициентов:
∆ rH 0 = ∑ ν j ∆CH 0 реаг - ∑ ν i ∆CH 0 прод.
Пример. Рассчитаем тепловой эффект реакции молочнокислого брожения глюкозы, зная, что стандартные теплоты сгорания глюкозы и молочной кислоты равны -2810 и -1344 кДж/моль соответственно:
С6Н12O6 → 2СН3СН(ОН)СООН
∑ ∆ CH 0 -2811 -1344
∆ rH 0 = -2811 - (-1344∙2) = -123 кДж.
3. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ.
Второй закон термодинамики является физическим принципом, накладывающим ограничение на направление процессов передачи тепла меж; телами.
Согласно этому закону невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому (одна из первых формулировок закона; М. В. Ломоносов, 1850 г.).
Существует несколько эквивалентных формулировок второго закона термодинамики, среди которых:
• постулат Клаузиуса: «Невозможно осуществить перенос тепла от более холодного тела к более горячему без затраты работы»;
• постулат Томсона: «Невозможно превратить какое-либо количество теплоты полностью в работу без того, чтобы часть теплоты не оказалась растраченной при более низкой температуре».
Энтропия (S) — важная функция состояния термодинамичесм системы. Энтропию можно охарактеризовать как меру хаотичности или неупорядоченности системы.
S = k ∙ ln W,
где W — число возможных микросостояний системы; k — постоянная Больцмана, равная отношению R/NA = 1,381•10-23 Дж/К; R — универсальная газовая постоянная, равная 8,315Дж/моль∙К); NA — постоянная Авогадро, равная 6,022•1023 моль-1.
При абсолютном нуле (Т = 0К) энтропия идеального кристалла равна нулю — полная упорядоченность, W = 1 (иногда это положение называется нулевым законом термодинамики).
Изменение энтропии (S) равно теплоте, подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру, при которой осуществляется этот процесс ∆ S = Q/T.
Для необратимого процесса при температуре Т: ∆S > Q/Т
В соответствии с изменением числа возможных микросостояний системы энтропия:
· возрастает при превращении жидкости или твердого тела в газ;
· увеличивается при растворении твердого вещества или жидкости в воде или в другом растворителе;
· уменьшается при растворении газа в воде или в другом растворителе
· возрастает при увеличении числа частиц в системе;
· имеет меньшие значения в ковалентно связанных твердых веществах с прочными, пространственно направленными связями, по сравнению с кристаллами с частично металлической связью;
· повышается по мере ослабления связей между атомами.
На рис. 4.6 приведена типичная кривая изменения значений энтропии для вещества в широком диапазоне температур, в котором это вещество переходит из твердого кристаллического состояния в жидкое и далее из жидкого состояния в газообразное.
Повышение температуры сопровождается ростом энтропии, которая вплоть до достижения температуры плавления кристаллического вещества (Тпл) изменяется по плавной кривой ОА (см. рис. 4.6). В точке плавления нарушается дальний порядок во взаимном расположении частиц, и энтропия скачкообразно возрастает на ∆ S (отрезок АВ). Повышение температуры выше точки плавления вещества вызывает последовательное увеличение энтропии жидкости, которое происходит по плавной кривой ВС вплоть до достижения температуры кипения (Т кип). В этой точке жидкость полностью превращается в пар, и энтропия скачком возрастает на величину ∆ S пар, соответствующую отрезку CD. Далее энтропия газа изменяется по плавной кривой DE, и новое скачкообразное возрастание энтропии может произойти только в результате химических изменений газа (термической диссоциации, ионизации и т.п.), приводящих к увеличению числа частиц и росту беспорядка в системе.
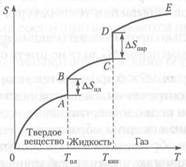
Рис. 4.6. Типичная зависимость энтропии вещества от температуры
Энтропия 1 моль вещества в стандартном состоянии называется стандартной энтропией (S °, Дж/(моль∙К). Изменение стандартной энтропии в химической реакции, аналогично изменению энтальпии, можно определить по уравнению
∆rS° = ∑ ν j S° прод - ∑ ν i S° реаг.
Пример 4.5. Рассчитаем изменение энтропии при получении сульфата цинка путем обжига сульфида цинка (сфалерита).
ZnS(k) + 2O2(г) = ZnSO4(k)
S ° 298, Дж/(моль-К) 57,7 205,15 110,6
∆ rS° = 110,6 – (57,7 + 2∙205,15) = -357,4 Дж/К.
Значения стандартной молярной энтропии различных веществ при 298К сведены в таблицы и имеются в справочной литературе (см. также приложение 2). Стандартная молярная энтропия простого вещества не равна нулю. Стандартная молярная энтропия сложного вещества возрастает при увеличении числа атомов в молекуле.
СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
Для того чтобы судить о возможности самопроизвольного (без затраты энергии извне) протекания реакции, необходимо учитывать два фактора - энергию и энтропию.
1. Энергия. Все материальные системы имеют общую тенденцию к достижению минимума потенциальной энергии. В процессе химической реакции при постоянном давлении изменение энергии соответствует изменению энтальпии. В экзотермической реакции система теряет энергию в виде теплоты до тех пор, пока ее полная энтальпия не достигнет минимума.
2. Энтропия. Все материальные системы стремятся к достижению максимального беспорядка (увеличение энтропии).
Учесть одновременно влияние обоих этих факторов позволяет новая термодинамическая функция состояния — энергия Гиббса или ее изменение
∆ G = ∆ Н – T∙ ∆ S.
Это уравнение носит название уравнения Гиббса.
Таким образом, изменение величины ∆ G учитывает изменение энтальпии и энтропии реакционной системы. Энтропийный член (T ∆ S) включает абсолютную температуру, которая позволяет учесть разупорядочивание материальной системы при повышении температуры.
Для самопроизвольно протекающей реакции при постоянных температуре и давлении изменение ∆ G должно иметь отрицательное значение.
Процессы, для которых ∆ G < 0, называются экзэргоническими, а для которых ∆ G > 0 — эндэргоническими. Эндэргонические процессы могут осуществляться только при подводе энергии извне.
Стандартная свободная энергия образования — это изменение свободной энергии Гиббса при образовании 1 моль вещества из простых веществ в их стандартных состояниях; это тоже табличная величина, имеющаяся в справочниках.
Значение свободной энергии образования ∆ fG° измеряется в килоджоулях на моль. Стандартное изменение энергии Гиббса реакции можно вычислить, зная свободные энергии образования (∆fG°298) продуктов и реагентов:
∆ r G ° = ∑ ν j ∆fG 0 прод - ∑ ν i ∆fG 0 реаг.
Пример. Необходимо оценить возможность образования этилового эфира уксусной кислоты в результате реакции этерификации:
С2Н5ОН(ж) + СН3СООН(ж) → СН3СООС2Н5(ж) + Н2О(ж)
∆fG°298, кДж/моль -174,8 -390,2 -333,7 -237,14
∆rG° = -333,7 + (-237,14) – (-174,8) – (-390,2) = -5,8 кДж.
Поскольку изменение энергии Гиббса отрицательно, самопроизвольный процесс возможен в стандартных условиях, т.е. когда количества всех четырех соединений в правой и левой частях уравнения реакции равны 1 моль.
Таблица 4.1
Изменение термодинамических функций и возможность самопроизвольного протекания процесса
| ∆H | ∆ S | ∆ G | Процесс возможен | |
| <0 | <0 | Т (низкая) < 0 | Т (высокая) > 0 | Только при низкой Т |
| <0 | >0 | <0 | При любой Т | |
| >0 | <0 | >0 | Процесс невозможен | |
| >0 | >0 | Т (низкая) > 0 | Т (высокая) < 0 | Только при высокой Т |
Возможность самопроизвольного протекания процесса определяется приведенными в табл. 4.1 соотношениями.






