Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Уфимский государственный нефтяной технический университет»
Кафедра «Общая и аналитическая химия»
ГИДРОЛИЗ СОЛЕЙ
Учебно-методическое пособие
Уфа
Издательство УГНТУ
2015
Учебно-методические пособие разработано на кафедре «Общая и аналитическая химия» и предназначено для выполнения лабораторной работы по теме «Гидролиз солей», а также для самостоятельной работы студентов направлений БАГ, БАТ, БАЭ, БГБ, БГГ, БГР, БГШ, БМЗ, БМП, БМС, БМТ, БСТ, БТЭ, БУС, ББП, БПБ, БЧС, БМА, БМК, БОС, БТБ, БТК, БТП, БТС, изучающих дисциплины «Химия» и «Общая и неорганическая химия».
Составители: Низаева Э.Р., доц., канд. хим. наук
Шавшукова С.Ю., доц., д-р техн. наук
Рольник Л.З., проф., д-р хим. наук
Рецензент Удалова Е.А., проф., д-р техн. наук
ÓУфимский государственный нефтяной технический университет, 2015
Содержание
| Значение гидролиза в природе и промышленности | 2 |
| Гидролиз солей | 2 |
| Типы гидролиза солей | 4 |
| Количественные характеристики гидролиза | 6 |
| Особые случаи гидролиза | 10 |
| Примеры решения задач | 12 |
| Вопросы и задачи | 14 |
| Тестовые задания | 18 |
| Лабораторная работа «Гидролиз солей» Приложение А | 20 22 |
| Список использованных литературных источников | 23 |
Значение гидролиза в природе и промышленности
Гидролиз – широко распространенный процесс в живой природе. Гидролиз белков, жиров и углеводов является необходимой составляющей процессов усвоения продуктов питания живыми организмами. Гидролиз аденозинтрифосфата (АТФ) является основой энергетики клетки живого организма.
В неживой природе гидролиз также широко распространён. В результате взаимодействия с водой происходят процессы разложения и образования горных пород.
Гидролизные производства составляют важную отрасль химической промышленности. Сырьём для гидролизных производств являются отходы непищевого растительного сырья, образующиеся в процессах лесозаготовок, лесопиления и деревообработки (опилки, мелкая стружка, щепа) или переработки сельскохозяйственных культур (солома, шелуха семян и т.д.). Гидролизом такого сырья при дальнейшей химической и биохимической переработке получают пищевые, кормовые и технические продукты, в том числе кормовые дрожжи, этиловый спирт, фурфурол, глюкозу, ксилит, лигнин и др.
Гидролиз солей
Гидролизом («гидро» – вода и «лизис» – распад, разложение) называется процесс разложения различных органических и неорганических соединений водой. В неорганической химии гидролиз наиболее характерен для солей.
Гидролиз является результатом поляризационного взаимодействия ионов соли с молекулами воды в их гидратных оболочках. Поляризуя молекулы воды, катионы металлов разрывают связь Н–ОН и присоединяют гидроксид-ионы, в результате чего в растворе повышается концентрация ионов водорода Н+; анионы присоединяют ионы Н+, что приводит к повышению в растворе концентрации ОН–. Таким образом происходит нарушение ионного равновесия воды Н2О «Н+ + ОН– и изменение рН среды.
При диссоциации абсолютно чистой воды концентрации ионов Н+ и ОН– одинаковы. При 298 К [Н+] = [ОН–] = 10–7 моль/л. Произведение ионов [Н+]•[ОН–] называется ионным произведением воды. При 298 К:
КН2О = [Н+] • [ОН–] = 10–14.
В кислом растворе: [Н+] > 10–7 моль/л, [ОН–] < 10–7 моль/л.
В щелочном растворе: [Н+] <10–7 моль/л, [ОН–] > 10–7 моль/л.
Для характеристики среды существует понятие водородного показателя рН, который равен отрицательному десятичному логарифму активности ионов водорода, или, упрощенно, концентрации ионов водорода в растворе:
рН = -lg [H+].
В нейтральном растворе рН = 7;
в кислых растворах рН < 7;
в щелочных растворах рН > 7.
рОН – гидроксильный показатель, который равен отрицательному десятичному логарифму концентрации гидроксильных ионов в растворе:
рОН = -lg [OH–],
рН + рОН = 14.
На практике реакцию среды определяют при помощи кислотно-основных индикаторов – веществ, которые изменяют окраску раствора в зависимости от концентрации ионов водорода. К наиболее распространенным индикаторам относятся лакмус, фенолфталеин и метиловый оранжевый (таблица 1).
Таблица 1 – Окраска индикаторов в различных средах
| Индикатор | Окраска индикатора | ||
| Кислая среда | Нейтральная среда | Щелочная среда | |
| Метиловый оранжевый | Красный (рН < 3,1) | Оранжевый (3,1 < рН < 4,4) | Желтый (рН > 4,4) |
| Фенолфталеин | Бесцветный (рН < 8,0) | Бледно-малиновый (8,0 < рН <9,8) | Малиновый (рН > 9,8) |
| Лакмус | Красный (рН < 5,0) | Фиолетовый (5,0 < рН < 8,0) | Синий (рН > 8,0) |
С точки зрения термодинамики гидролиз является реакцией, обратной реакции нейтрализации слабых кислот и оснований.
Типы гидролиза солей
Любую соль можно рассматривать как продукт взаимодействия кислоты и основания. В зависимости от природы соли различают 4 типа гидролиза.
1 Соли, образованные сильными кислотами и сильными основаниями (щелочами), такие как NaCl, CaCl2, Ba(NO3)2 и др., гидролизу не подвергаются. Катионы солей этого типа имеют небольшие заряды и значительные размеры, поэтому их поляризующее действие на молекулы воды невелико, то есть взаимодействие соли с водой практически не происходит, и среда в растворах таких солей остается нейтральной (рН = 7).
2 Соли, образованные сильными кислотами и слабыми основаниями NH4Cl, ZnCl2, Fe2(SO4)3 и др., подвергаются гидролизу по катиону, в результате чего среда раствора становится кислой (рН < 7).
Рассмотрим гидролиз хлорида меди (II) – соли, образованной слабым основанием Cu(OH)2 и сильной кислотой HCl. В водном растворе соль диссоциирует на ионы: CuСl2 ® Cu2+ + 2Cl–.
Затем происходит взаимодействие катиона Cu2+ с молекулами воды. Процесс гидролиза можно представить в трёх формах: сокращенной ионной, полной ионной и молекулярной:
Cu2+ + HOH «CuOH+ + H+ (сокращенная ионная форма);
Cu2+ + Cl–+ HOH «CuOH+ + H+ + Cl– (полная ионная форма);
CuСl2 + 2H2O «CuOHCl + HCl (молекулярная форма).
Поскольку катион меди Cu2+ двухзарядный, то гидролиз может протекать в две ступени. Вторую ступень гидролиза можно представить так:
CuOH+ + HOH «Cu(OH)2¯ + H+
CuOHCl + 2H2O «Cu(OH)2¯ + HCl.
3 Соли, образованные сильными основаниями (щелочами) и слабыми кислотами Na2CO3, KCN, Ba(CH3COO)2 и др., подвергаются гидролизу по аниону, в результате которого среда становится щелочной (рН > 7).
Рассмотрим гидролиз цианида калия KCN – соли, образованной сильным основанием КОН и слабой кислотой HCN. В водном растворе соль диссоциирует на ионы: KCN ® К+ + CN–.
Затем анион CN– взаимодействует с молекулами воды:
CN–+ HOH «HCN + OH–
KCN + H2O «HCN + KOH.
Таким образом, гидролиз всегда протекает по слабой составляющей.
4 Соли, образованные слабыми кислотами и слабыми основаниями NH4CN, Al(CH3COO)3, CH3COONH4, подвергаются гидролизу и по катиону и по аниону одновременно. Среда растворов таких солей зависит от силы образующихся в результате гидролиза основания и кислоты: если константа диссоциации основания больше, то среда будет слабощелочной (рН > 7), если константа диссоциации кислоты больше, то – слабокислой (рН < 7).
Например, соль CH3COONH4 образована слабым основанием NH4OH и слабой кислотой СН3СООН. Гидролиз идет по катиону NH4+ и аниону СН3СОО– с образованием двух слабых электролитов – кислоты и основания:
CH3COONH4 + HOH «CH3COOH + NH4OH.
Водные растворы солей такого типа в зависимости от степени диссоциации образующихся слабых электролитов имеют нейтральную, слабокислую или слабощелочную среду. Для того чтобы оценить реакцию среды в растворе соли такого типа, нужно сравнить константы диссоциации образующихся слабых электролитов (см. приложение А).
В данном случае константы диссоциации практически равны:
КNH4OH = 1,79×10-5,
КCH3COOH = 1,86×10-5,
поэтому реакция раствора близка к нейтральной (рН» 7).
Если соли образованы многозарядными катионами и анионами, то их гидролиз протекает ступенчато. При этом на первой ступени происходит образование кислой (гидролиз по аниону) или основной (гидролиз по катиону) соли. Последующие ступени гидролиза многозарядных ионов в стандартных условиях протекают незначительно, поэтому их можно не учитывать.
Например, гидролиз хлорида алюминия АlCl3 теоретически может протекать в три ступени:
Первая:
АlCl3 + 2H2O «AlOHCl2 + HCl,
Аl3+ –+ HOH «AlOH2+ + H+.
Вторая:
AlOHCl2+ H2O «Al(OH)2Cl + HCl,
AlOH2+ + HOH «Al(OH)2+ + H+.
Третья:
Al(OH)2Cl + 2H2O «Al(OH)3 + HCl,
Al(OH)2++ HOH «Al(OH)3 + H+.
На практике гидролиз по первой ступени идет полностью, по второй –частично, по третьей не идёт совсем. Этот факт объясняется принципом Ле Шателье: накопление катионов водорода на первой ступени препятствует образованию их на второй. Кроме того, катион AlOH2+ имеет больший размер и меньший заряд по сравнению с Аl3+, поэтому обладает меньшим поляризующим действием. Усилить гидролиз, то есть сместить равновесие указанных обратимых реакций вправо, можно, например, удаляя из раствора ионы водорода (подщелачивая раствор). Таким образом можно добиться полного превращения хлорида алюминия в гидроксид алюминия.
Однако следует отметить, что в действительности состав частиц раствора, приведённых в вышеуказанных уравнениях гидролиза АlCl3, является более сложным.
Как правило, гидролиз – обратимая реакция. Но процесс гидролиза может протекать необратимо. Это происходит, если продукты гидролиза являются труднорастворимыми либо газообразными продуктами, то есть выводятся из зоны реакции, например:
ZnSiO3 + 2H2O ® Zn(OH)2¯ + H2SiO3¯,
Al(CN)3 + 3H2O ® Al(OH)3¯ + 3HCN.
Такие соли не могут существовать в водном растворе.
Количественные характеристики гидролиза
Количественными характеристиками обратимого гидролиза солей являются константа гидролиза и степень гидролиза. Константа гидролиза Кг – это константа равновесия обратимой реакции гидролиза. Степень гидролиза h определяется отношением числа молекул, подвергшихся гидролизу, к общему числу молекул растворенной соли. Константа гидролиза зависит от температуры, но не зависит от концентрации раствора. Степень гидролиза не является постоянной величиной, зависит от температуры и концентрации раствора. Кг и h связаны между собой в соответствии с законом разбавления Оствальда.
Рассмотрим эти характеристики на примере реакции гидролиза хлорида аммония NH4Cl. Эта соль образована слабым основанием NH4OH и сильной кислотой HCl, следовательно, подвергается гидролизу по катиону:
NH4+ + H2O «NH4OH + H+.
По закону действия масс выражение для константы равновесия этой обратимой реакции имеет вид
К = 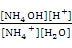 . (1)
. (1)
Так как концентрация воды остается практически неизменной: [H2O]0 = [H2O]равн., то уравнение (1) можно записать в виде
 = Кр[H2O] = Кг. (2)
= Кр[H2O] = Кг. (2)
Произведение двух констант Кр[H2O] является постоянной величиной и называется константой гидролиза Кг.
Из уравнения ионного произведения воды выразим концентрацию ионов водорода:
[H+] =  . (3)
. (3)
Тогда уравнение (1) можно переписать таким образом:
Кг. = t wx:val="Cambria Math"/><w:i/><w:sz w:val="28"/><w:sz-cs w:val="28"/><w:lang w:fareast="RU"/></w:rPr><m:t>,</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 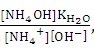 (4)
(4)
так как
 =
= 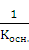 , (5)
, (5)
где Косн. – константа диссоциации слабого основания NH4OH.
Тогда выражение (4) примет вид
Кг =  (6)
(6)
Следовательно, чем меньше Косн., тем сильнее соль подвергается гидролизу.
В случае гидролиза соли с многозарядным катионом слабого основания, например CuСl2, константа гидролиза по первой ступени связана с константой диссоциации Косн. по второй ступени; константа гидролиза по второй ступени связана с Косн. по первой ступени:
Кг1 =  , (7)
, (7)
Кг2=  . (8)
. (8)
Так как Косн.1 значительно выше, чем Косн.2, то Кг1 >> Кг2.
Аналогичным образом выводится выражения для константы гидролиза по аниону:
Кг =  . (9)
. (9)
Уравнение для расчёта степени гидролиза h выведем на примере хлорида аммония, исходя из следующих соображений. Если исходная концентрация соли NH4Cl равна С моль/л, то гидролизовано Сh молей соли, то есть образовалось Сh молей NH4OH и Сh молей H+. В состоянии равновесия [NH4OH] = [H+] = Сh, [NH4+] = (C–Сh). Подставим эти выражения в уравнение (2):
Кг = 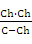 =
=  =
=  , (10)
, (10)
Кг = 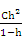 =
=  . (11)
. (11)
Чтобы упростить соотношение между константой и степенью гидролиза, можно принять (1–h)» 1, так как в большинстве случаев h << 1. Тогда получим
Кг =  = Сh2, (12)
= Сh2, (12)
h =  =
=  (13)
(13)
В случае гидролиза по аниону выражения для константы и степени гидролиза выводятся аналогично, и уравнения (6) и (13) имеют вид:
Кг =  , (14)
, (14)
h =  =
=  , (15)
, (15)
где Ккисл. – константа диссоциации слабой кислоты.
Охарактеризуем количественно гидролиз соли, образованной слабым основанием и слабой кислотой, например гидролиз ацетата аммония, протекающий и по катиону и по аниону одновременно:
NH4+ + CH3COO– + HOH «NH4OH + CH3COOH.
Согласно закону действующих масс константа равновесия этой реакции:
К = 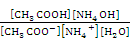 . (16)
. (16)
Так как концентрация воды в растворе соли есть величина постоянная [H2O] = const, то
Кг = К[H2O] =  . (17)
. (17)
Умножим числитель и знаменатель этой дроби на ионное произведение воды КН2О = [Н+] • [ОН–]. Получим:
Кг = 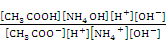 =
= 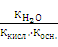 , (18)
, (18)
Так как  = s w:val="24"/><w:lang w:fareast="RU"/></w:rPr><m:t>РєРёСЃР»</m:t></m:r></m:sub></m:sSub><m:r><w:rPr><w:rFonts w:ascii="Cambria Math" w:fareast="Times New Roman" w:h-ansi="Cambria Math"/><wx:font wx:val="Cambria Math"/><w:i/><w:sz w:val="24"/><w:sz-cs w:val="24"/><w:lang w:fareast="RU"/></w:rPr><m:t>.</m:t></m:r></m:den></m:f></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">
= s w:val="24"/><w:lang w:fareast="RU"/></w:rPr><m:t>РєРёСЃР»</m:t></m:r></m:sub></m:sSub><m:r><w:rPr><w:rFonts w:ascii="Cambria Math" w:fareast="Times New Roman" w:h-ansi="Cambria Math"/><wx:font wx:val="Cambria Math"/><w:i/><w:sz w:val="24"/><w:sz-cs w:val="24"/><w:lang w:fareast="RU"/></w:rPr><m:t>.</m:t></m:r></m:den></m:f></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">  и
и 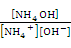 = s w:val="24"/><w:lang w:fareast="RU"/></w:rPr><m:t>РѕСЃРЅ.</m:t></m:r></m:sub></m:sSub></m:den></m:f></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">
= s w:val="24"/><w:lang w:fareast="RU"/></w:rPr><m:t>РѕСЃРЅ.</m:t></m:r></m:sub></m:sSub></m:den></m:f></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 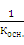 . (19)
. (19)
Таким образом, в этом случае:
Кг = 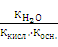 . (20)
. (20)
Из уравнений (9) и (11) можно сделать следующие выводы: степень гидролиза тем больше:
1) чем больше КH2O, то есть чем выше температура раствора, поскольку ионное произведение воды прямо пропорционально зависит от температуры;
2) чем меньше Косн. или Ккисл., то есть чем слабее образующееся в результате гидролиза основание или кислота;
3) чем меньше концентрация соли.
Таким образом, гидролиз соли можно усилить нагреванием или разбавлением раствора. Кроме того, сместить равновесие обратимой реакции гидролиза можно, согласно принципу Ле Шателье, путём связывания продуктов гидролиза, например, подкислением или подщелачиванием раствора.
В общем виде гидролиз солей можно представить в виде таблицы 2.
Таблица 2 – Гидролиз солей
| Образующие соль | Продукты гидролиза по 1-ой ступени | Реакция раствора (рН) | |||
| Основание | Кислота | Характерные катионы | Характерные анионы | ||
| Сильное | Сильная | Катионы щелочных и щелочно-земельных металлов | Сl-, Br-, I-, NO3-, SO42-, ClO3-, ClO4-, MnO4- | – | Нейтральная (рН = 7) |
| Сильное | Слабая | Катионы щелочных и щелочно-земельных металлов | CO32-, SO32-, NO2-, CN-, PO43- и др. | Кислые соли | Щелочная (рН > 7) |
| Слабое | Сильная | Cu2+, Fe2+, Zn2+, Mn2+, Al3+ и др. | Сl-, Br-, I-, NO3-, SO42-, ClO3-, ClO4-, MnO4- | Основные соли | Кислая (рН < 7) |
| Слабое | Слабая | Cu2+, Fe2+, Zn2+, Mn2+, Al3+ и др. | CO32-, SO32-, NO2-, CN-, PO43- и др. | Основание и кислота | Зависит от соотношения Косн. и Ккисл. |
Особые случаи гидролиза
Гидролиз может протекать необратимо, если продукты гидролиза выпадают в осадок или улетучиваются в виде газа. В этом случае гидролиз называют полным или необратимым. Например:
Al2S3 + H2O ® 2Al(OH)3¯ + 2H2S.
Соли такого рода не могут существовать в водных растворах.
Ряд катионов, к которым относится Ве2+, Sn2+, Pb2+, Bi3+, Sb3+, Fe3+, Zr4+, обладают повышенным поляризующим действием. Они поляризуют и разрывают в молекулах воды не только связь Н–ОН, но и связь О–Н. Поэтому при гидролизе солей, образованных этими катионами, образуются оксосоли или комплексные соли. Например, гидролиз хлорида сурьмы (III) идет с образованием малорастворимого соединения – хлорида оксосурьмы (III) (хлористого антимонила) SbOCl:
SbCl3 + H2O «SbOHCl2 + HCl,
SbOHCl2 + H2O «Sb(OH)2Cl + HCl,
Sb(OH)2Cl ® SbOCl¯ + H2O.
Внесение в систему НСl в соответствии с принципом Ле Шателье смещает равновесие влево и приводит к растворению осадка хлористого антимонила, добавление воды смещает равновесие вправо (усиливает гидролиз), что сопровождается выпадением осадка SbOCl.
Аналогично протекает гидролиз хлорида циркония (IV).
При гидролизе солей остальных вышеуказанных катионов образуются комплексные соединения.
Гидролиз соединений с ковалентно-полярными связями, к которым относятся галогениды амфотерных металлов, находящихся в степени окисления +4, например SnCl4, PbF4, протекает необратимо. При этом образуются оксикислоты или оксиды металлов.
SnCl4 + 4H2O = H2SnO3¯ + 4HCl,
TiCl4 + 2H2O = TiO2¯ + 4HCl.
Гидролиз гидридов, нитридов, фосфидов, карбидов также протекает необратимо с образованием гидроксида металла и летучего соединения:
СаH2 + 2H2O = Ca(OH)2 + H2,
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3,
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4,
Na2C2 + 2H2O = 2NaOH + C2H2.
Примеры решения задач
Пример 1. Вычислите константу гидролиза (КГ), степень гидролиза (h) и рН 0,1 моль/л раствора CH3COONa.
Решение:
Запишем уравнение гидролиза CH3COONa в трех формах:
1) молекулярной
CH3COONa + H2O ⇄ CH3COOH + NaOH;
2) ионно-молекулярной
CH3COO− + Na+ + H2O ⇄ CH3COOH + Na+ + OH−;
3) краткой ионно-молекулярной
CH3COO− + H2O ⇄ CH3COOH + OH−.
 ;
;
 ,
,  ;
;
 .
.
Степень гидролиза определяем по формуле
 или h = 0,0074 %.
или h = 0,0074 %.
Пример 2. Степень гидролиза нитрата аммония в растворе с молярной концентрацией, равной 0,001 моль/л, равна 7,5·10-4. Рассчитать рН.
Решение:
Запишем ионно-молекулярное уравнение гидролиза:
NH4+ + H2O ⇄ H+ + NH4OH.
Из уравнения следует, что при гидролизе 1 моль NH4+ получается 1 моль H+. Поскольку степень гидролиза – это доля подвергшихся гидролизу ионов NH4+ от их общей концентрации 0,001 моль/л, концентрация гидролизуемых ионов аммония равна:
сгидр. = с·αг = 0,001·7,5·10-4 = 7,5·10-7 = сH+
pH = -lg (7,5·10-7) = 6,13.
Пример 3. Рассчитать рН раствора гипохлорита натрия С = 10-2 моль/л, если степень гидролиза этой соли равна 0,01.
Решение:
Из уравнения гидролиза
ClO− + H2O ⇄ OH− + HClO
следует, что каждый ион ClO− при гидролизе дает 1 ион OH−.
сгидр. = 10-2·10-2 = 10-4 моль/дм3 = сОН−;
рОН = –lg10-4 = 4;
pH = 14 – 4 = 10.
Пример 4. Рассчитать рН раствора хлорида аммония с молярной концентрацией, равной 0,05 моль/дм3.
Решение:
NH4+ + H2O ⇄ H+ + NH4OH.
Константа гидролиза
Кг =  .
.
По таблице находим константу диссоциации Кд = 1,8·10-5 и рассчитываем:
КГ = 10-14/1,8·10-5 = 5,55·10-10.
Из уравнения гидролиза следует, что [H+] = [NH4OH]. Тогда
 .
.
Отсюда
 .
.
рН = -(lg 5,27·10-6) = 5,28.
Пример 5. Рассчитать рН раствора фторида калия с молярной концентрацией, равной 0,02 моль/дм3.
Решение:
F− + H2O ⇄ OH− + HF.
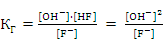 ;
;
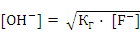 .
.
По таблице КHF = 6,7·10-4. Тогда КГ = 10-14/6,7·10-4 = 1,49·10-11;
 ;
;
рОН = - lg (5,46·10-7) = 6,26;
рН = 14 – 6,26 = 7,74.
Вопросы и задачи
1 Напишите ионно-молекулярные уравнения реакций гидролиза с указанием рН при растворении в воде следующих солей: сульфата цинка, нитрата калия, хлорида цезия, сульфата хрома (III).
2 Напишите в ионно-молекулярной форме уравнения гидролиза следующих солей: K2S, Li2CO3, K3PO4, K2SO3, ZnCl2.
3 Напишите в молекулярной форме уравнение гидролиза гидросолей и определите рН среды их водных растворов: NaHSO3, NaHS, KHCO3, Na2HPO4, NaH2PO4.
4 Напишите молекулярно-ионные формы уравнений гидролиза (отдельно для катиона и аниона) и укажите реакцию водных растворов солей: (NH4)2S, (NH4)2SO3, (NH4)3PO4, (NH4)2HPO4.
5 Составьте молекулярные и ионно-молекулярные уравнения гидролиза солей CrCl3, FeSO4, Na2SO3 и Na2S. Какие из перечисленных растворов имеют pH < 7? pH > 7?
6 Какую реакцию имеют растворы солей Zn(NO3)2, Al2(SO4)3, K2CO3, KNO3, NaCN? Ответ подтвердите ионно-молекулярными уравнениями.
7 Напишите в молекулярной и в молекулярно-ионной форме уравнения реакций:
1) Fe2(SO4)3 + Na2CO3 + H2O →
2) AlCl3 + (NH4)2S + H2O →
3) Cr2(SO4)3 + (NH4)2S + H2O →
8 Напишите в молекулярной и в молекулярно-ионной форме уравнения реакций:
1) AlCl3 + CH3COONa + H2O → Al(OH)(CH3COO)2 + …
2) CuSO4 + Na2CO3 + H2O → [Cu(OH)2]CO3 + …
3) Na2SiO3 + NH4Cl + H2O →
9 Укажите, не производя вычислений, в каком из растворов двух солей равной концентрации рН больше или меньше:
1) NaClO4 и NaClO
2) K2S и K2Se
3) Na2CO3 и NaHCO3
10 Укажите, не произведя вычислений, в каком из растворов двух солей равной концентрации рН больше или меньше:
1) CH3COO Na и HCOONa
2) Na2CO3 и NaSO3
3) HCOONa и HCOONH4
11 Охарактеризуйте поведение в растворе следующих солей и укажите реакцию их водных растворов: HCOOK, NH4Br, K2HPO4, Cu(NO3)2.
12 Раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 сильнощелочную реакцию. Объясните эти факты, подтвердите уравнениями.
13 Почему растворы NaF и Na2S имеют щелочную, а растворы ZnSO4 и NH4NO3 кислую реакцию? Ответ подтвердите ионно-молекулярными уравнениями.
14 Какая из двух солей при равных условиях в большей степени подвергается гидролизу: FeCl2 или FeCl3, MgCl2 или ZnCl2, NaCN или CH3COONa? Почему? Составьте молекулярные и ионно-молекулярные уравнения гидролиза этих солей.
15 Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3, TlCl или TlCl2, SnCl2 или SnCl4? Почему? Составьте молекулярные и ионно-молекулярные уравнения гидролиза этих солей.
16 Почему растворы NaH2PO4 имеют слабокислую, Na3PO4 – щелочную, СН3СООNH4, KCl – нейтральную, CuSO4 – кислую реакции? Какие из перечисленных солей подвергаются гидролизу? Составьте молекулярные и ионно-молекулярные уравнения гидролиза этих солей.
17 Как зависит степень гидролиза от температуры? Почему? В какую сторону сместится равновесие гидролиза NaCN, если к раствору прибавить: а) щёлочь; б) кислоту; в) хлорид аммония?
18 При сливании водных растворов Cr(NO3)3 и Na2S образуется осадок Cr(OH)3 и выделяется газ. Составьте молекулярное и ионно-молекулярное уравнение реакций.
19 Какие из перечисленных солей подвергаются гидролизу:
1) NaHCO3
2) NaCN
3) KNO3?
Напишите молекулярные и ионно-молекулярные уравнения гидролиза.
20 Вычислите константу гидролиза фторида калия, определите степень гидролиза этой соли в 0,01М растворе и рН раствора.
21 Вычислите рН 0,02 г-экв/л раствора соды Na2CO3, учитывая только первую ступень гидролиза.
22 Сравните степень гидролиза соли и рН среды в 0,1 М и 0,001 М растворах цианида калия.
23 При 60 ºС ионное произведение воды КH2O = 10-12. Считая, что константа диссоциации хлорноватистой кислоты не изменяется с температурой, определите рН 0,001н раствора KOCl при 25 и 60ºС.
24 рН 0,1 М раствора натриевой соли органической одноосновной кислоты равен 10. Вычислите константу диссоциации этой кислоты.
25 Исходя из значений констант диссоциации соответствующих кислот и оснований, укажите реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S.
26 Почему раствор NaHCO3 имеет слабощелочную, а NaHSO3 слабокислую реакцию? Ответ обоснуйте.
27 Вычислите константу гидролиза карбоната натрия, степень гидролиза соли в 0,1 М растворе и рН среды.
28 Вычислите константу гидролиза ортофосфата калия. Каков рН в 2,4 М растворе Na3PO4? Определите степень гидролиза.
29 Вычислите константу гидролиза ортофосфата калия. Каков рН в 3 н растворе Na3PO4? Какова степень гидролиза?
30 Вычислите константу гидролиза сульфита натрия, степень гидролиза и рН 0,6 М раствора.
31 Вычислите рН 0,2 М раствора NaHCOO, если KHCOOH = 1,7∙10-4.
32 Оцените рН раствора, полученного растворением 0,001 г NH4Cl в 10 л воды.
33 В чем состоит отличие реакций гидролиза Al(CH3COO)3 и Al2S3?
34 Объясните, почему при введении в раствор FeCl3 раствора соды в осадок выпадает не карбонат железа, а его гидроксид. Напишите уравнения процессов.
35 Составьте уравнения реакций, протекающих в водных растворах:
1) AlCl3 + H2O →
2) AlCl3 + (NH4)2S + H2O →
3) AlCl3 + (NH4)2CO3 + H2O →
36 Предполагают, что гидролиз буры протекает в 2 стадии:
B4O72- + 3H2O ↔ 2H3BO3 + 2BO2−;
BO2- + 2H2O ↔ H3BO3 + OH−.
Как рассчитать рН раствора буры известной концентрации?
37 Вычислите рН раствора NH4OH, в 5 л которого содержится 20 г NH4Cl, если Кд = 1,8∙10-5.
38 У какого раствора рН больше: SnCl2 или SnCl4 (при одинаковых концентрациях)?
39 Отличается ли гидролиз AlCl3 от AlF3? Ответ обоснуйте уравнениями.
40 Приведите возможные способы смещения равновесия реакций гидролиза вправо и влево.
41 Приготовлены растворы солей Na2CO3, FeCl3 и CuSO4. Напишите постадийно уравнения гидролиза. Как осуществить последнюю стадию гидролиза?
42 Расположите соединения Na2CO3, NaHCO3 и NaOH в порядке увеличения рН их растворов одинаковой концентрации.
43 Напишите сокращенным молекулярно-ионным способом уравнения реакций гидролиза следующих солей: 1) FeCl3; 2) Fe2(SO4)3; 3) Fe(OH)Cl2.
44 Напишите сокращенные молекулярно-ионные уравнения реакций гидролиза следующих солей: 1) NaNO3; 2) NH4NO2; 3) NH4NO3.
45 Напишите сокращенные молекулярно-ионные уравнения реакций гидролиза следующих солей: 1) Zn(NO3)2; 2) Cu(NO3)2; 3) Ca(NO2)2.
46 Напишите сокращенные молекулярно-ионные уравнения реакций гидролиза следующих солей: 1) Cu(CH3COO)2; 2) CuSO4; 3) Cu(OH)NO3. Укажите реакцию среды.
47 Укажите способы смещения равновесия реакций гидролиза вправо:
CO32- + H2O ↔ HCO3− + OH−
HCO3− + H2O ↔ H2CO3 + OH−
48 Напишите молекулярно-ионные уравнения гидролиза кислых солей и определите реакцию их водных растворов: 1) NaHSO3; 2) NaHS; 3) KHCO3; 4) Na2HPO4.
49 Какая соль железа гидролизуется сильнее: FeCl2 или FeCl3 и почему? Ответ обоснуйте.
50 Определите степень гидролиза 0,01 М раствора сульфида калия. Можно ли использовать упрощенную формулу, α = (Кг/См)1/2? В какую сторону сместится равновесие при добавлении кислоты? щёлочи?
51 Раствор, содержащий в 1 л 3,81 г тетрабората натрия Na2B4O7∙10H2O (бура), имеет рН = 9,18. Напишите уравнение реакции гидролиза и вычислите константу первой стадии гидролиза, предполагая, что она обусловливает щелочную среду раствора.
52 Вычислите константу диссоциации BeOH+
BeOH+ = Be2+ + OH−
исходя из того, что рН 0,02 М раствора BeCl2 составляет 4,2.
53 Соли, образованные многоосновными кислотами и многокислотными основаниями, гидролизуются по ступеням. Докажите, что полная константа гидролиза равна произведению констант всех ступеней гидролиза.
54 Вычислите рН 0,2 М раствора HCOONa, если К HCOOH = 1,7∙10-4.
55 Водные растворы HCl и FeCl3 показывают кислую среду. Это объясняется протеканием следующих процессов:
HCl + H2O = H3O+ + Cl−,
FeCl3 + 2H2O = H3O+ + Cl− + FeOHCl2.
56 Укажите признаки сходства и различия этих процессов. Назовите процессы.
57 Предскажите реакцию среды (кислая или щелочная) водных растворов Na3PO4, Na2HPO4, NaH2PO4.
58 Определите рН 0,1 М раствора ортофосфата калия.
59 У какого раствора рН больше: FeCl2 или FeCl3 (при одинаковых концентрациях)?
60 Определите рН 0,1 М раствора дигидрофосфата калия.
61 Напишите уравнение гидролиза арсенaта натрия (Na3AsO4).
Варианты заданий
| Вариант | Номер задачи | |||
| 1 | 1 | 16 | 31 | 46 |
| 2 | 2 | 17 | 32 | 47 |
| 3 | 3 | 18 | 33 | 48 |
| 4 | 4 | 19 | 34 | 49 |
| 5 | 5 | 20 | 35 | 50 |
| 6 | 6 | 21 | 36 | 51 |
| 7 | 7 | 22 | 37 | 52 |
| 8 | 8 | 23 | 38 | 53 |
| 9 | 9 | 24 | 39 | 54 |
| 10 | 10 | 25 | 40 | 55 |
| 11 | 11 | 26 | 41 | 56 |
| 12 | 12 | 27 | 42 | 57 |
| 13 | 13 | 28 | 43 | 58 |
| 14 | 14 | 29 | 44 | 59 |
| 15 | 15 | 30 | 45 | 60 |
Тестовые задания
1 Обратимый гидролиз солей – это реакция, которая:
Ответы: 1) сопровождается выделением газа или выпадением осадка;
2) сопровождается изменением степеней окисления атомов элементов;
3) не сопровождается изменением степеней окисления атомов элементов;
4) сопровождается выделением теплоты;
5) является обменной между солью и водой.
2 Гидролизу по катиону подвергается:
Ответы: 1) Na2SO3; 2) ZnCl2; 3) Ca(NO3)2; 4) LiF; 5) BaI2.
3 Гидролизу по катиону подвергается:
Ответы: 1) Na2CrO4; 2) KHCO3; 3) SrCl2; 4) CuSO4; 5) CsI.
4 Гидролизу по катиону подвергается:
Ответы: 1) FeCl2; 2) NaBr; 3) RbI; 4) KNO3; 5) Li2S.
5 Гидролизу по катиону подвергается:
Ответы: 1) Li2SO3; 2) K3PO4; 3) CH3COONa; 4) CaBr2; 5)NH4Cl.
6 Гидролизу по аниону подвергается:
Ответы: 1) K2CO3; 2) Fe(NO3)2; 3) MgCl2; 4)(NH4)2SO4; 5) Li2CrO4.
7 Гидролизу по аниону подвергается:
Ответы: 1) KBr; 2)NaNO3; 3) Na3PO4; 4) MgSO4; 5) NH4I.
8 Гидролизу по аниону подвергается:
Ответы: 1) AgNO3; 2) CH3COOK; 3) AlCl3; 4) K2CrO4; 5) MnSO4.
9 Гидролизу по аниону подвергается:
Ответы: 1) NiBr2; 2) BeSO4; 3) Cu(NO3)2; 4) Na2S; 5) KI.
10 Гидролизу не подвергается:
Ответы: 1) FeSO4; 2) CuBr2; 3) Pb(NO3)2; 4) KMnO4; 5) CrCl3.
11 Гидролизу не подвергается:
Ответы: 1) NaCl; 2) AlCl3; 3) Bi(NO3)3; 4) SnSO4; 5) K2CO3.
12 Гидролизу не подвергается:
Ответы: 1) BiCl3; 2) FeSO4; 3) PbNO3; 4) Al2(SO4)3; 5)Ca(NO3)2.
13 Гидролиз невозможен для следующей группы соединений:
Ответы: 1) оксиды; 2) нитриды; 3) фосфиды; 4) гидриды.
14 Пара веществ, в растворе которых лакмус изменяет окраску на красную и синюю соответственно:
Ответы: 1) Na2CO3 и K2SO3; 2) ZnSO4 и AlBr3; 3) NiCl2 и Ba(NO2)2; 4) NaNO3 и CaCl2.
15 В водных растворах соли гидролизуются только по катиону:
Ответы: 1) Na2SO4, K2Cr2O7, Ba(NO3)2; 2) CuCl2, NH4Br, Fe2(SO4)3;
3) K2CO3, KClO, Na2S; 4) KF, NaHCO3, CaCl2; 5) NaNO2, KClO3, CH3COONa.
16 В водных растворах соли гидролизуются только по аниону:
Ответы: 1) Na2SO4, Al2(SO4)3, KNO3; 2) CuCl2, NH4Br, Fe2(SO4)3;
3) K2CO3, Na2HPO4, Na2S; 4) KCN, NaHCO3, CH3COONa;
5) KClO4, NaH2PO4, CuSO4.
17 В водных растворах гидролизу не подвергаются соли:
Ответы: 1) Al2(SO4)3; 2) Ba(NO3)2; 3) Na2SO3; 4) NH4Br; 5) Na3PO4.
18 Цинк будет растворяться при погружении его в раствор:
Ответы: 1) NaCl; 2) BaCl2; 3) AlCl3; 4) KCl.
19 Вследствие взаимного усиления гидролиза солей выделяется газ при совместном присутствии в водном растворе:
Ответы: 1) Fe2(SO4)3 и K2CO3; 2) Cr(NO3)3 и K2SO3; 3) Na2SO3 и HCl; 4) K2CO3 и Н2SO4; 5) Cu(NO3)2 и K2CO3; 6) AlCl3 и Na2S.
20 Щелочную реакцию имеет раствор:
Ответы: 1) KCl; 2) Na2CO3; 3) ZnCl2; 4) Na3PO4; 5) (NH4)2SO4.
21 В водном растворе сульфида калия максимальной будет концентрация ионов:
Ответы: 1) HS-; 2) S2-; 3) H+; 4) H2S; 5) OH-.
22 Гидролиз нитрита натрия можно подавить при добавлении в его водный раствор:
Ответы: 1) NaNO3; 2) NaOH; 3) Н2O; 4) HCl; 5) КОН.
23 Газ выделяется при смешивании растворов хлорида хрома (III) и: Ответы: 1) гидросульфида аммония; 2) гидроортофосфата калия; 3) гидросульфата натрия; 4) силиката натрия.
24 Для усиления гидролиза FeCl3 в его водном растворе необходимо:
Ответы: 1) повысить температуру раствора соли; 2) понизить температуру раствора соли; 3) добавить хлороводородную кислоту; 4) добавить хлорид натрия; 5) добавить воду.
25 При медленном добавлении раствора карбоната натрия к раствору нитрата магния в результате взаимного усиления гидролиза солей образуются продукты:
Ответы: 1) Mg(OH)2; 2) MgCO3; 3) Mg2(OH)2CO3; 4) MgO; 5) NaNO3.
Лабораторная работа «Гидролиз солей»
Опыт 1. Определение рН растворов кислот и оснований: HCl, CH3COOH, NaOH, NH4OH.
На предметное стекло положите полоски универсального индикатора, нанесите на них 1 каплю исследуемого раствора и тотчас же сравните окраску бумаги с эталонной шкалой универсального индикатора. Напишите уравнения диссоциации. Сделайте выводы о силе электролитов.
Опыт 2. Определение рН растворов солей: MgCl2, CuSO4, NaCl, Na2SO4, Na2CO3.
На предметное стекло положите полоски универсального индикатора и нанесите на них по 1 капле исследуемого раствора. Определите рН растворов этих солей, сравнивая со шкалой универсального индикатора.
Какие из испытуемых солей подвергаются гидролизу? Составьте молекулярные и ионно-молекулярные уравнения реакций гидролиза этих солей.
Опыт 3. Влияние температуры на гидролиз
В пробирку внесите 5 капель раствора FeCl3 и 5 капель раствора CH3COONa одинаковой концентрации. Нагрейте смесь до кипения. Наблюдайте выпадение бурого осадка основных уксуснокислых солей железа. Напишите уравнение реакции гидролиза уксуснокислого железа (III).
Опыт 4. Влияние разбавления раствора на гидролиз
Нанесите на часовое стекло 2 капли SbCl3 и 3–4 капли воды. Наблюдайте образование осадка основной соли Sb(OH)2Cl, которая легко теряет воду.
Напишите уравнение реакции гидролиза SbCl3 с образованием хлористого антимонила SbOCl (осадок сохраните для следующего опыта).
Опыт 5. Обратимость гидролиза
1) К раствору SbCl3 с осадком SbOCl (из опыта 4) прилейте несколько капель HCl до растворения осадка. Затем добавьте 3 капли воды. Дайте объяснения наблюдаемым явлениям.
2) Внесите в пробирку 10 капель 0,5 н раствора CH3COONa и 1 каплю фенолфталеина. Нагрейте жидкость до кипения. Охладите раствор. Напишите уравнение гидролиза CH3COONa. Дайте объяснения наблюдаемым явлениям.
Опыт 6. Полный гидролиз
В две пробирки внесите по 5 капель раствора соли алюминия и к ним добавьте 5 капель раствора Na2CO3. Наблюдайте выпадение белого аморфного осадка и выделение CO2. Убедитесь в том, что в осадке находится Al(OH)3. В одной из пробирок осадок обработать разбавленной соляной кислотой, а в другой – раствором гидроксида натрия. В обоих случаях наблюдать растворение осадка.
Составьте уравнения реакций.
Приложение А






