Тепловое состояние тела определяется интенсивностью теплового движения его молекул. При изменении этого движения меняются внутренняя энергия и тепловое состояние тела. В качестве характеристики теплового состояния вводят понятие температуры Т, как физической величины, количественно описывающей интенсивность хаотического движения молекул. Температура характеризует степень нагретости тела. Температура, выраженная в кельвинах, по термодинамической шкале, называется абсолютной и обозначается Т (К). Т=273+t0С. Самая низкая температура по шкале Кельвина это температура абсолютного нуля. Абсолютный нуль это такая температура, при которой должно прекратиться поступательное движение молекул. При изменении теплового состояния тела изменяются параметры состояния: температура, объем, теплопроводность и др. При контакте тел с разными температурами между телами идет обмен энергиями: одни тела отдают энергию, другие ее принимают. В процессе теплообмена перенос энергии идет до тех пор, пока не наступает тепловое равновесие, т.е. температуры взаимодействующих тел выравниваются, а передача и изменение энергии от одного тела к другому прекращаются. Экспериментально было установлено, что количество переданной энергии при теплообмене пропорционально массе тела и разности температур. Если процесс теплообмена происходит без совершения работы, то тело получает тепло только за счет изменения внутренней энергии. Часть внутренней энергии, которую тело получает или отдает в процессе теплопередачи, называется количеством теплоты Q(Дж). Количество теплоты, полученное жидкостями, в процессе их нагревания электрокалориметром, определяется по формуле:
Q =m·c (T2 – T1) (4.27)
где с (Дж/кг·К)–удельная теплоемкость вещества; m(кг) – масса нагретой жидкости; T2 – T1 – разность температур жидкости в процессе нагревания
Величина, характеризующая зависимость изменения внутренней энергии тела при нагревании или охлаждении от рода вещества и от внешних условий, называется удельной теплоемкостью вещества суд. Удельная теплоемкость зависит от рода вещества, от внешних условий, от агрегатного состояния вещества. Так удельная теплоемкость газа зависит от характера процесса, при котором происходит нагревание. Удельная теплоемкость газа при постоянном давлении С(Р) больше его удельной теплоемкости при постоянном объеме С(v), так как в первом случае нужно не только увеличить внутреннюю энергию газа, но и затратить энергию на выполнение работы, совершаемой газом над внешними силами в процессе его расширения.
Так как резисторы, на изолирующих пластинах, имеют одинаковые сопротивления, то они отдают одинаковое количество теплоты жидкостям при прохождении через них электрического тока.
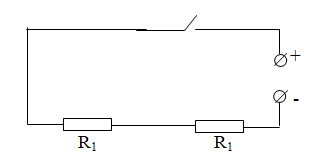
Рисунок 4.8 – Схема электрической цепи
Исходя из уравнения теплового баланса:
Qполуч=Qотдан (4.28)
Qж+Qк+ж=Qв+Qк+в (4.29)
где Qв, Qж(Дж)-количество теплоты, полученное водой и жидкостью; Qк+ж, Qк+в(Дж)- количество теплоты, полученное калориметром с жидкостью и полученное калориметром с водой
Qв=св· mв·(T2в – T1в) (4.30)
Qк+в= ск+в· mк+в·(T2в – T1в) (4.31)
Qк+ж= ск+ж· mк+ж·(T2ж – T1ж) (4.32)
Удельная теплоемкость вещества измеряется количеством теплоты, необходимым для нагревания единицы массы вещества на единицу температуры.
Учитывая (4.27) найдем удельную теплоемкость жидкости:
Сж=Qж/ mж·(Tж2- Tж1) (4.33)
Порядок выполнения работы
Часть
1. Установить на штативе 2 термометра;
2. Собрать электрическую цепь по схеме (рис.4.8);
3. Взвесить пустые калориметры (внутренние);
4. Взвесить калориметр с водой вылив в него воду из мерного стаканчика;
5. Определить массу воды;
6. Взвесить калориметр с неизвестной жидкостью вылив в него жидкость из мерного стаканчика;
7. Определить массу неизвестной жидкости;
8. Опустить изолированные сопротивления с изолированными проводами в калориметры, подвесив провода на лапке штатива;
9. Нагреть воду и неизвестную жидкость на 2 -30С;
10. Разомкнуть электрическую цепь и данные записать в таблицу4.10;
Таблица 4.10 − Экспериментальные данные
| № | Масса кг | Температура К | Масса кг | Температура К | Уд.теплоемкость Дж/кг К | ||||||
| mв | mк | Тв1 | Тв2 | mж | mk | Tж1 | Tж2 | св | ск | с ж | |
| 1 | |||||||||||
| 2 | |||||||||||
Часть
1. Для избегания ошибок от возможной неодинаковости сопротивлений обоих калориметров следует повторить опыт, поменяв местами сопротивления и взять среднюю величину для расчета С из обоих опытов.
2. Проделать измерения соответствующих величин повторив пункты с 1 -10;
3.Рассчет удельной теплоемкости неизвестной жидкости произвести двумя способами по таблице4.11
Таблица 4.11 − Экспериментальные данные
| № | Сж Дж/кг К | Сжср Дж/кг К |  С
Дж/кг К С
Дж/кг К
|  Сср
Дж/кг К Сср
Дж/кг К
| ε% | ε% |
| 1 |
|
|
|
| ||
| 2 |






