Раздел химии, изучающий скорость и механизм химических реакций, называется химической кинетикой. Скоростью химической реакции называется изменение количества реагирующего вещества за единицу времени в единице реакционного пространства. Скорость химической реакции зависит от природы реагирующих веществ, их концентраций, температуры, давления (в случае газообразных участников реакции) и присутствия катализатора.
Зависимость скорости от концентрации выражается основным законом химической кинетики – законом действия масс(для простых реакций, протекающих в одну стадию в одном направлении в соответствии со стехиометрическим уравнением): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам.
В общем случае для реакции вида
а А + b В +... → m M + n N +...
математическое выражение закона имеет вид
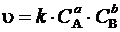 , (10)
, (10)
где u – скорость химической реакции; k – коэффициент пропорциональности, называемый константой скорости реакции, который равен скорости реакции при единичных концентрациях реагирующих веществ (т.е. при С A = С B = 1 моль/дм3, k = u); С A и
С B – концентрации реагентов, моль/дм3; а и b – стехиометрические коэффициенты.
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры и от присутствия катализатора. Выражение (10) называется кинетическим уравнением реакции.
В химической кинетике реакцииклассифицируют по молекулярности,т.е. по числу частиц, участвующих в элементарном взаимодействии, ипо порядку кинетического уравнения данной реакции (по порядку реакции). Известны одно-, двух- и трехмолекулярные (моно-, би- и тримолекулярные) реакции, например:
моно- А → В + С; би- А + В → С или 2А → В + С.
Порядком химической реакции n называют сумму показателей степеней при концентрациях реагентов в кинетическом уравнении. Различают общий и частный (по каждому веществу) порядки реакции. Общий порядок реакции есть сумма частных порядков. Реакции, скорость которых не зависит от концентрации, имеютнулевой порядок.
Для реакции первого порядка уравнение для расчета константы скорости реакции имеет вид
 , время-1,
, время-1,
где С – начальная концентрация вещества, моль/дм3; х – количество вещества, вступившего в реакцию к моменту времени τ.
Зависимость скорости гомогенной химической реакции от температуры определяется эмпирическим уравнением Вант-Гоффа:
 ,
,
где u2 и u1 – скорости реакции при температурах Т 2 и T 1; γ – температурный коэффициент скорости реакции (для большинства реакций он лежит в пределах значений 2 – 4). Указанная зависимость может быть выражена в виде следующего правила: при повышении температуры на каждые 10° скорость реакции увеличивается в 2 – 4 раза, если реакция проводится при температуре, близкой к комнатной.
Зависимость константы скорости реакции от температуры также может быть выражена уравнением Аррениуcа:
 ,
,
где А – предэкспоненциальный множитель, не зависящий от Т и концентрации; Т – абсолютная температура, К; Е А – энергия активации, Дж/моль.
Энергия активации равна тому избытку энергии, которым должны обладать молекулы реагентов по сравнению со средней энергией молекул при данной температуре, чтобы их столкновение приводило к химическому взаимодействию. Величина Е А химической реакции может быть рассчитана по уравнению Аррениуса, если известны значения констант скоростей при разных температурах:
 (11)
(11)
Химизм процесса окисления йодоводородной кислоты
пероксидом водорода
Реакция окисления йодоводородной кислоты пероксидом водорода выражается уравнением
2HI + Н2О2 ® 2Н2О + I2.
Количество прореагировавшего пероксида водорода определяется эквивалентным количеством йода путем титрования последнего раствором тиосульфата натрия Na2S2О3:
I2 + 2Na2S2О3 ® 2NaI + Na2S4О6.
Йодоводородную кислоту получают действием серной кислоты на йодиды, например KI или NaI:
2KI + H2SO4 ® K2SO4 + 2HI.
Так как в результате опыта концентрации KI и HI остаются постоянными, то скорость реакции в условиях опыта зависит только от концентрации пероксида водорода. Следовательно, для вычисления константы скорости этой реакции можно применить уравнение первого порядка.
Порядок выполнения работы
Приборы и реактивы: термостат, секундомер, термометр, бюретка вместимостью 25 см3, колба мерная вместимостью 100 см3, колба коническая вместимостью 200 см3, пипетка Мора вместимостью 10 см3; растворы: серной кислоты С (H2SO4) = 1 моль/дм3; иодида калия или натрия ω (KI; NaI) = 0,4 %; тиосульфата натрия С (Na2S2О3) = 0,05 моль/дм3; пероксида водорода ω (H2О2) = l %; крахмала ω [(С6H10O5) x ] = 3 %; молибдата аммония C [(NH4)2MoО4] = 0,1 моль/дм3.
Х о д р а б о т ы
1. В коническую колбу вместимостью 250 см3 последовательно прилить следующие растворы:
а) 100 см3 раствора KI (раствор отмеряют мерной колбой);
б ) 5 см3 раствора H2SO4 (раствор отмеряют мерным цилиндром);
в) из бюретки прибавляют 1 см3 раствора Na2S2O3;
г) из капельницы вносят 3 – 4 капли крахмала.
2. В колбу поместить термометр и дождаться момента, когда раствор в колбе примет заданное преподавателем значение температуры (если температура выше комнатной, то следует нагреть раствор на водяной бане, а если температура ниже комнатной, то необходимо охладить систему на ледяной бане).
3. С помощью пипетки Мора к реакционной смеси прилить 10 см3 раствора Н2О2. Содержимое колбы перемешать. С последней каплей Н2О2 включить секундомер.
4. Не выключая секундомер, отметить текущее время первого появления синего окрашивания раствора, записав его в таблицу формы 5.
5. К раствору из бюретки снова прилить 1 см3 раствора Na2S2O3, смесь в колбе перемешать (окраска должна исчезнуть). Ждать следующего появления синего окрашивания раствора.
6. Не выключая секундомер, снова отметить текущее время появления синего окрашивания раствора и записать его в таблицу формы 5.
7. Прилить ещё 1 см3 раствора Na2S2O3, перемешать и ждать следующего появления синего окрашивания, отмечая время появления окрашивания по часам. Эти операции продолжать до тех пор, пока число измерений не станет равным 4 или 6 в зависимости от температуры опыта (шесть раз при комнатной и при повышенной температурах, 4 раза при пониженной температуре).
8. После последнего появления синего окрашивания раствора отметить время и выключить секундомер.
9. Из бюретки снова добавить 1 см3 раствора Na2S2O3 и 2 – 3 капли раствора молибдата аммония, который является катализатором данного процесса. Смесь перемешать.
10. Полученный раствор оттитровать из бюретки раствором Na2S2O3 до полного обесцвечивания. Записать общий объем тиосульфата натрия, пошедший на титрование в таблицу формы 5.
11. Получить у преподавателя результаты титрования системы при другой температуре. Данные занести в таблицу формы 5.
Форма 5
Экспериментальные и расчетные данные
| № опыта | Температура опыта Т, К | Объем Na2S2О3 х i , см3 | Общий объем Na2S2О3 V, см3 | Время появления окрашивания от начала опыта, τ i | Константа скорости реакции k, мин-1 | Энергия активации Е А , кДж/моль | П, % | |||
| мин и с | мин | k i | 
| Е А эксп | Е А теор | |||||
| 1 2 | T 1 T 2 | x 1 = 1 x 2 = 2 x 3 = 3 …. x 1 = 1 x 2 = 2 x 3 = 3 …. | 55,0 | |||||||
Обработка экспериментальных данных
1. Отдельно для каждого промежутка времени τ1, τ2, τ3 и т.д. с точностью до четвертого десятичного знака вычисляем константы скорости реакции по формуле

 , мин-1,
, мин-1,
где τ i – время от начала опыта, мин; xi – объем раствора Na2S2О3, соответствующий τ i, см3; V – общий объем раствора Na2S2О3, пошедший на титрование, см3.
2. Рассчитываем среднее значение константы скорости данной реакции при заданной температуре опыта:
 ,
,
где m – количество измерений времени появления синего окрашивания системы.
3. По аналогии рассчитываем значение  при другой температуре.
при другой температуре.
4. Вычисляем энергию активации по формуле (11):
 .
.
5. Определяем относительную погрешность проведения опыта, считая, что теоретическое значение энергии активации данной реакции 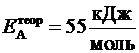 .
.
6. Расчетные данные заносим в таблицу формы 5.
7. Оформляем метрологическую карту средств измерения и формулируем выводы.
Контрольные задания
Вариант 1
1. Во сколько раз изменится скорость гомогенной газовой реакции
4HCl + O2 ® 2H2O + 2Cl2,
если общее давление в системе увеличить в 3 раза?
2. При какой температуре реакция закончится за 45 мин, если при 293 К на это требуется 3 ч? Температурный коэффициент скорости реакции принять равным 3,2.
3. При температуре 36 °С константа скорости распада пенициллина равна 6 · 10-6 с-1, а при температуре 41 °С равна 1,2 · 10-5 с-1. Вычислить энергию активации.
4. Вычислить константу равновесия реакции
Н2 + I2 «2HI,
если до начала реакции в сосуде объемом 5 л содержалось 1 моль водорода и 2 моль йода, а к моменту равновесия образовалось 35 г HI.
Вариант 2
1. Как изменятся скорости реакций, если объем каждой из систем уменьшить в 4 раза?
а) Sтв + О2 ® SO2 газ;
б) 2SO2 газ + О2 ® 2SO3 газ.
2. Две реакции при 283 К протекают с одинаковой скоростью. Температурный коэффициент первой реакции равен 2,5, а второй – 3,0. Найти соотношение скоростей данных реакций при температуре 350 К.
3. При 393 К реакция заканчивается за 18 мин. Через какой промежуток времени эта реакция закончится при 453 К, если температурный коэффициент скорости реакции равен 3?
4. Вычислить константу равновесия реакции
Н2 + I2 «2HI,
если до начала реакции в сосуде объемом 5 л содержалось 2 г водорода и 254 г йода, а к моменту равновесия образовалось 0,4 моль HI.
Вариант 3
1. Во сколько раз следует увеличить концентрацию СО в системе, чтобы повысить скорость реакции 2СО ® СО2 + Ств в 4 раза?
2. Во сколько раз уменьшится скорость реакции, если температуру понизить от 140 до 110 °С? Температурный коэффициент скорости реакции принять равным 3.
3. Температурный коэффициент скорости реакции разложения йодоводорода по реакции
2HI = H2 + I2
равен 2. Вычислить константу скорости этой реакции при 684 К, если при 629 К константа скорости равна 8,9 · 10-5 л / (моль · с).
4. В сосуд емкостью 0,2 л поместили 0,3 и 0,8 г водорода и йода. После установления равновесия в сосуде обнаружено 0,7 г HI. Вычислить константу равновесия реакции.
Вариант 4
1. Как изменится скорость реакции
2NO + Cl2 ® 2NOCl
при увеличении концентрации оксида азота в 2 раза и при увеличении концентраций обоих компонентов в 3 раза?
2. При повышении температуры на 50 К скорость реакции возросла в 1024 раза. Вычислить температурный коэффициент Вант-Гоффа.
3. Константа скорости реакции при температуре 9,4 °С равна 2,37 мин-1, а при температуре 14,4 °С составляет 3,204 мин-1. Вычислить энергию активации реакции.
4. Скорость реакции
2NO + O2 → 2NO2
при концентрациях NO и O2, равных 0,6 моль/дм3, составляет
0,18 моль/дм3 · мин. Вычислить константу скорости реакции.
Вариант 5
1. Скорость реакции при 40 °С равна 1 моль/(дм3 · c). Вычислить скорость этой реакции при 80 °С, если энергия активации реакции равна 74 кДж/моль.
2. Как изменится скорость реакции разложения карбоната кальция на оксид кальция и СО2 при уменьшении общего давления в 4 раза?
3. На сколько градусов необходимо повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент Вант-Гоффа равен 2,7.
4. В сосуде емкостью 8,5 л установилось равновесие
СО(г) + Cl2(г) ↔ СОCl2(г).
Состав равновесной смеси (в г): СО – 11, Cl2 – 38, СОCl2 – 42. Вычислить константу равновесия реакции.
Вариант 6
1. На сколько градусов нужно повысить температуру, чтобы увеличить скорость реакции в 64 раза, если температурный коэффициент реакции равен 2?
2. Как изменится скорость реакции
2NO + Cl2 ® 2NOCl
при уменьшении концентрации оксида азота в 3 раза и при уменьшении общего объема системы в 3 раза?
3. При какой температуре реакция закончится за 45 мин, если при 293 К на это требуется 3 ч? Энергия активации реакции равна 62 кДж/моль.
4. Записать выражение для константы равновесия реакции
СО + Cl2 ↔ COCl2.
Вариант 7
1. На сколько градусов нужно повысить температуру, чтобы увеличить константу скорости реакции в 90 раз, если температурный коэффициент равен 2,7?
2. Вычислить скорость прямой реакции (моль/л · мин) при концентрации оксида азота (II) 0,6 моль/л и кислорода 0,5 моль/л, если константа скорости реакции
2NО + О2 = 2NО2
равна 0,56 л2/моль2 ∙ мин.
3. Энергия активации реакции равна 103,5 кДж/моль. При 298 К константа скорости данной реакции равна 0,00203 с-1. Вычислить константу скорости при температуре 288 К.
4. Как изменится скорость прямой реакции в системе
2SO2 + О2 → 2SO3 ,
если при Т = const увеличить давление в 3 раза?
Вариант 8
1. Вычислить константу скорости реакции при 680 К, если при 630 К константа скорости данной реакции равна 8,9 ×
× 10-5 дм3/(моль · c) , а g = 2.
2. Как изменится скорость прямого процесса при увеличении концентрации паров воды в 5 раз?
СО + Н2О(г) = Н2 + СО2.
3. При повышении температуры на 27,8 °С скорость реакции возросла в 6,9 раза. Вычислить энергию активации этой реакции при температуре 300 К.
4. В какой из систем при повышении давления скорость реакции возрастет в большее число раз?
а) N2 + O2 ® 2NO;
б) 2NO + O2 ® 2NO2.
Вариант 9
1. Константа скорости некоторой реакции при 273 и 298 К равна, соответственно, 1,17 и 6,56 дм3/(моль · мин). Найти энергию активации реакции.
2. Равновесная концентрация оксида азота (II) в реакции
N2 + О2 = 2NО
составляет 4 моль/л, а исходные концентрации азота и кислорода равны, соответственно, 6 и 5 моль/л. Определить равновесную концентрацию кислорода.
3. При повышении температуры на 20 °С скорость реакции возросла в 9 раз. Вычислить температурный коэффициент скорости реакции и энергию активации этой реакции при температуре 300 К.
4. В какой из систем при повышении давления скорость реакции возрастет в большее число раз?
а) N2 + O2 ® 2NO;
б) 2NO + O2 ® 2NO2.
Вариант 10
1. При 393 К реакция заканчивается за 18 мин. Через сколько времени эта реакция закончится при 453 К, если энергия активации реакции равна 75 кДж/моль?
2. В каком направлении сместится равновесие при увеличении концентрации паров воды в 10 раз?
СО(г) + Н2О(г) ↔ Н2(г) + СО2(г).
3. Во сколько раз изменится скорость реакции
2А + В → А2В,
если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
4. Химическая реакция при температуре 10 °C заканчивается за 16 мин. При какой температуре она закончится за 1 мин при температурном коэффициенте, равном 2?
Вариант 11
1. Определить температурный коэффициент скорости реакции, если при понижении температуры на 45 К реакция замедлилась в 25 раз.
2. Как изменится скорость прямой реакции при уменьшении концентрации паров воды в 5 раз?
СО(г) + Н2О(г) = Н2(г) + СО2(г).
3. Константы скорости некоторой реакции при 288 и 325 К равны, соответственно, 0,02 и 0,38 с-1. Определить энергию активации реакции.
4. Вычислить скорость прямой реакции (моль/л · мин) при концентрации оксида азота (II) 0,9 моль/л и кислорода 0,6 моль/л, если константа скорости равна 0,56 л2/моль2 ∙ мин:
2NО(г) + О2(г) = 2NО2(г).
Вариант 12
1. Две реакции при температуре 293 К протекают с одинаковой скоростью. Температурный коэффициент первой реакции равен 2, а второй – 4. Найти соотношение скоростей данных реакций при температуре 500 К.
2. Записать выражение для константы скорости реакции
N2 + 3Н2 ↔ 2NН3.
3. Константа скорости реакции при 9,4 °С равна 2,37 мин-1, а при 14,4 °С составляет 3,204 мин-1. Вычислить энергию активации и температурный коэффициент скорости реакции.
4. Во сколько раз следует увеличить концентрацию СО в системе, чтобы повысить скорость реакции 2СО ® СО2 + Ств в 8 раз?
Вариант 13
1. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 50 и 100 раз, если температурный коэффициент скорости реакции равен 3?
2. В каком направлении сместится равновесие для газовой реакции
4HCl + O2 ↔ 2H2O + 2Cl2,
если общее давление в системе уменьшить в 3 раза?
3. Во сколько раз надо увеличить внешнее давление в системе, чтобы скорость прямой реакции А(г) + 2В(г) = С(г) увеличилась в 125 раз?
4. Исходные концентрации NO и Cl2 в гомогенной системе
2NO + Cl2 = 2NOCl
составляют, соответственно, 0,5 и 0,2 моль/дм3. Вычислить константу равновесия, если к моменту равновесия прореагировало 35 % NO.
Вариант 14
1. Вычислить температурный коэффициент скорости реакции разложения пероксида водорода в температурном интервале
25 – 55 °С при Еа = 75,4 кДж/моль.
2. Определить исходные концентрации NO и O2 и константу равновесия обратимой реакции
2NO + О2 «2NO2,
если равновесие установилось при следующих концентрациях реагирующих веществ (моль/дм3): [NO2] = 0,12; [NO] = 0,48; [O2] = 0,24.
3. В системе СО + Cl2 = COCl2 концентрацию увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
4. Во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 °C, если температурный коэффициент скорости реакции равен 2?
Вариант 15
1. Во сколько раз увеличится скорость реакции, протекающей при температуре 298 К, если энергию активации уменьшить на 4 кДж/моль?
2. Вычислить среднюю скорость реакции
I2 + H2 ® 2HI,
если в системе объемом 2 л за 15 мин образовалось 0,12 г йодоводорода.
3. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 20 и 60 раз, если температурный коэффициент скорости реакции равен 2?
4. Реакция идет по уравнению
N2 + O2 → 2NO.
Исходные концентрации азота и кислорода равны 0,049 и 0,01 моль/дм3. Вычислить концентрации веществ, когда в системе образуется 0,005 моль NO.
ПРИЛОЖЕНИЯ
Приложение 1
Титульный лист
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ






