Проводят после разделения смеси. Фенобарбитал очень мало растворим в холодной воде, трудно растворим в кипящей воде и хлороформе, легко растворим в спирте и в растворах щелочей, растворим в эфире. Анальгин легко растворим в воде, практически не растворим в эфире.
Для определения смеси навеску порошка взбалтывают с эфиром, фильтруют, проверяя полноту извлечения фенобарбитала по отсутствию пятна после испарения части извлечения. Эфир отгоняют, остаток растворяют в спирте и фенобарбитал определяют алкалиметрически
Остаток после извлечения фенобарбитала эфиром растворяют в воде и определяют анальгин йодометрически.
Фенобарбитал. Метод алкалиметрии. Основан на кислотных свойствах препарата, индикатор-метиловый красный

Кстех = 1/1 =1
Титрованный раствор натрия гидроксида по ГФ ХI готовится с учетом РЧ.
f экв = Кстех = 1
Э = f экв * М.м. = 1 * М.м. = М.м. = 232,24 г/моль
Т = М * Э / 1000 = 0,1 * 232,24 / 1000 = 0,02322г/мл
Предварительный расчет объема титранта на количественное определение:
V= a * Y = 0,27 * 0,02 = 0,86 мл 0,1 М раствора натрия гидроксида
Т* Р 0,02322 * 0,27
Где а- навеска лекарственной формы в граммах; Y – количество фенобарбитала по прописи в граммах; Т – титр фенобарбитала по 0,1 М раствору натрия гидроксида, г/мл; Р - масса лекарственной формы по прописи, гр.
Методика.
Навеска ЛФ – 0,2700 г (один порошок)
Практический объем титранта (Vопр) 0,9 мл К = 1,000
Расчет содержания (Х) в массе лекарственной формы (Р) проводят по формуле прямого титрования:
Х = Т* V* К * Vл.ф = 0,02322 * 0,9 * 1,000 * 0,27 = 0,0208г
а 0,2700
Расчет относительного отклонения.
Еоткл = (Г – Y) *100 = (0,0208 – 0,02) * 100 = 4,5 %
Y 0,02
Приказ МЗ РФ № 751 н от 21.04.16 в таблице «Отклонения в массе навески отдельных лекарственных средств в порошках» для прописанной массы 0,02 г составляет + 20%
Анальгин. Остаток после извлечения фенобарбитала эфиром растворяют в 3 мл воды. Добавляют 1 мл разведенной кислоты хлороводородной и титруют 0,1 М раствором йода до синего окрашивания (индикатор — крахмал).

Кстех.=1/1 = 1
Титрованный раствор йода по ГФ ХI готовится с учетом УЧ.
fэкв = Кстех * УЧтитр= 1* 1/2 = 1/2
Э = fэкв * М.м. =1/2 * М.м.= М.м./2 = 351,36 /2 = 175,68 г/моль
Т =Э * М / 1000 = 0,1 * 175,68 / 1000 = 0,01756г/мл
Предварительный расчет объема титранта на количественное определение:
V= a * Y = 0,27 * 0,25 = 14,36 мл 0,1 М раствора йода
Т* Р 0,01756 * 0,27
Где а- навеска лекарственной формы в граммах; Y – количество анальгина по прописи в граммах; Т – титр анальгина по 0,1 М раствору йода, г/мл; Р - масса лекарственной формы по прописи, гр.
Методика.
Навеска ЛФ – 0,2700 г (один порошок)
Практический объем титранта (Vопр) 14,4 мл К = 1,000
Расчет содержания (Х) в массе лекарственной формы (Р) проводят по формуле прямого титрования:
Х = Т* V* К * Vл.ф = 0,01756 * 14,4* 1,000 * 0,27 = 0,252 г
а 0,2700
Расчет относительного отклонения.
Еоткл = (Г – Y) *100 = (0,252 – 0,25) * 100 = 1,1 %
Y 0,25
Приказ МЗ РФ № 751 н от 21.04.16 в таблице «Отклонения в массе навески отдельных лекарственных средств в порошках» для прописанной массы 0,25 г составляет + 8%
Заключение. Лекарственная форма удовлетворяет требованиям приказа № 751 н
Виды контроля: обязательные (письменный, органолептический, контроль при отпуске) и выборочные (физический, полный химический и опросный)
Хранят в защищенном от света месте не более 10 дней
Димедрола 0,25 г
Раствора глюкозы 25% 200 мл.
Состав:
Димедрола 0,25 г
Глюкозы 50,0 г
Воды очищенной до 200 мл
Органолептический контроль. Прозрачная бесцветная жидкость. Укупорка флакона плотная, металлический колпачок не прокручивается, жидкость не подтекает. Механических включений нет.
Физический контроль. V прописанный 200 мл.
Норма отклонений (пр.№751 н) + 2%
Рассчитываем сколько мл составляет 2% от 200мл.
200мл - 100%
Х мл - 2%
Х = 200 * 2 / 100 = 4 мл.
находим нижний предел = 200 – 4 = 196 мл
находим верхний предел = 200 + 4 = 204 мл
[196 - 204]
Подлинность.
Доказывают наличие димедрола и глюкозы
Реакция на димедрол.
Реакция образования оксониевой соли. Реакция обусловлена наличием простой эфирной группы в молекуле препарата.
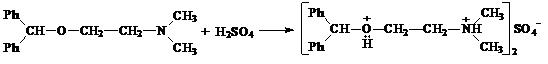
Появляется желтое окрашивание, исчезающее при добавлении 2—3 капель воды.
Реакция на глюкозу.
Реакция окисления реактивом Фелинга. Глюкоза за счет альдегидной группы обладает восстановительными свойствами, при взаимодействие с реактивом Фелинга восстанавливает ионы меди из реактива Фелинга, а сама глюкоза окисляется:

Образуется кирпично-красный осадок.
Количественное определение. Аргентометрический метод. Вариант Фаянса (прямое титрование)Основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.; индикатор –эозинат натрия. Среда – уксусно-кислая.
Кстех = 1/1
Титрованный раствор серебра нитрата по ГФ ХI готовится с учетом РЧ.
f экв = Кстех =1
Э = f экв * М.м. = 1 * М.м. = М.м. = 291,8 г/моль
Т = Э * М / 1000 = 291,8 * 0,02 / 1000 = 0,005836 г/мл
Предварительный расчет объема титранта на количественное определение:
V= a * Y = 5 * 0,25 = 1,07 мл 0,02 М раствора серебра нитрата
Т* Р 0,005836 * 200
Где а- навеска лекарственной формы в мл; Y – количество димедрола по прописи в граммах; Т – титр димедрола по 0,02 М раствору серебра нитрата, г/мл; Р - объем лекарственной формы по прописи, мл.
Методика.
Навеска ЛФ – 5 мл
Практический объем титранта (Vопр) 1,0 мл К = 1,000
Расчет содержания (Х) в объеме лекарственной формы (Р) проводят по формуле прямого титрования:
Х = Т* V* К * Vл.ф = 0,005836 * 1,0*1,000 * 200 = 0,233 г
а 5
Расчет относительного отклонения.
Еоткл = (Г – Y) *100 = (0,233 – 0,25) * 100 = - 6,7 %
Y 0,25
Приказ МЗ РФ № 751 н от 21.04.16 в таблице «Отклонения в массе навески отдельных лекарственных средств в жидких лекарственных формах при изготовлении массо-объемным методом» для прописанной массы 0,25 г составляет + 8%
Глюкоза. Метод рефрактометрии. На практике определяют относительный показательпреломления (n), который является отношением скорости света в воздухе к скорости света виспытуемом веществе.
Методика. Определяют показатель преломления 1 мл ЛФ на рефрактометре.
Выполнение количественного определения.
1.Расчет содержания (Х) в массе лекарственной формы (Р) проводят по формуле:
Хгр= (n – n 0) * 1,11 * V = (1,3653– 1,3333) *1,11 * 200 = 50,03 г
0,00142 *100 0,00142 *100
Где n0 – показатель преломления воды при 200С; 1,11 – коэффициент пересчета на водную глюкозу при содержании 10% влаги в препарате; 0,00142 – фактор показателя преломления раствора безводной глюкозы
Расчет относительного отклонения.
Еоткл = (Г – Y) *100 = (50,03 – 50,0) * 100 = 0,1 %
Y 50,0
Приказ МЗ РФ № 751 н от 21.04.16 в таблице «Отклонения в массе навески отдельных лекарственных средств в жидких лекарственных формах при изготовлении массо-объемным методом» для прописанной массы 50,0 г составляет + 3%
Заключение. Лекарственная форма удовлетворяет требованиям приказа № 751 н
Виды контроля: обязательные (письменный, органолептический, контроль при отпуске, полный химический) и выборочные (физический и опросный)
Хранят в защищенном от света месте не более 7 дней (приказ МЗ РФ №751н)
8.Раствор калия йодида 20% - концентрат..
Органолептический контроль. Бесцветная прозрачная жидкость без запаха.
Подлинность.
Доказывают наличие калия-иона и йодид-аниона.
Реакция на катион калия.
1.Реакция осаждения натрия гексанитрокобальтатом (III) в уксуснокислой среде. Образуется желтый кристаллический осадок:
2KCl + Na3[Co(NO2)6] → K2Na[Co(NO2)6] ↓ + 2NaCl
2.Соли калия окрашивают бесцветное пламя в красно-пурпурный цвет.
Реакция на йодид-анион.
Реакция с раствором натрия нитрита:
2KI + 2NaNO2 + 2H2SO4 → I2 + K2 SO4 + Na2SO4 + 2NO↑ + 2H2O
Хлороформный слой окрашивается в фиолетовый цвет.






