 В IБ-группе (группе меди) находятся переходные металлы Сu, Аg, Аu, которые имеют сходное распределение электронов, определяемое феноменом «проскока» или «провала» электронов.
В IБ-группе (группе меди) находятся переходные металлы Сu, Аg, Аu, которые имеют сходное распределение электронов, определяемое феноменом «проскока» или «провала» электронов.
 Явление «проскока» представляет собой символическое перенесение одного из двух валентных s-электронов на d-подуровень, что отражает неравномерность удержания ядром внешних электронов.
Явление «проскока» представляет собой символическое перенесение одного из двух валентных s-электронов на d-подуровень, что отражает неравномерность удержания ядром внешних электронов.
Переход одного s-электрона на внешний уровень приводит к стабилизации d-подуровня. Поэтому в зависимости от степени возбуждения атомы IБ-группы могут отдавать на образование химической связи от одного до трех электронов. Вследствие этого элементы IБ-группы могут образовывать соединения со степенями окисления +1, +2 и +3. Однако имеются различия: для меди наиболее устойчивы степени окисления +1 и +2; для серебра +1, а золота +1 и +3. Наиболее характерные координационные числа в этой группе 2, 3, 4.
Элементы 1Б-группы относительно инертны. В электрохимическом ряду стоят после водорода, что проявляется в их слабой восстановительной способности. Поэтому в природе встречаются в самородном виде. Они относятся к первым металлам, которые нашел и применил древний человек. В качестве ископаемых находят соединения: Сu2О — куприт, Сu2S — халькозин, Аg2S — аргентит, акантит, АgСl — кераргирит, АuТe2 — калаверит, (Аu,Аg)Те4 — сильванит.
В группе IБ восстановительные и основные свойства убывают от меди к золоту.
Химические свойства соединений меди, серебра, золота.
Оксид серебра (I) получают при нагревании серебра с кислородом или обработкой растворов АgNО3 щелочами:
2 АgNО3 + 2КОН → Аg2О + 2КNО3 + Н2О
Оксид серебра (I) в воде растворяется незначительно, тем не менее, вследствие гидролиза растворы имеют щелочную реакцию
Аg2О + Н2О → 2Аg+ + 2ОН-
в цианидных растворах превращается в комплекс:
Аg2О + 4КСN + Н2О → 2К[Аg(СN)2] + 2КОН
Аg2О — энергичный окислитель. Окисляет соли хрома (III):
3Аg2O + 2Сr(ОН)3 + 4NаОН → 2Nа2СrО4 + 6Аg + 5Н2О,
а также альдегиды и галогеноуглеводороды.
Окислительные свойства оксида серебра (I) обусловливают применение его суспензии как антисептического средства.
В электрохимическом ряду нормальных окислительно-восстановительных потенциалов серебро стоит после водорода. Поэтому металлическое серебро реагирует только с окисляющими концентрированной азотной и серной кислотами:
2Аg + 2Н2SО4 → Аg2SО4 + 5О2 + 2Н2О
Большинство солей серебра мало или плохо растворимы. Практически нерастворимы галогениды, фосфаты. Плохо растворимы сульфат серебра и карбонат серебра. Растворы галогенидов серебра разлагаются под действием ультрафиолетовых и рентгеновских лучей:
2АgСl —hν→ 2Аg + Сl2
Еще более чувствительны к действию ультрафиолетовых и рентгеновских лучей кристаллы АgСl с примесью бромидов. Под действием кванта света в кристалле протекают реакции
Вr-- + hν → Вг° + е-
Аg+ + е~ → Аg°
2АgВr → 2Аg0 + Вr2
Это свойство галогенидов серебра используют при изготовлении светочувствительных материалов, в частности фотопленок, рентгеновских пленок.
Нерастворимые серебро хлорид и серебро бромид растворяются в аммиаке с образованием аммиакатов:
АgСl + 2NН3 → [Аg(NH3)2]Сl
Растворение АgСl возможно потому, что ионы серебра связываются в очень прочный комплексный ион. В растворе остается настолько мало ионов серебра, что их не хватает для образования осадка, так как произведение концентраций меньше константы растворимости.
Бактерицидные свойства АgСl используются в препаратах для обработки слизистых оболочек газа. Для стерилизации и консервации пищевых продуктов применяется «серебряная вода» — обработанная кристаллами АgСl дистиллированная вода.
Так же, как и серебро, медь (I) образует нерастворимые галогениды. Эти соли растворяются в аммиаке и образуют комплексы:
СuСl + 2NН3 → [Сu(NН3)2]Сl
Нерастворимы в воде оксиды и гидроксиды меди (II), которые имеют основной характер и растворяются в кислотах:
Сu(ОН)2 + 2НСl + 4Н2О → [Сu(Н2О)6]Сl2
Образующийся аквакатион [Сu(Н2О)6]2+ сообщает растворам яркую голубую окраску.
Гидроксид меди (II) растворяется в аммиаке, образует комплекс, окрашивающий раствор в синий цвет:
Сu(ОН)2 + 4NН3 + 2Н2О → [Сu(NН3)4(Н2О)2](ОН)2
Эта реакция используется для качественной реакции на ионы меди (II).
Соли меди, серебра и золота взаимодействуют с сульфидами щелочных металлов и с водородсульфидом с образованием нерастворимых в воде осадков — Аg2S, Сu2S, СuS, Аu2S3.
Высокое сродство металлов группы IБ к сере определяет большую энергию связи М—S, а это, в свою очередь, обусловливает определенный характер их поведения в биологических системах.
Катионы этих металлов легко взаимодействуют с веществами, в состав которых входят группы, содержащие серу. Например, ионы Аg+ и Сu+ реагируют с дитиоловыми ферментами микроорганизмов по схеме:
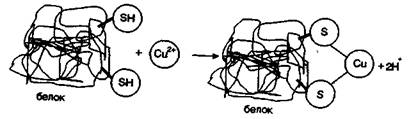
Включение ионов металлов в состав белка инактивирует ферменты, разрушает белки.
Такой же механизм лежит и в основе действия содержащих серебро и золото лекарственных препаратов, применяемых в дерматологии.
Наиболее распространенным соединением золота (III) является хлорид АuСl3, хорошо растворимый в воде.
Оксид и гидроксид золота (III) — амфотерные соединения с более выраженными кислотными свойствами. Гидроксид золота (III) в воде не растворяется, но растворяется в щелочах с образованием гидроксокомплекса:
АuО(ОН) + NаОН + Н2О → Nа[Аu(ОН)4]
Реагирует с кислотами с образованием ацидокомплекса:
АuО(ОН) + 2Н2SО4 → Н[Аu(SО4)2] + 2Н2О
Для золота и его аналогов известно большое число комплексных соединений. Знаменитая реакция растворения золота в «царской водке» (1 объем конц. НМОз и 3 объема конц. НСl) представляет собой образование комплексной кислоты:
Аu + 4НСl + НNО3 → Н[АuСl4] + NO + 2Н2О
В организме медь функционирует в степенях окисления + 1 и +2. Ионы Сu+ и Сu2+ входят в состав «голубых» белков, выделенных из бактерий. Эти белки имеют сходные свойства и называются азуринами.
Медь (I) более прочно связывается с серосодержащими лигандами, а медь (II) с карбоксильными, фенольными, аминогруппами белков. Медь (I) дает комплексы с координационным числом, равным 4. Образуется тетраэдрическая структура (если участвует четное число d-электронов). Для меди (II) координационное число равно 6, ему соответствует орторомбическая геометрия комплекса.






