Электролитическая ионизация обусловлена взаимодействием полярных молекул растворителя с частицами растворенного вещества. Упрощенно, без учета H-связей в воде, этапы электролитической диссоциации представлены на рис. 3.1.
Рисунок 3.1
Этапы электролитической ионизации полярных молекул (а)
и ионных кристаллов (б)

1 - сольватация; 2 - ионизация; 3 - диссоциация.
Подготовительным этапом электролитической диссоциации является сольватация вещества (этап 1). Далее полярные молекулы (например, HCl) поляризуются в силовом поле окружающих их диполей растворителя, и вследствие сильного смещения связывающих электронов связь становится ионной. Происходит ионизация молекулы (этап 2), а затем гетеролитическая диссоциация связи с образованием гидратированных ионов:
HCl(г) + nH2O H+(H2O)x + Cl-(H2O)n-x.
Сольватация вещества наблюдается и при растворении преимущественно ионных кристаллов (например, NaCl) в воде. Взаимодействие с полярными молекулами растворителя способствует ослаблению связей в кристалле и обеспечивает возможность перехода ионов Na и Cl в раствор с образованием гидратированных ионов:
NaCl + nH2O Na+(H2O)x + Cl-(H2O)n-x.
Количество молекул в сольватной оболочке меняется в зависимости от природы иона, температуры и концентрации раствора. Поэтому формулой невозможно точно передать состав сольвата, т.к. он может быть, например, Na+(H2O)6, Na+(H2O)23 и др.
Основные понятия электролитической диссоциации.
По способности вещества распадаться или не распадаться в расплаве или растворе на ионы различают, соответственно, электролиты и неэлектролиты.
Электролиты - это вещества, растворы и расплавы которых проводят электрический ток. К электролитам принадлежат большинство солей и гидроксиды.
Неэлектролиты - это сложные вещества, которые не распадаются на ионы и вследствие чего их растворы и расплавы не проводят электрический ток. К неэлектролитам относят большую часть органических соединений, например, бензол, глюкозу, крахмал (важнейшие исключения: органические кислоты и оранические основания).
К сильным электролитам условно относят вещества, кажущаяся степень диссоциации которых в растворе превышает 30% (ά > 0,3). При ά < 3% (ά < 0,03) электролиты считают слабыми, в других случаях о них говорят как об электролитах средней силы.
Силу электролитов количественно характеризуют степенью диссоциации. Степень диссоциации ( ά ) - это отношение числа распавшихся на ионы молекул (Nдис.) к общему числу молекул растворенного вещества (Nобщ.):
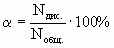
Степень диссоциации выражают в долях единицы или в процентах. Поскольку общее число молекул вещества в растворе пропорционально количеству его вещества и его молярной концентрации, то можно записать:
 ,
,
где nдис. и cдис. - соответственно, количество и молярная концентрация растворенного вещества, подвергшегося электролитической диссоциации;
nобщ. и cобщ. - количество и молярная концентрация вещества в растворе в момент его приготовления.
Электролиты, у которых ά = 1, относят к сильным, у слабых электролитов ά < 1.
Степень диссоциации обычно определяют по данным измерения электропроводности растворов, которая прямо пропорциональна концентрации свободно движущихся ионов. При этом получают не истинные ά, а кажущиеся значения. Они всегда меньше истинных значений ά, т.к. ионы при движении к электродам сталкиваются и частично уменьшают свою подвижность, особенно при высокой их концентрации в растворе, когда возникает электростатическое притяжение между ионами. Например, истинное значение степени электролитической диссоциации HCl в разбавленном растворе равно 1, в 1 М растворе ά = 0,78 (78%) при 180С, однако, в этом растворе не содержится 22% недиссоциированных молекул HCl, практически все молекулы диссоциированы.
Электролиты, которые в разбавленном водном растворе диссоциируют практически полностью, называют сильными электролитами.
К сильным электролитам в водных растворах принадлежат почти все соли, многие неорганические кислоты (H2SO4, HNO3, HClO4, галогеноводородные, кроме HF и др.), гидроксиды s-элементов (исключение - Be(OH)2 и Mg(OH)2). Кажущиеся значения a этих электролитов находятся в пределах от 70 до 100%.
Диссоциация сильных электролитов - это практически необратимый процесс:
HCl → H+ + Cl- или HCl = H+ + Cl-
Электролиты, которые в разбавленном водном растворе диссоциируют частично, называют слабыми. Диссоциация слабых электролитов - обратимый процесс, например:
| ά (при 250 С) | |
| HCN → H+ + CN- | 7·10-5 (или 0,007%) |

| 0,013 (или 1,3%) |
Степень электролитической диссоциации зависит от:
- природы электролита и растворителя;
- концентрации раствора;
- температуры
и возрастает при увеличении разбавления раствора. Степень диссоциации возрастает при увеличении температуры раствора. Если в растворе слабой кислоты или слабого основания увеличить концентрацию одноименного иона введением соответствующей соли, то наблюдается резкое изменение степени диссоциации слабого электролита. Рассмотрим, например, как изменится ά уксусной кислоты (CH3COOH) при введении в раствор ацетата натрия (введение одноименных ионов CH3COO-).
Согласно принципу Ле Шателье равновесие процесса диссоциации
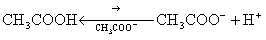
сместится влево в результате увеличения концентрации ацетат-ионов CH3COO-, образующихся при диссоциации ацетата натрия:
CH3COONa → CH3COO- + Na+.
Такое смещение равновесия в сторону молизации CH3COOH означает уменьшение степени ее диссоциации и приводит к уменьшению концентрации ионов водорода.






