В реакцию радикального замещения легче всего вступают атомы водорода при третичном атоме С, затем при вторичном, а сложнее всего разорвать связь С-Н при первичном атоме углерода. Поэтому при бромировании 2-метилбутана преимущественно образуется 2-бром-2-метилбутан:

Реакция нитрования
По механизму радикального замещения протекает реакция нитрования алканов в газовой фазе (реакция Коновалова). Условия – повышенные температура и давление.
В парообразном состоянии азотная кислота разлагается:
2HNO3  2NO2 + ½ O2 + H2O.
2NO2 + ½ O2 + H2O.
Оксид азота (IV) является радикалом ·NO2. Он атакует молекулу алкана.
Итоговая реакция:
СH4 + HNO3 = СН3NO2 + H2O.
Горение алканов
 Горение алканов (рис. 1.) также является радикальной цепной реакцией, но, кроме того – разветвленной. На стадии развития цепи встречаются процессы, приводящие к размножению радикалов (разветвление).
Горение алканов (рис. 1.) также является радикальной цепной реакцией, но, кроме того – разветвленной. На стадии развития цепи встречаются процессы, приводящие к размножению радикалов (разветвление).
Рис. 1. Горение метана
Фрагмент механизма горения метана:
• Инициирование:
RH + O2 = R· + ·HO2 (и др.)
• Развитие цепи:
R· + O2 = ·RO2
·RO2 + RH = ROOH + R·
• Разветвление:
ROOH = RO· + ·OH
ROOH + RH = RO· + R· + H2O
2ROOH = ·RO2 + RO· + H2O
Смесь метана с кислородом (в объёмном соотношении 1:2) или с воздухом (1:10) при поджигании сгорает со взрывом. Поэтому смеси метана, пропана, этана, бутана с воздухом очень опасны. Они иногда могут образоваться в шахтах, в мастерских, в жилых помещениях. С этими газами нужно проявлять осторожность при применении.
Алканы. Химические свойства. Реакции с изменением углеродного скелета. Термический крекинг
Горение алканов
Ранее уже были рассмотрены реакции радикального галогенирования алканов. И было показано, что, для того чтобы алканы вступили в реакцию, к ним нужен дополнительный подвод энергии либо в виде излучения, либо в виде тепла. При обычных условиях алканы не взаимодействуют с кислородом воздуха. Для начала реакции нужно либо открытое пламя, либо хотя бы электрическая искра. Если подвести первоначальную энергию, реакция будет продолжаться самопроизвольно, поскольку она экзотермическая, т.е. в процессе реакции выделяется много энергии.
Рассмотрим эту реакцию на примере горения метана. В смеси газообразных алканов с воздухом обычно взрывоопасны, в довольно широком диапазоне концентрации.
CH4+2O2→CO2+2H2O+Q
Термический крекинг
При нагревании до температуры выше 500оС в молекулах алканов происходит разрыв связей между атомами С, и образуются углеводороды с меньшей молярной массой – алканы и алкены. Нагревание производят без доступа воздуха. Чем выше температура крекинга, тем более легкие углеводороды образуются.
Наиболее энергетически выгоден разрыв молекулы пополам, но связи рвутся и в других местах:
С10Н22→C5Н12+С5Н10;
С10Н22→C4Н10+С6Н12;
С10Н22→C6Н14+С4Н8 и т.д.
Каталитический крекинг
Крекинг чаще проводят, используя катализаторы (обычно алюмосиликаты). Каталитический крекинг протекает при более низких температурах, чем термический.
Наряду с расщеплением углеводородов при каталитическом крекинге происходит перестройка углеродного скелета – изомеризация. В результате образуются углеводороды с более разветвленным скелетом:
CН3–CН2–CН2–CН2–CH2–CH2–CH2–CH2–CH2–CH3 
СН3–СH2–СH2–СH3+ 
Каталитический крекинг углеводородов нефти – один из промышленных способов повышения октанового числа бензина.

Рис. 1. Установка каталитического крекинга
Пиролиз
Увеличивая температуру, можно достичь такой степени разложения углеводорода, когда образуются простые вещества: углерод (в виде сажи) и водород. Такой процесс называют пиролизом:
CH4  С + 2Н2.
С + 2Н2.
Дегидрирование
При пропускании нагретого алкана над платиновым или никелевым катализатором отщепляется водород. В результате получаются алкены.


 + H2
+ H2
Риформинг
Если нагревать алканы с углеродной цепью не менее чем из 6 атомов, над катализатором из платины и алюмосиликатов, то отщепляется водород и образуются ароматические углеводороды – арены. Эту реакцию – риформинг – так же, как и крекинг, используют для получения бензина с высоким октановым числом.
CН3–CН2–CH2–CH2–CH2–CH2-CH3 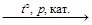
 + 4H2.
+ 4H2.


Рис. 2. Разные катализаторы риформинга.
Конверсия
Конверсия – взаимодействиеалканов (чаще всего используют природный газ) с парами воды при высокой температуре (800–1000°C):
CH4 + H2O  CO + 3H2.
CO + 3H2.
Смесь оксида углерода (II) и водорода – синтез-газ – не разделяют, а используют для получения из нее разных органических веществ.
Алканы. Методы получения и применение. Промышленное получение






