Испарение – это переход части молекул жидкости (воды) из жидкого агрегатного состояния в пар. При испарении необходимо преодолеть силы межмолекулярного сцепления жидкости и силы внешнего давления воздуха на поверхность жидкости. Эта работа совершается за счёт кинетической энергии теплового движения молекул. Поэтому испарение процесс эндотермический. С повышением температуры скорость испарения увеличивается. Процесс испарения является обратимым. Конденсация, т.е. переход молекул из газовой фазы в жидкую, - процесс обратный испарению. Конденсация – процесс экзотермический.
В закрытом сосуде с жидкостью с течением времени при определённой температуре устанавливается равновесие: скорость испарения жидкости равна скорости её конденсации. Пар над жидкостью в состоянии равновесия считают насыщенным при данной температуре. Он производит определённое давление на поверхность жидкой фазы. Это давление насыщенного пара растворителя.
Растворяя небольшое количество какого-нибудь нелетучего вещества в данном растворителе, мы, естественно понижаем концентрацию молекул растворителя в единице объёма раствора. Давление пара таких растворов меньше давления пара растворителей, взятых при той же температуре. Понижение давления пара вызвано тем, что поверхность раствора, в отличие от поверхности растворителя, частично занята молекулами нелетучего растворённого вещества. Это приводит к уменьшению числа молекул растворителя, испаряющихся в единицу времени. Число же молекул растворителя, переходящих из газовой фазы в обратном направлении и оседающих на поверхности раствора, остаётся без изменения, поскольку общая площадь поверхности не изменяется.
Кроме того, следует учитывать силы сольватации взаимодействия между молекулами растворителя и растворённого вещества. Эти силы прочнее сил сцепления молекул растворителя друг с другом, поэтому уменьшается тенденция молекул растворителя к переходу в газовую фазу.
Таким образом, добавление к растворителю любого растворимого в нём нелетучего вещества и образование раствора вызывает нарушение состояния равновесия между растворителем и его насыщенным паром и установление нового равновесия, при котором давление пара раствора будет несколько меньше давления пара растворителя при той же температуре. Следовательно, давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем. При этом понижение давления пара будет тем большим, чем больше концентрация растворённого вещества в растворе.
Если обозначить давление пара растворителя через р0, а давление раствора через р, то разность р0 – р = ∆ р покажет величину понижения давления пара. Отнеся эту разность к давлению пара растворителя, получим так называемое относительное понижение давления пара растворителя:
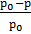 или
или 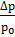
Согласно закону Рауля:
Относительное понижение давления насыщенного пара растворителя равно отношению числа молей растворённого вещества к общему числу молей в растворе (растворённого вещества и растворителя).
Математически это выражается так:
 или
или 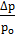 =
= 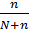
где n, N – количество растворённого вещества и растворителя соответственно.
Отношение 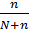 называется мольной долей растворённого вещества, поэтому закон Рауля может быть сформулирован и так:
называется мольной долей растворённого вещества, поэтому закон Рауля может быть сформулирован и так:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества.
Исходя из приведённых уравнений, можно вычислить давление пара раствора р или абсолютное понижение давления пара ∆ р:
р = ро 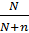 и ∆ p = po
и ∆ p = po 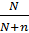
Так как в разбавленных растворах n <<N, то допустимо считать, что
∆ р = ро  .
.
Пример 1
Требуется вычислить давление пара раствора, содержащего при 200С 0,2 моля сахара в 450 г воды. Давление водяного пара при этой температуре равно 2332,75 Па.
Решение. Число молей растворителя N равно 450/18= 25. Подставляем неизвестные величины в формулу
∆ р = ро – р = 2332,75 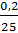 = 18,66 Па,
= 18,66 Па,
Откуда давление пара раствора р = ро - ∆ р =2332,75 – 18,66 = 2314,1 Па
Пример 2
Определить молекулярную массу неэлектролита, если при растворении 17 г его в 450 г воды при 800С давление пара раствора понизилось на 342,3 Па. Давление пара воды при 800С равно 47321,5 Па.
Решение. Заменив в приведённом уравнении n и Nчерез m 1 / М1 и m 2 / М2 соответственно, где m 1, М1 и m 2, М2 – массы и молекулярные массы растворённого вещества и растворителя соответственно получим
∆ р =ро 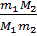 ,откуда М 1 =
,откуда М 1 =  =
=  = 94
= 94
Пример 3
Определить давление насыщенного водяного пара при t= 250C над водным раствором сахарозы, моляльность которого равна 0,2 моль/кг. Давление насыщенного водяного пара над чистой водой при этой температуре равно 23,756 мм. рт. ст.
Решение. Найдём молярную долю воды в растворе. 1 кг воды составит 1000/18 = 55,52 моль. Вычислим молярную долю растворителя в растворе (χ0)
χ0= 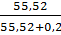 = 0,99641.
= 0,99641.
По закону Рауля:
Р = 23,756 ∙ 0,99641 = 23,671 мм. рт. ст.
Пример
Навеска вещества массой 12,42 г растворена в воде объёмом 500 мл. Давление пара полученного раствора при 200С равно 3732,7 Па. Давление пара воды при той же температуре 3742 Па. Как по этим данным найти М r растворённого вещества?
Решение
Для определения М r надо вычислить n, пользуясь законом Рауля:
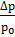 =
=  ,откуда n =
,откуда n = 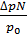 ; так как ∆р = 3742 -3732,7 = 9,3 Па и N =
; так как ∆р = 3742 -3732,7 = 9,3 Па и N = 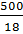 = 27,78 моль, то n =
= 27,78 моль, то n = 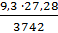 = 0,069 моль. Поскольку n =
= 0,069 моль. Поскольку n = 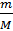 ,то М =
,то М =  =
=  = 180 г/моль и
= 180 г/моль и
М r = 180.
Пример
При 250С давление насыщенного пара воды составляет 3,166 кПа (23,75 мм рт. ст.). Найти при той же температуре давление насыщенного пара над 5% (раствором карбамида (мочевина) СО(NH2)2.
Решение.
Для расчёта по формуле р1 = N 1 ∙ p 0 нужно вычислить мольную долю растворителя N 1. В 100 г раствора содержится 5 г карбамида (М =60,05г/моль) и 95 г воды (М = 18,02 г/моль). Количества воды и карбамида соответственно равны:
n 1 = 95/18,02 = 5,272 моль; n 2 = 5/60,05 = 0,083 моль
Находим мольную долю воды:
N 1 =  =
=  =
= 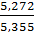 = 0,985
= 0,985
Следовательно,
р 1= 0,985 ∙ 3,119 = 3,119 кПа (или 23,34 мм рт. ст.)






