Используя стандартные окислительно-восстановительные потенциалы определить возможность протекания ОВР между дихроматом калия и соляной кислотой.
В пробирку поместить несколько кристаллов дихромата калия, прилить 1-2 мл концентрированной соляной кислоты и нагреть в пламени спиртовки (ТЯГА!). Что наблюдается? Объясните причину протекания реакции. Написать уравнение реакции пользуясь электронно-ионным методом.
Контрольные вопросы
1. Какие из указанных ниже веществ: Cl2, PbO2, K2Cr2O7, KMnO4, Na2S, KJ, KBr, FeSO4, Na2SO3, NaNO2 - могут проявлять окислительные свойства, какие - востановительные свойства?
2. Рассчитайте DHo, DSo и DGo реакции
2(NH4)2CrO4(тв.) = Cr2O3 (тв.) + 2NH3 (г.)+ N2 (г.)+ 5H2O (г.)
Какова роль энтальпийного и энтропийного факторов протекания этого процесса? Является ли процесс обратимым? Какие элементы изменяют степень окисления и к какому типу ОВР относится данный процесс?
3. Вычислите потенциал системы: а) Fe3+/Fe2+, если активности ионов Fe3+ = 0.1 моль/л, Fe2+ = 5·10-3 моль/л; б) MnO4-/Mn2+ при 1) [H+] = 1 моль/л и 2) [H+] = 1·10-2 моль/л, если [MnO4-]/[Mn2+] = 1.Объясните зависимость потенциала системы MnO4-/Mn2+ от рН среды.
4. Вычислите электродвижущую силу, необходимую для разложения хлорида натрия при 1100 К, если DGо при 1100 К равно 311 кДж/моль.
5. Составьте уравнения реакций, происходящих при электролизе раствора иодида калия на угольных электродах.
6. Пользуясь методом электронно-ионного баланса, закончите составление следующих уравнений окислительно-восстановительных реакций и укажите их тип:
1) KМnO4 + NaNO2 +H2SO4(разб.) ®...
2) NaClO + KJ + H2SO4(разб.) ® NaCl + J2 +...
3) Cl2 +KOH ® KСlO3 +...
4) J2 + Cl2 + H2O ®HJO3 +...
5) NO2 + NaOH ® NaNO2 +...
6) K2Cr2O7 + H2SO4(разб.) + FeSO4 ® Cr2(SO4)3 +...
7) H2S + H2SO3 ® S +...
8) KСlO3 ® O2 +...
9) KСlO3 ® KСlO4 +...
10) HNO2 ® NO +...
11) KМnO4 ® K2MnO4 + MnO2 + O2
12) As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO +...
13) MnO2 + HCl(конц.) ®...
14) Mg + HNO3 ® NH4NO3 +...
15) Cu + HNO3 ® NO +...
16) KJ + H2SO4(конц.) ® J2 + H2S +...
7. Закончите уравнения реакции между следующими ионами, пользуясь методом электронно-ионного баланса:
1) MnO4- + NO2- + H+ ® Mn2+ + NO3- +...
2) Fe3+ + S2- ® S + Fe2+
3) MnO4- + J- + H+ ® Mn2+ + J2
4) ClO- + J- + OH- ® JO3- + Cl- +...
5) MnO4- + SO32- + H+ ® Mn2+ + SO42- +...
6) MnO4- + NO2- + OH- ® Mn2+ + NO3- +...
8. Железная пластинка погружена в раствор CuSO4. После окончания реакции масса пластинки увеличилась на 2 грамма. Найти массу выделившейся из раствора меди.
9. Какую массу сероводорода можно окислить до свободной серы одним граммом йода?
Лабораторная работа № 9
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Основные положения
Комплексными соединениями называются определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии.
Комплексные соединения содержат катионный, анионный или нейтральный комплекс, состоящий из центрального атома или иона и связанных с ним молекул или ионов - лигандов. Центральный атом (комплексообразователь) - обычно акцептор, а лиганды - доноры электронов и при образовании комплекса между ними возникает донорно-акцепторная, или координационная связь. Комплекс может быть электронейтральным (неэлектролит), иметь положительный заряд (комплексный катион) или отрицательный (комплексный анион).
В случае образования комплексного соединения с одноименными лигандами все связи в комплексе равноценны, если он находится в растворе или в газовой фазе, а в случае разнородных лигандов характер связи зависит от их свойств. Число атомов лигандов, координированных центральным атомом, - координационное число (к.ч.) - обычно превышает его степень окисления.
Лиганды, связанные с центральным атомом, образуют внутреннюю координационную сферу комплексного соединения. Анионы или катионы (противоионы), входящие вместе с комплексом в состав комплексного соединения, образуют вторую (внешнюю) сферу.
В зависимости от числа донорных атомов лиганда, способных к координации, различают моно-, би- и полидентатные лиганды. Лиганды, координирующиеся через два и более донорных атомов к одному центральному атому, называются хелатными, а координирующиеся к разным центральным ионам - мостиковыми. Комплексы, в которых лиганды связывают два или более центральных ионов, называются би- или полиядерными. Полиядерные комплексы, имеющие химические связи между центральными атомами, называются кластерами. Комплексные соединения, содержащие циклические комплексы металлов с полидентатными лигандами, в которых центральный атом входит в один или несколько циклов, называются хелатами. Например:

Природа химической связи в комплексных соединениях. В комплексных соединениях - хотя бы одна из связей - донорно- акцепторная, образуется в результате перекрывания заселенных электронами орбиталей лигандов с вакантными орбиталями центрального атома. Если лиганд, как, например, OH-, OR-, NR2-, SR-, O2-, NR2-, имеет дополнительные неподеленные пары электронов, а центральный атом - подходящие вакантные орбитали, то образуются простые дативные связи. Лиганды, у которых есть вакантные орбитали с центральными атомами, имеющими d -электроны (как, например, у PR3, SR2, AsR3), могут образовывать обратные дативные связи p -типа. Оба эффекта приводят к упрочению координационной связи, увеличивая ее кратность.
Природу химической связи в комплексных соединениях объясняют с помощью метода валентных связей, методов молекулярных орбиталей, электростатической теории и ее модификации - теории кристаллического поля.
Изомерия комплексных соединений
Различают изомерию комплексов, при которой состав внутренней сферы и строение координированных лигандов не меняется (геометрическая, оптическая, конформационная, связевая), и изомерию с изменением состава координационной сферы или строения лигандов (ионизационная, гидратная, координационная, лигандная, формальная). Геометрическая изомерия является следствием различного расположения разнородных лигандов во внутренней сфере комплексов. Возможна только для к.ч. 4 и более высоких к.ч.
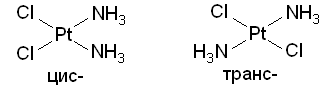
Простейший пример оптически активного комплекса - тетраэдрическая структура, в которой центральный атом окружен четырьмя различными лигандами или двумя несимметричными бидентатными лигандами.
Конформационная изомерия - способность комплексов изменять форму координационного полиэдра, например, переходить из плоской конфигурации в тетраэдрическую.
В случае связевой изомерии изменяется способ связывания монодентатного координированного лиганда, имеющего два или более неэквивалентных донорных центра, во внутренней сфере комплекса при сохранении строения лиганда.
Координационная изомерия заключается в полном или частичном изменении состава комплексных аниона или катиона при сохранении состава комплексных соединений. Например:
[Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6]
Ионизационная изомерия - способность комплексного соединения одного состава давать в растворе различные ионы. Например:
[Pt(NH3)3Br]NO3 и [Pt(NH3)3NO3]Br
Частный случай ионизационной изомерии - сольватная (гидратная) изомерия. Например:
[Cr(H2O)6]Cl3; [Cr(H2O)5Cl]Cl2·H2O; [Cr(H2O)4Cl2]Cl·2H2O
Формальные изомеры - комплексные соединения одинакового состава и молекулярного веса, но отличающиеся по составу лигандов. Например:
[Pt(NH3)(NH2C2H5)Cl2] и [Pt(NH2CH3)2Cl2]
Комплексные соединения в водных растворах
При растворении кристаллического комплексного соединения в воде его кристаллическая решетка разрушается, а координационная сфера и внешнесферные ионы гидратируются водой. Этот процесс протекает по механизму диссоциации сильных электролитов.
Образование и диссоциация координационной сферы комплексных соединений происходит ступенчато:
M + A Û MA K1 = 
MA + A Û MA2 K2 = 

......
MAn-1 + A Û MAn K n = 
Константы К1, К2,..., К n называются ступенчатыми константами образования (устойчивости). Для обозначения полных констант образования используют символ b:
M + A Û MA b 1 = 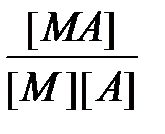
M + 2A Û MA2 b 2 = 
......
M + nA Û MAn b n = 
При этом b n является произведением ступенчатых констант b n =K1 × K2 × ¼ × K n. Константы K n и b n - термодинамические характеристики устойчивости комплекса в растворе. Величины, обратные K n или b n, называются константами диссоциации или нестойкости.
Устойчивость комплексных соединений определяется природой центрального атома и лиганда и стерическими факторами. В соответствии с теорией «жестких» и «мягких» кислот и оснований все центральные атомы могут быть условно разделены на два класса: жесткие кислоты Льюиса и мягкие кислоты Льюиса. Первые имеют малый атомный или ионный радиус и высшую положительную степень окисления, предпочтительно взаимодействующие с неполяризующимися жесткими основаниями, такими как F-, OH-, NR2-. Кислоты второго класса имеют большой атомный или ионный радиус и низкую степень окисления, более эффективно взаимодействуют с легко поляризующимися мягкими лигандами. К жестким кислотам Льюиса относятся центральные ионы элементов в высших степенях окисления, с электронной конфигурацией d0 или d10. Мягкие кислоты Льюиса имеют электроны на d -орбиталях, способные к образованию p -связей в результате перекрывания с вакантными d -орбиталями мягких лигандов. С увеличением основных свойств лигандов устойчивость комплексов повышается.
Комплексы хелатообразующих реагентов по сравнению с комплексами их монодентантных аналогов обладают повышенной устойчивостью (так называемый хелатный эффект).
Присоединение объемного заместителя к донорному атому или вблизи него, например, замена атома водорода на алкильную группу, приводит под влиянием стерических факторов к уменьшению стабильности комплекса, напротив, введение алкильных групп в другие положения, вследствие увеличения основности лигандов, повышает стабильность комплексов.
На стабильность комплексов оказывает влияние и природа донорного атома лигандов. В случае «жестких» центральных атомов уменьшение размера донорных атомов лиганда и повышение его электронной плотности приводит к увеличению стабильности комплексов. Например, стабильность комплексов падает в рядах F > Cl > Br > J или O > S > Se > Te. В случае «мягких» центральных ионов наблюдается обратная тенденция: F < Cl < Br < J.
Экспериментальная часть






