а) Образование осадков. Налить в пробирку по 1-2 мл раствора хлорида кальция и добавить равный объем раствора сульфата натрия. Наблюдается ли выпадение осадка?
В два стаканчика налейте по 1-2 капли исходных растворов и разбавьте 100-кратным количеством дистиллированной воды. Испытайте в пробирке, будет ли образовываться осадок при смешении этих растворов. При необходимости, процесс разбавления и испытания повторите еще раз.
Напишите ионное уравнение обратимой реакции, протекающей при образовании и осадка, выражение для константы равновесия этой реакции, учтя ее гетерогенность, и ее значение (справочник). Используя это значение, оцените, при какой минимальной концентрации исходных растворов можно ожидать выпадение осадка.
б) Сравнение растворимости. В две пробирки налейте по 1-2 мл раствора соли свинца, добавьте в одну из них раствор йодида калия, в другую – такой же объем раствора хлорида калия. Отметьте цвет и количество выпавшего осадка.
Напишите молекулярные и ионные уравнения реакций, учтя их обратимость, выражения для произведений растворимости соответствующих солей и их значения (справочник). Используя значения ПР, объясните различия в протекании опытов.
в) Растворение осадков. В пробирку налить 1-2 мл раствора оксалата натрия и прилить равный объем раствора хлорида кальция. Что наблюдается? Разделить полученный осадок на две пробирки и испытать на растворимость в соляной и уксусной кислотах. Объяснить наблюдаемые явления, пользуясь значениями констант диссоциации соответствующих кислот и произведения растворимости оксалата кальция. Какова величина константы равновесия суммарного процесса в первом и во втором случае?
г) Малорастворимые соединения в реакциях обмена. В пробирке смешать равные объемы (1-2 мл) растворов нитрата свинца и сульфата натрия. Дать осадку отстояться и слить большую часть раствора (декантация). Используя прием декантации промыть осадок дистиллированной водой. Отметить цвет осадка.
К чистому осадку в пробирке добавить 0,5 мл раствора сульфида аммония и хорошо перемешать стеклянной палочкой. Как изменился цвет осадка? Снова отделить и промыть осадок декантацией, после чего добавить к нему раствор сульфата натрия. Происходит ли обратное изменение цвета осадка?
Написать ионные уравнения реакций, учитывая их обратимость. Пользуясь величинами произведения растворимости солей, объяснить переход одного осадка в другой.
Общий вывод к работе: С какими видами равновесий в растворах электролитов Вы ознакомились? Как называются константы этих равновесий? Какие еще равновесия могут устанавливаться в растворах электролитов?
Контрольные вопросы
1. Чем объясняется различная электропроводность водного и спиртового растворов одной и той же соли при равенстве концентраций?
2. От каких факторов зависит степень электролитической диссоциации? Как ее увеличить? Как уменьшить?
3. Почему для характеристики диссоциации сильных электролитов применяют термин «кажущаяся степень диссоциации»?
4. Как уменьшить концентрацию ионов водорода в растворе соляной кислоты?
5. Написать уравнения диссоциации сернистой и мышьяковой кислот и выразить в общем виде их константы диссоциации.
6. Вычислить константу диссоциации уксусной кислоты, если ее степень диссоциации в 0,1Н растворе равна 1,32 %.
7. В каком растворе и во сколько раз содержится больше ионов водорода: в 1 л 0,1Н раствора CH3COOH или в 2 л 0,1Н раствора HCN?
8. Удельная электропроводность 0,6Н раствора бинарного электролита равна 0,069, а эквивалентная электропроводность при предельном разбавлении равна 129,6. Вычислить степень диссоциации электролита.
9. Вычислить концентрацию гидроксид-ионов в растворе хлорной кислоты, содержащем 2,5·10-3 моль/л HClO4 при 298 К. Изменится ли эта концентрация при нагревании раствора до 373 К?
10. В 0,1Н растворах степень диссоциации щавелевой кислоты равна 31%, а соляной 92%. При какой концентрации раствора степень диссоциации щавелевой кислоты достигнет степени диссоциации соляной кислоты?
11. Вычислить концентрации ионов водорода в растворе муравьиной кислоты, если она диссоциирована в нем на 10%. Константа диссоциации равна 2·10-4.
12. Вычислить рН 3,6%-ного раствора HCl с учетом и без учета коэффициентов активностей (fHCl=0,809).
13. Вычислить ионную силу раствора, содержащего в 1 л 0,2 моль KCl и 0,1 моль Al2(SO4)3.
14. Написать молекулярные и ионные уравнения растворения в соляной кислоте следующих малорастворимых в воде веществ: а) Cr(OH)3; б) Zn(OH)2.
15. Смешаны растворы веществ: а) Na2CO3 и BaCl2; б) FeSO4 и (NH4)2S. Составить молекулярные и ионные уравнения реакций взаимодействия этих веществ.
16. Найти активности ионов К+ и Cl- в 0,01М растворе хлорида калия.
17. Во сколько раз уменьшится активность иона Na+ в 0,001М растворе хлорида натрия, если к 1 л этого раствора прибавить 0,01 моля соли сульфата алюминия?
18. Вычислить процент гидролиза NaHS в 0,01Н растворе.
19. Вычислить степень гидролиза цианида калия при концентрациях 0,1 и 0,001Н, если константа диссоциации HCN равна 7,2·10-10.
20. Написать ионные и молекулярные уравнения гидролиза солей: а) (NH4)2CO3; б) Na3PO4; в) FeCl3; г) CuSO4.
21. Написать уравнения следующих реакций (с учетом возможности необратимого гидролиза образующихся солей):
а) Fe2(SO4)3 + K2CO3 ®
б) Al2(SO4)3 + (NH4)2S ®
Лабораторная работа № 8
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Степень окисления. Окислители и восстановители
Окислительно-восстановительными называются реакции, сопровождающиеся изменением степеней окисления атомов, входящих в состав реагирующих веществ. Степень окисления — это условный заряд атома в соединении, вычисленный из предположения, что все связи в соединении являются чисто ионными, а само соединение состоит из ионов.
Поскольку чисто ионных связей не существует, действительные (эффективные) заряды атомов в соединениях часто сильно отличаются по числовым значениям от степеней окисления. Однако понятие «степень окисления» очень полезно для классификации веществ и нахождения стехиометрических коэффициентов уравнений химических реакций.
Если в результате реакции степень окисления атома увеличивается, то говорят, что он окисляется. Примерами окисления служат процессы:
Fe2+ -  ® Fe3+
® Fe3+
2I- - 2  ® I2
® I2
Mn2+ +4H2O - 5  ® MnO4- + 8H+
® MnO4- + 8H+
Из них видно, что окисление связано с отщеплением — потерей — электронов.
Если же в результате реакции степень окисления атома уменьшается, то говорят, что он восстанавливается.
В качестве примеров восстановления могут служить процессы, обратные записанным выше:
Fe3+ +  ® Fe2+
® Fe2+
I2 + 2  ® 2I-
® 2I-
MnO4- + 8H+ + 5  ® Mn2+ +4H2O
® Mn2+ +4H2O
Из них видно, что восстановление связано с присоединением электронов восстанавливающимся атомом.
Окисление — это отдача электронов, восстановление — присоединение электронов.
Атом, молекула или ион, принимающие электроны, называются окислителями. Атом, молекула или ион, отдающие электроны, называются восстановителями.
Понятие «окислитель» и «восстановитель» часто используют как совершенно однозначные характеристики окислительно-восстановительных свойств соединений. В действительности эти понятия относительны.
Так, например, молекулярный водород в огромном числе реакций используется как восстановитель. К числу таких реакций относятся:
CuO + H2  Cu + H2O
Cu + H2O
CH3COН + H2  CH3CH2OH
CH3CH2OH
Но в реакциях образования гидридов щелочных и щелочноземельных металлов тот же водород играет роль окислителя:
2Na + H2 ® 2NaH
Целесообразно запомнить важнейшие окислители и восстановители. К важнейшим окислителям относятся:
1) свободные неметаллы (галогены, кислород, сера), которые в результате реакций превращаются в одноатомные анионы;
2) кислородсодержащие ионы и молекулы, в которых центральный атом имеет высшую или высокую степень окисления (MnO4-, Cr2O72-, CrO42-, NO3-, ClO3-);
3) одноатомные катионы, в которых элементы проявляют свою высшую степень окисления (Ce4+, Fe3+, Ag+, H+).
Важнейшими восстановителями являются:
1. свободные металлы, а из неметаллов – углерод и водород;
2. многоатомные ионы и молекулы, в которых центральный атом имеет низшую или низкую степень окисления (H2S, NH3, SO32-, NO2-, CrO2-);
3. одноатомные ионы, в которых элементы проявляют низшую или низкую степень окисления (I-, S2-, Sn2+, Fe2+).
Таким образом, вещества, содержащие атомы в высших степенях окисления, могут быть только окислителями, т.е. только принимать электроны. Вещества, содержащие атомы в низших степенях окисления, могут быть только восстановителями, т.е. только отдавать электроны. Вещества, содержащие атомы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями.
Все окислительно-восстановительные реакции можно разделить на следующие четыре группы:
1. Реакции межмолекулярного окисления-восстановления — реакции, в которых окислитель и восстановитель — разные вещества, причем эти вещества могут быть как сложными, так и простыми:
2Mg + O2 = 2MgO
4NH3 + O2 = 2N2 + 6H2O
2. Реакции внутримолекулярного окисления-восстановления — реакции, которые протекают с изменением степеней окисления атомов одного и того же соединения:
2КClO3  2КСl + 3O2
2КСl + 3O2
NH4NO2  N2 + 2Н2O
N2 + 2Н2O
3. Реакции диспропорционирования (реакции самоокисления-самовосстановления), — реакции в которых происходит одновременное увеличение и уменьшение степени окисления атомов одного и того же элемента. Реакции диспропорционирования возможны для веществ, содержащих атомы с промежуточной степенью окисления:
4КClO3  3KClO4 + КСl
3KClO4 + КСl
В этой реакции хлор из промежуточной степени окисления +5 окисляется до степени окисления +7 и восстанавливается до степени окисления –1.
4. Реакции компропорционирования — реакции, в которых участвуют два вещества, содержащих атомы одного и того же элемента в разных степенях окисления. В результате реакций компропорционирования получается вещество, содержащее атомы того же элемента в промежуточной степени окисления:
Cu + CuCl2 = 2CuCl
Составление уравнений окислительно-восстановительных реакций
Для реакций, не связанных с изменением степеней окисления элементов, характерны небольшие стехиометрические коэффициенты, нахождение которых обычно не вызывает трудностей. Напротив, реакции окисления-восстановления часто имеют сложную стехиометрию. Примером может служить окисление минерала пирита FeS2 кислородом:
4FeS2 + 11O2 = 2Fe2O3 + 8 SO2
Поэтому нахождение стехиометрических коэффициентов реакций окисления-восстановления часто оказывается непростой задачей, которую решают с применением специально разработанных приемов. Рассмотрим метод полуреакций, обычно применяемый к реакциям в водных растворах.
Ключевая задача этого метода — составление уравнений полуреакций. При использовании этого метода каждая окислительно-восстановительная реакция представляется как алгебраическая сумма двух полуреакций: полуреакции восстановления окислителя и полуреакции окисления восстановителя. Составляя уравнения полуреакций, используют те же правила, что и при составлении обычных ионных реакций в растворах: для неэлектролитов и слабых электролитов записывают формулы их молекул, а для сильных электролитов — формулы только тех ионов, в состав которых входят атомы элементов, изменяющих в результате реакции степени окисления. От обычных ионных уравнений уравнения полуреакций отличаются наличием в них символов электронов.
Уравнения многих полуреакций очень просты. В них присутствуют всего три вида частиц: электроны и две формы соединений одного и того же элемента:
Cu2+ +  Û Cu+
Û Cu+
Br2 + 2  Û 2Br-
Û 2Br-
MnO4- +  Û MnO42-
Û MnO42-
Одна из них — окисленная форма — содержит атомы элемента в более высокой степени окисления. В приведенных примерах окисленными формами являются Си2+, Вг2 и MnO4-. Другая — восстановленная форма — содержит атомы этого же элемента в более низкой степени окисления. В приведенных примерах восстановленные формы — это Си+, Вг- и MnO42-.
Немного сложнее уравнения полуреакции типа:
PbSO4 + 2  Û Pb + SO42-
Û Pb + SO42-
[Cu(NH3)4]2+ + 2  Û Cu + 4NH3
Û Cu + 4NH3
В этих полуреакциях наряду с атомами элементов, изменяющих степени окисления, присутствуют сульфат-ионы SO42- и молекулы NH3, все атомы которых сохраняют постоянные степени окисления, а сами эти ионы и молекулы имеют одинаковый состав в левой и правой частях уравнения.
Сложнее других полуреакции с участием кислородсодержащих анионов (оксоанионов) типа NO3-, MnO4-, Cr2O72-. В результате восстановления оксоанионы могут терять все входящие в их состав атомы кислорода или часть этих атомов. Например, перманганат-ион в результате восстановления в кислой среде превращается в катион Mn2+, теряя четыре атома кислорода. При восстановлении перманганат-иона в нейтральной и слабощелочной среде образуется оксид марганца (IV) MnO2, в ходе этой реакции MnO4- отдает два атома кислорода.
Составляя полуреакции восстановления оксоанионов, принимают, что атомы кислорода в оксоанионах имеют формальную степень окисления -2, хотя даже в ионных кристаллах оксидов щелочных и щелочноземельных металлов действительный заряд оксид-анионов O2- не достигает этого значения. В соответствии со степенью окисления -2 предполагают, что атомы кислорода, отщепляющиеся от оксоанионов, реагируют с водой так же, как оксид-анионы, попадающие в раствор при разрушении кристаллических решеток ионных оксидов:
Na2O + H2O ® 2Na+ + 2OH-
т.е. предполагают, что при взаимодействии одного иона O2-с молекулой воды образуются два иона ОН-:
O2- + H2O ® 2OH-
В соответствии с этим предположением полуреакцию восстановления перманганат-иона в нейтральной среде можно записать так:
MnO4- + 2H2O + 3  Û MnO2 + 4OH-
Û MnO2 + 4OH-
При разрушении оксоанионов в кислой среде, где имеется избыток катионов Н+, образуются не гидроксид-ионы, а молекулы воды:
MnO4- + 8Н+ + 5  Û Mn2+ + 4 H2O
Û Mn2+ + 4 H2O
Для связывания одного атома кислорода в степени окисления -2 при этом расходуются два катиона Н+.
Полуреакции, составленные с использованием описанных приемов, приведены в справочниках, где они записаны как полуреакции восстановления, т.е. в левой части уравнения — окисленная форма, а в правой — восстановленная. Это сделано для того, чтобы не повторять в таблицах одну полуреакцию дважды, сначала как полуреакцию окисления, а затем как полуреакцию восстановления.
Как же, используя полуреакции, составить уравнение реакции окисления — восстановления? Рассмотрим процесс составления уравнения на примере реакции между перманганатом калия КMnO4 и сульфитом натрия Na2SO3 в присутствии H2SO4.
Прежде чем приступить к составлению уравнений, следует определить, какую роль играют каждая молекула и ион в данной реакции, т.е. назвать окислитель и восстановитель, а также те молекулы и ионы, атомы которых не изменяют степеней окисления. Если хотя бы одно из веществ, участвующих в реакции, содержит атом в высшей или низшей возможной для данного элемента степени окисления, то предсказать роль этого вещества можно, пользуясь перечнем, приведенным выше. Если оба вещества, участвующих в реакции, содержат атомы в промежуточных степенях окисления, то определить, какое из веществ будет окислителем, а какое — восстановителем, можно с помощью стандартных окислительно-восстановительных потенциалов.
В рассматриваемом примере перманганат калия содержит марганец в высшей степени окисления +7, и поэтому он может играть только роль окислителя. Сульфит натрия содержит серу в промежуточной степени окисления +4 и может быть и окислителем, и восстановителем. В данном случае в присутствии сильного окислителя — перманганата калия — сульфит натрия является восстановителем. Разбавленная серная кислота окислительно-восстановительными свойствами не обладает. Она играет роль источника ионов водорода, т. е. обеспечивает кислую реакцию среды.
После этого следует составить или найти в справочнике нужные уравнения полуреакций, а затем получить их алгебраическую сумму. Для этого обе полуреакции нужно записать одну под другой. Причем ту полуреакцию, которая описывает восстановление окислителя, следует привести в табличной форме, а вторую полуреакцию нужно преобразовать: перенести все члены уравнения из левой части в правую и наоборот так, чтобы она превратилась в полуреакцию окисления восстановителя. Перед сложением надо все члены уравнения первой полуреакции умножить на число электронов, отдаваемых восстановителем во второй полуреакции, а все члены второй полуреакции следует умножить на число электронов, присоединяемых окислителем в первой полуреакции. После этого все члены левых и правых частей уравнения полуреакций суммируются. Таким образом, получается уравнение реакции окисления — восстановления в сокращенной ионной форме.
Для рассматриваемой реакции окисления сульфита натрия перманганатом калия в кислой среде уравнение полуреакции восстановления MnO4- и уравнение полуреакции окисления SO32- запишутся следующим образом:
MnO4- + 8H+ + 5  Û Mn2+ + 4H2O ½ 2 (восстановление)
Û Mn2+ + 4H2O ½ 2 (восстановление)
SO32- + H2O - 2  Û SO42- + 2H+ ½ 5 (окисление)
Û SO42- + 2H+ ½ 5 (окисление)
2MnO4- + 16H+ + 5SO32- + 5H2O Û 2Mn2+ + 8H2O + 5SO42- +10H+
Справа от вертикальной черты записываем множители — числа электронов. После приведения однородных членов уравнения (катионы H+, молекулы H2O) получаем сокращенное ионное уравнение реакции окисления сульфита натрия перманганатом калия в кислой среде:
2MnO4- + 6H+ + 5SO32- Û 2Mn2+ + 3H2O + 5SO42-
Для получения молекулярной формы уравнения каждому иону добавляем определенное число противоионов, необходимое для полной нейтрализации заряда иона. Объединяя ионы в формулы молекул, получаем уравнение в молекулярной форме:
2KMnO4+5Na2SO3+3H2SO4Û 2MnSO4+3H2O+5Na2SO42-+K2SO4
Окислительно-восстановительные (электродные) потенциалы
Особенностью всех полуреакций является участие электронов. Электроны могут выступать в качестве химических реагентов и продуктов, а полуреакции, которые до сих пор рассматривались только как прием для расчета стехиометрических коэффициентов, часто используют в устройствах, называемых гальваническими полуэлементами или электродами.
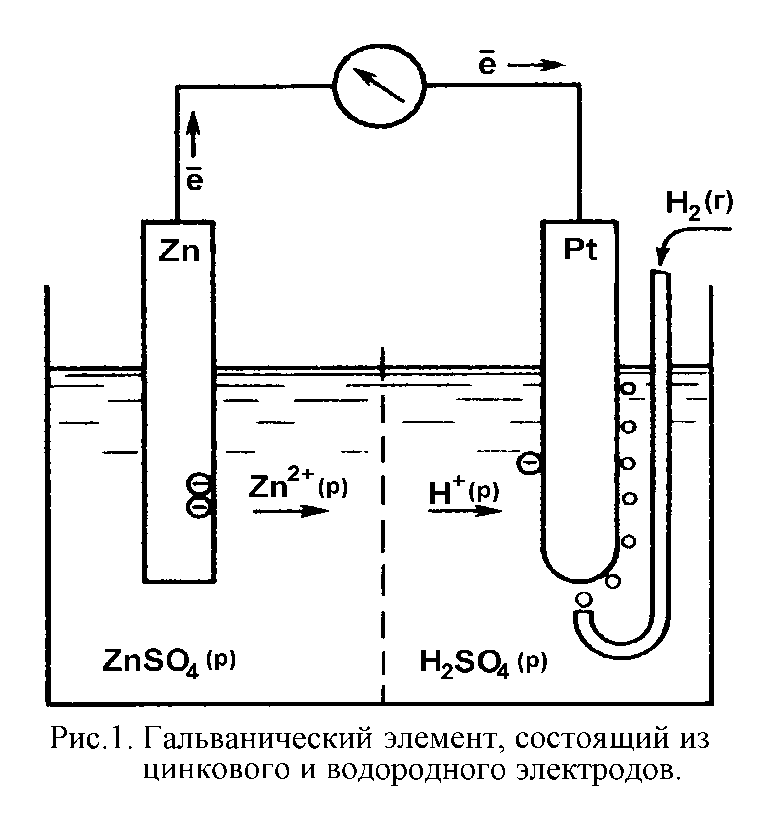 Самый простой электрод состоит из металлической пластинки и раствора, содержащего гидратированные катионы этого металла. Примером такого электрода может служить пластинка из кристаллического цинка, погруженная в раствор сульфата цинка (рис. 1). После погружения пластинки в раствор на ее поверхности происходят два взаимно противоположных процесса: атомы кристаллического цинка теряют электроны и переходят в раствор:
Самый простой электрод состоит из металлической пластинки и раствора, содержащего гидратированные катионы этого металла. Примером такого электрода может служить пластинка из кристаллического цинка, погруженная в раствор сульфата цинка (рис. 1). После погружения пластинки в раствор на ее поверхности происходят два взаимно противоположных процесса: атомы кристаллического цинка теряют электроны и переходят в раствор:
Zno - 2  ® Zn2+
® Zn2+
а катионы цинка осаждаются на поверхности кристаллов пластинки и приобретают электроны, превращаясь в атомы:
Zn2+ + 2  ® Zno
® Zno
В результате первого процесса пластинка приобретает отрицательный заряд, так как электроны, первоначально уравновешивавшие заряд катионов, остаются в кристаллической решетке пластинки. По мере того как число переходящих в раствор катионов увеличивается, отрицательный заряд пластинки возрастает. Увеличение отрицательного заряда пластинки замедляет переход катионов в раствор и ускоряет их осаждение из раствора. Через некоторое время после погружения пластинки в раствор скорости обеих реакций выравниваются, наступает равновесие, описываемое уравнением:
Zn2+ + 2  Û Zno,
Û Zno,
а пластинка приобретает некоторый электрический потенциал. Абсолютное значение потенциала одного, отдельно взятого электрода измерить нельзя. Оценить числовое значение этого потенциала можно только путем измерения разности потенциалов между рассматриваемым электродом и каким-то другим электродом, потенциал которого известен. В соответствии с международным соглашением электродные потенциалы отсчитывают относительно потенциала стандартного водородного электрода.
Водородный электрод представляет собой более сложное устройство, чем цинковый. Для его изготовления платиновую пластинку погружают в водный раствор серной кислоты, через который пропускают газообразный водород (рис. 1). На поверхности платиновой пластинки устанавливается равновесие:
2H+ + 2  Û H2
Û H2
Это равновесие устанавливается потому, что молекулярный водород растворяется в металлической платине с диссоциацией на атомы и протоны с переходом части электронов в кристаллическую решетку самой платины. Поскольку в реакции, определяющей потенциал водородного электрода, участвуют катионы Н+ и газообразный водород, его потенциал определяется как активностью (концентрацией) катионов Н+ в растворе H2SO4, так и давлением газообразного водорода. Если  в растворе равна 1 моль/л, а давление газообразного водорода равно 101,3 кПа, такой электрод называют стандартным водородным электродом. Потенциал стандартного водородного электрода принят равным 0 (нулю) при всех температурах.
в растворе равна 1 моль/л, а давление газообразного водорода равно 101,3 кПа, такой электрод называют стандартным водородным электродом. Потенциал стандартного водородного электрода принят равным 0 (нулю) при всех температурах.
Цинковый электрод можно соединить с водородным так, как это показано на рис. 1, и получить гальванический элемент. На цинковом электроде этого элемента будет проходить полуреакция окисления металлического цинка:
Zno - 2  Û Zn2+
Û Zn2+
Катионы цинка будут уходить в раствор, а цинковая пластинка в результате накопления электронов приобретет отрицательный заряд. Появление отрицательного заряда заставит электроны переходить по внешней электрической цепи на платиновую пластину водородного полуэлемента. Получив электроны, платиновая пластина превратится в их источник и на ней будет проходить полуреакция восстановления гидратированных протонов:
2H+ + 2  Û H2
Û H2
Из-за этого в растворе H2SO4 водородного электрода будут накапливаться избыточные анионы SO42-. Эти избыточные анионы будут переходить в раствор ZnSO4 цинкового электрода сквозь разделяющую растворы мембрану, а им навстречу будут двигаться избыточные катионы Zn2+.
Если измерить электродвижущую силу ЭДС этого элемента при стандартных условиях (Т = 298,15 К,  = 101,3 кПа,
= 101,3 кПа,  = 1 моль/л,
= 1 моль/л,  = 1 моль/л), то окажется, что ЭДС = - 0,763 В, т.е. будет измерен стандартный электродный потенциал цинкового электрода
= 1 моль/л), то окажется, что ЭДС = - 0,763 В, т.е. будет измерен стандартный электродный потенциал цинкового электрода  .
.
Рассмотрим суммарную реакцию, происходящую в гальваническом элементе, который состоит из цинкового и водородного полуэлементов. Она есть результат сложения полуреакций этих полуэлементов - электродов:
Zn - 2  Û Zn2+
Û Zn2+
2H+ + 2  Û H2
Û H2
Zn + 2H+ = Zn2+ + H2
Таким образом, эта реакция является окислительно-восстановительной реакцией растворения металлического цинка в водных растворах кислот.
Заменим стандартный цинковый электрод на стандартный медный электрод, т.е. на аналогичное устройство, в котором вместо цинковой пластины взята медная, а вместо 1 М раствора ZnSO4 — 1 М раствор CuSO4. Соединив медный электрод со стандартным водородным, получим новый гальванический элемент. В его полуэлементах будут проходит иные реакции: в водородном полуэлементе — полуреакция окисления Н2 с получением гидратированных протонов:
Н2 - 2  Û 2Н+
Û 2Н+
а в медном — полуреакция восстановления гидратированных катионов Сu2+ в металлическую медь:
Сu2+ + 2  Û Сuo
Û Сuo
Измерение ЭДС этого элемента позволяет определить стандартный потенциал медного электрода  = +0,337 В. Суммирование полуреакций дает реакцию восстановления катиона Cu2+ газообразным Н2 до металлической меди:
= +0,337 В. Суммирование полуреакций дает реакцию восстановления катиона Cu2+ газообразным Н2 до металлической меди:
Cu2+ + H2 = Cu + 2H+
Отличие медного электрода от цинкового состоит в том, что его стандартный потенциал положителен, а у цинкового электрода — отрицателен.
Если составить гальванический элемент из цинкового и медного электродов, то происходящую в нем реакцию можно представить как сумму полуреакций:
Zn - 2  Û Zn2+
Û Zn2+
Сu2+ + 2  Û Сuo
Û Сuo
Zn + Сu2+ Û Zn2+ + Сuo
Электродвижущая сила этого элемента равна разности  -
-  = 0,337 - (-0,763) = 1,100 В. Значит, ЭДС гальванических элементов (окислительно-восстановительных реакций) можно вычислять, вычитая из алгебраически большего стандартного потенциала алгебраически меньший стандартный потенциал. Другими словами:
= 0,337 - (-0,763) = 1,100 В. Значит, ЭДС гальванических элементов (окислительно-восстановительных реакций) можно вычислять, вычитая из алгебраически большего стандартного потенциала алгебраически меньший стандартный потенциал. Другими словами:
Электродвижущая сила окислительно-восстановительной реакции в стандартных условиях равна разности стандартных окислительно-восстановительных (электродных) потенциалов окислителя и восстановителя:

В рассматриваемом гальваническом элементе, составленном из медного и цинкового электродов, катионы меди играют роль окислителя, а металлический цинк — восстановителя.
Если расположить все металлы в порядке возрастания числовых значений Е°, то образуется ряд стандартных электродных потенциалов металлов, известный также под более кратким названием ряда напряжений металлов.
Стандартные электродные потенциалы Е° являются количественными характеристиками систем, состоящих из кристаллического металла и гидратированных катионов в водном растворе. Применение значений Е° для расчета ЭДС гальванических элементов уже было продемонстрировано. Среди металлов электрод Li/Li+ обладает самым большим отрицательным потенциалом. Другими словами, металлический литий будет самым сильным восстановителем, если в результате реакции образуются гидратированные катионы Li+. Электрод Au/Au3+ имеет самый большой положительный потенциал: это говорит о том, что, восстанавливаясь до металла, катион Au3+ является самым сильным окислителем из всех катионов. Все металлы с отрицательными значениями Е° растворяются в кислотах с выделением водорода Все металлы с положительными Е° - не растворяются. Каждый из металлов, обладающих меньшим значением Е°, способен восстанавливать до кристаллического состояния катионы любого другого металла, имеющего большее значение, если эта реакция не тормозится поверхностными пленками типа пленки Al2O3, покрывающей металлический алюминий.
Уравнение Нернста, направление протекания окислительно-восстановительных реакций в растворах и константы их равновесия
Участие электронов в протекании полуреакций кажется естественным только при наличии металлов, в которых существует «электронный газ». Между тем существует огромное число реакций окисления — восстановления, которые протекают в водных растворах между гидратированными ионами или между ионами и молекулами. Более того, эти реакции можно проводить как сумму двух полуреакций, проходящих в полуэлементах-электродах, соединенных в гальванический элемент. Следовательно, и для таких реакций участие в них электронов является физической реальностью.
В качестве примера рассмотрим реакцию
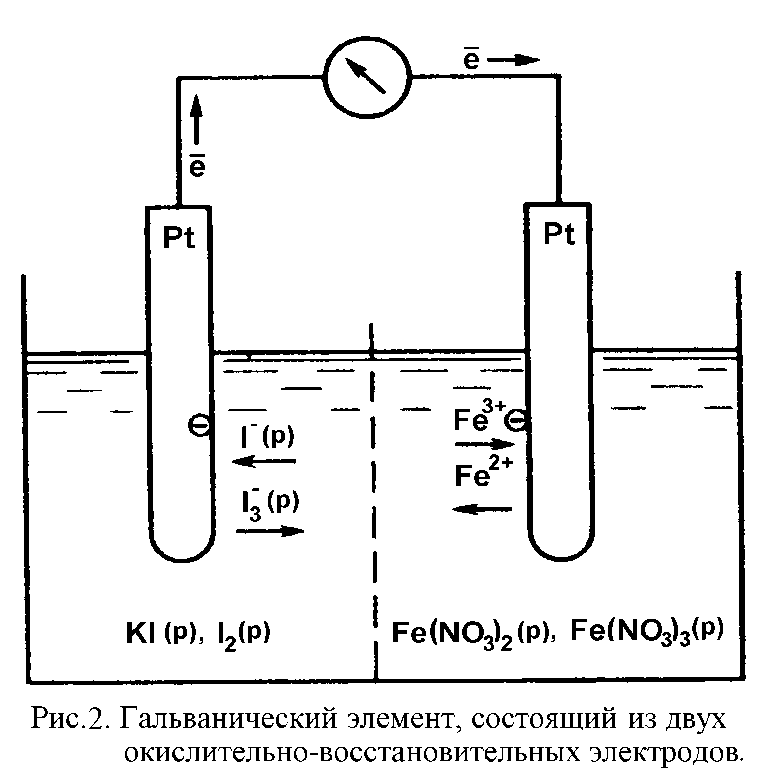
Fe3+ + I- Û Fe2+ +  I2
I2
Ее можно реализовать с помощью гальванического элемента, состоящего из двух полуэлементов - электродов (рис. 2), в которых протекают полуреакции:
Fe3+ +  Û Fe2+
Û Fe2+
I- -  Û
Û  I2
I2
Полуреакция окисления иодид-ионов записана упрощенно. В присутствии избытка I- молекулы I2 образуют растворимые в воде анионы I3-.
Как видно из рис. 2, устройство обоих электродов, служащих для раздельного проведения этих полуреакций, почти такое же, как и у водородного электрода. В водные растворы погружены платиновые пластины, которые служат в качестве сборника электронов в левом полуэлементе и источника электронов в правом.
 Следовательно, реакции окисления — восстановления, проходящие в растворах, можно рассматривать как суммы или разности полуреакций, имеющих совершенно определенные значения Е°.
Следовательно, реакции окисления — восстановления, проходящие в растворах, можно рассматривать как суммы или разности полуреакций, имеющих совершенно определенные значения Е°.
Для установления количественной связи между ЭДС гальванического элемента и константой равновесия протекающей в нем реакции служит уравнение Нернста. Оно выражает зависимость электродного потенциала от активностей потенциалопределяющих веществ полуреакций:

где Е — окислительно-восстановительный электродный потенциал при произвольных условиях; Е° — стандартный электродный потенциал (табличная величина); R — универсальная газовая постоянная; Т — абсолютная температура; п — число электронов, принимаемых окисленной формой при превращении ее в восстановленную форму; F — постоянная Фарадея; Паокисл. — произведение активностей окисленной формы и всех ионов и молекул, записываемых в уравнении вместе с этой формой в левой части полуреакции; Павосст. — произведение активностей восстановленной формы и всех ионов и молекул, записываемых в уравнении полуреакции вместе с этой формой в правой части полуреакции.
После подстановки числовых значений констант R, F и Т= 298,15 К и в результате замены натурального логарифма на десятичный уравнение Нернста принимает вид

Использование уравнения Нернста позволяет вычислять ЭДС гальванического элемента не только в стандартных условиях в соответствии с вышеприведенным, но и тогда, когда активности веществ, оказывающих влияние на электродный потенциал, не равны единице.
Например, ЭДС гальванического элемента, изображенного на рис. 2, можно вычислить как разность электродного потенциала  электрода, в котором окисленной формой являются катионы Fe3+, а восстановленной — катионы Fe2+, и электродного потенциала
электрода, в котором окисленной формой являются катионы Fe3+, а восстановленной — катионы Fe2+, и электродного потенциала  — электрода, в котором окисленной формой являются молекулы I2, а восстановленной — иодид-ионы I-:
— электрода, в котором окисленной формой являются молекулы I2, а восстановленной — иодид-ионы I-:
ЭДС =  -
- 
После подстановки в это уравнение выражений, полученных на основании уравнения Нернста и иллюстрирующих зависимость электродных потенциалов от активностей потенциалопределяющих частиц, получаем
ЭДС = 
Значение D Ео = 0,771 – 0,536 = 0,235 В.
При достижении состояния равновесия активности реагентов и продуктов реакции приобретут равновесные значения, а ЭДС гальванического элемента станет равной нулю:

Выражение, стоящее под знаком логарифма, при этом станет равной величине, обратной константе равновесия:


или

В общем случае, когда в реакции принимает участие п электронов, из аналогичных уравнений получается уравнение:
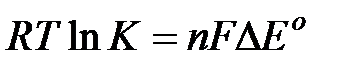
из которого видно, что константа равновесия может быть больше, чем единица, только при D Е° > 0.
Pеакции окисления — восстановления протекают слева направо только тогда, когда ЭДС гальванического элемента, образованного из полуэлементов-электродов, является положительной величиной.
Такой гальванический элемент может совершать работу. Это заключение находится в соответствии со вторым законом термодинамики, согласно которому самопроизвольно протекают лишь реакции, имеющие отрицательные DG. Между ЭДС (D Е°) гальванических элементов, DGреакции и константой равновесия К существует следующая взаимосвязь:

Эту взаимозависимость часто используют для точных электрохимических определений K и DG окислительно-восстановительных реакций,.так как значения D Е° можно измерять с высокой точностью.
Результаты расчета D G реакции и констант равновесия, полученные при использовании стандартных электродных потенциалов, применимы не только к процессам в гальванических элементах, но и к окислительно-восстановительным реакциям, протекающим при непосредственном смешении растворов.
Экспериментальная часть






