Методика расчета объема воздуха, необходимого для сгорания простых
веществ, химических соединений, объема и состава продуктов их горения
А) Твердые вещества (расчет по массе)
1. Составляем уравнение реакции горения вещества в воздухе.
2. Рассчитываем объём, занимаемый 1 кмоль газа при заданных условиях.
 , м3/кмоль;
, м3/кмоль;
где
22,4 м3/кмоль - объем, занимаемый 1 кмоль газа при нормальных условиях.
Рну - атмосферное давление при нормальных условиях, равное 101325 Па.
Тну – температура при нормальных условиях, равная 273К.
Т - заданная температура, К.
Р - заданное давление, Па.
3. Определяем молярную массу горючего вещества (М).
4. Рассчитываем объем воздуха, необходимый для сгорания горючего вещества.
 , м3;
, м3;
где
4,76 - число кмоль воздуха (1 кмоль О2 + 3,76 кмоль N2);
β - стехиометрический коэффициент, стоящий перед кислородом в уравнении реакции горения.
m – масса горючего вещества, кг;
Vt – объем, занимаемый 1 кмоль воздуха при заданных условиях, м3/кмоль;
М - молярная масса горючего вещества, кг/кмоль;
a - коэффициент избытка воздуха.
5. Определяем число кмоль кислорода и азота в избытке воздуха.
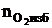 = b(a - 1), кмоль;
= b(a - 1), кмоль;
 =3,76 × b(a - 1), кмоль.
=3,76 × b(a - 1), кмоль.
6. Рассчитываем общее количество вещества продуктов горения
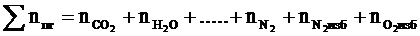 , кмоль;
, кмоль;
7. Находим объем продуктов горения по формуле:
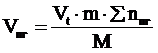 , м3
, м3
где
Vt – объем, занимаемый 1 кмоль продуктов горения при заданных условиях, м3/кмоль;
m - масса горючего вещества, кг;
М - молярная масса горючего вещества, кг/кмоль;
Snпг - количество вещества продуктов горения, кмоль.
8. Рассчитываем объёмы компонентов продуктов горения по формуле:



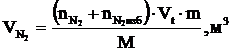
 и т.д.
и т.д.
9. Рассчитываем мольный процентный состав продуктов горения, принимая общее число кмоль продуктов горения за 100 %.
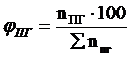 , мол. %;
, мол. %;
 , мол. %;
, мол. %;  , мол. %;
, мол. %;
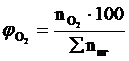 , мол. %;
, мол. %;  , мол. % и т.д.
, мол. % и т.д.
Аналогично рассчитывается объемный процентный состав продуктов горения. Численное значение объемных процентов при этом будет совпадать с мольным процентным составом продуктов горения.
Б) Газообразные вещества (расчет по объему):
1. Составляем уравнение реакции горения вещества в воздухе.
2. Рассчитываем объем воздуха, необходимого для сгорания вещества.
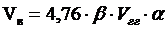 , м3,
, м3,
где
Vв - теоретический объем воздуха необходимый для сгорания вещества, м3.
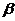 - стехиометрический коэффициент при кислороде в уравнении реакции горения.
- стехиометрический коэффициент при кислороде в уравнении реакции горения.
a - коэффициент избытка воздуха.
Vгг - заданный объем горючего газа, м3.
3. Определяем число кмоль кислорода и азота в избытке воздуха.
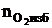 = b(a - 1), кмоль;
= b(a - 1), кмоль;
 =3,76 × b(a - 1), кмоль.
=3,76 × b(a - 1), кмоль.
4. Рассчитываем общее количество вещества продуктов горения
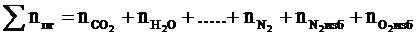 , кмоль.
, кмоль.
5. Находим общий объем продуктов горения по формуле:
Vпг = Vгг × ånпг, м3
где
Vгг - заданный объем горючего газа, м3;
ånпг- общее количество вещества продуктов горения, кмоль.
6. Рассчитываем объём компонентов продуктов горения по формуле:
 = Vгг×
= Vгг× 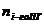 , м3;
, м3;
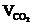 = Vгг×
= Vгг× 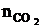 , м3;
, м3; 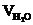 = Vгг×
= Vгг× 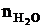 , м3;
, м3;
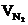 = Vгг×
= Vгг× 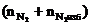 , м3
, м3  = Vгг×
= Vгг×  , м3 и т.д.
, м3 и т.д.
7. Рассчитываем мольный процентный состав продуктов горения, исходя из общего числа кмоль продуктов горения.
 , мол. %;
, мол. %;
 , мол. %;
, мол. %;  , мол. %;
, мол. %;
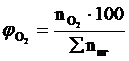 , мол. %;
, мол. %;  , мол. % и т.д.
, мол. % и т.д.
Методика расчёта объёма воздуха, необходимого для горения сложных веществ переменного состава, расчет объема и состава продуктов их горения
А) Твёрдые и жидкие вещества (расчет по массе).
1. Рассчитываем объём воздуха, необходимый для сгорания заданной массы вещества при нормальных условиях.
 , м3
, м3
где
wС, wН, wS, wO - массовые доли углерода, водорода, серы и кислорода в горючем веществе, %;
m – масса горючего вещества, кг;
a - коэффициент избытка воздуха.
2. Определяем объём воздуха при заданных условиях:
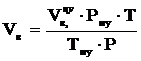 , м3,
, м3,
где
Рну - атмосферное давление при нормальных условиях, Па;
Тну - температура при нормальных условиях, К;
Р - заданное давление, Па;
Т - заданная температура, К.
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения, при нормальных условиях.
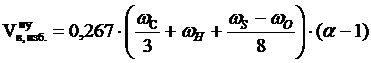 , м3
, м3
4. Используя коэффициенты, указанные в табл. 1 приложения 2, определяем объёмы компонентов продуктов горения (оксида углерода (IV), водяного пара, оксида серы (IV), оксида фосфора (V), азота и кислорода), образующиеся при сгорании 1 кг горючего вещества при нормальных условиях ( , м3).
, м3).
5. Определяем общий объём продуктов горения, выделяющихся при сгорании 1 кг вещества в нормальных условиях, суммируя объёмы компонентов продуктов горения:
 , м3.
, м3.
6. Пересчитываем общий объём продуктов горения при нормальных условиях на заданное количество вещества
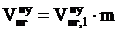 , м3
, м3
где
 - общий объём продуктов горения, выделяющихся при сгорании 1 кг горючего вещества в нормальных условиях, м3;
- общий объём продуктов горения, выделяющихся при сгорании 1 кг горючего вещества в нормальных условиях, м3;
m - масса горючего вещества, кг.
7. Находим объём продуктов горения при заданных условиях.
 , м3,
, м3,
где
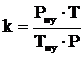 .
.
8. Находим объём компонентов продуктов горения при заданных условиях по формулам:
 , м3;
, м3; 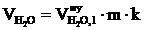 , м3;
, м3;  , м3;
, м3;
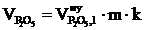 , м3;
, м3;  , м3;
, м3; 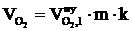 , м3.
, м3.
9. Объемный процентный состав компонентов продуктов горения определяется из следующих соотношений, принимая их общий объём  за 100 %.
за 100 %.
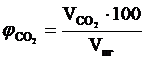 ,об. %;
,об. %; 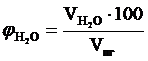 , об. %;
, об. %;
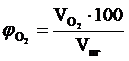 , об. %;
, об. %; 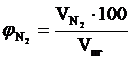 , об. % и т.д.
, об. % и т.д.
Б) Смесь газов (расчет по объему).
1. Составляем уравнения реакций горения горючих компонентов газовой смеси в воздухе и определяем стехиометрические коэффициенты b.
2. Определяем объём воздуха, необходимый для сгорания заданного объёма газовой смеси по формуле:
 , м3;
, м3;
где
bi- стехиометрический коэффициент перед кислородом i-ого горючего компонента смеси;
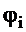 - концентрация i-ого горючего компонента смеси, об. %;
- концентрация i-ого горючего компонента смеси, об. %;
 - концентрация кислорода в газовой смеси, об. %;
- концентрация кислорода в газовой смеси, об. %;
Vгсм- заданный объём газовой смеси, м3.
a - коэффициент избытка воздуха.
3. Если заданный коэффициент избытка воздуха α > 1, то определяется объём избытка воздуха при сгорании 1 м3 газовой смеси
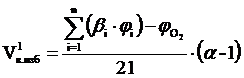 , м3.
, м3.
4. Используя коэффициенты, указанные в табл. 2 приложения 2, находим объём компонентов продуктов горения, образующихся при сгорании 1 м3 смеси ( ).
).
5. Рассчитываем общий объём продуктов, выделяющихся при сгорании 1 м3 горючей смеси, суммируя полученные значения объёмов компонентов продуктов горения:
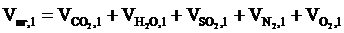 , м3.
, м3.
6. Пересчитываем полученное значение на заданный объём горючей смеси:
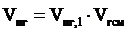 , м3.
, м3.
7. Находим объём каждого из компонентов продуктов горения:
 , м3;
, м3;
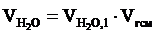 , м3;
, м3;
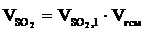 , м3 и т.д.
, м3 и т.д.
8. Рассчитываем объемный состав компонентов продуктов горения по формулам:
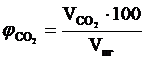 ,об. %, мол. %;
,об. %, мол. %; 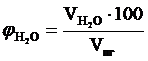 , об. %, мол. %;
, об. %, мол. %;
 , об. %, мол. %;
, об. %, мол. %; 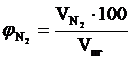 , об. %, мол. % и т.д.
, об. %, мол. % и т.д.
Задача 1. Рассчитать объём воздуха, необходимый для полного сгорания 5 кг хлорбензола; общий объём образовавшихся продуктов горения и их объемный процентный состав, при температуре 12 0С и давлении 101250 Па, если избыток воздуха составляет 15 %.
Дано:
C6H5Cl – хлорбензол;
m = 5 кг;
t = 120С;
Р = 101250 Па;
избыток воздуха = 15%.
Найти:Vв, Vпг, jпг?
Решение:
1. Используя правила, изложенные в разделе 2 настоящего пособия, составляем уравнение реакции горения хлорбензола в воздухе и определяем коэффициент b (стехиометрический коэффициент перед кислородом).
C6H5Cl + 7(О2 + 3,76N2) ® 6СО2 + 2Н2О + НCl + 7×3,76N2
b = 7
2. Рассчитываем объём, занимаемый 1 кмоль воздуха при заданных условиях.
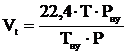 , м3/кмоль;
, м3/кмоль;
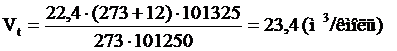
3. Рассчитываем молярную массу хлорбензола.
М (C6H5Cl) = 12 × 6 + 1 × 5 + 35,5 × 1 = 112,5 кг/кмоль
4. Рассчитываем объём воздуха, необходимый для полного сгорания заданной массы хлорбензола.
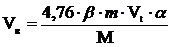 , м3;
, м3;
По условию задачи избыток воздуха составляет 15 %. В этом случае коэффициент избытка воздуха (a) на 0,15 больше единицы. Следовательно, a = 1,15.

5. Определяем избыточное количество вещества кислорода и азота.
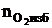 = b(a - 1), кмоль;
= b(a - 1), кмоль; 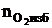 = 7(1,15 - 1) = 1,05 (кмоль)
= 7(1,15 - 1) = 1,05 (кмоль)
 =3,76 × b(a - 1), кмоль;
=3,76 × b(a - 1), кмоль;  =3,76 × 7(1,15 - 1) = 3,95 (кмоль)
=3,76 × 7(1,15 - 1) = 3,95 (кмоль)
6. Рассчитываем общее количество вещества продуктов горения.
ånп.г=  , кмоль;
, кмоль;
ånп.г= 6 + 2 + 1 + 26,32 + 3,95 + 1,05 = 40,32 (кмоль)
7. Определяем общий объём образующихся продуктов горения.
 , м3;
, м3;
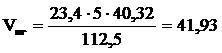 (м3)
(м3)
8. Рассчитываем объём компонентов продуктов горения.
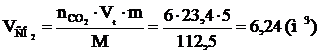

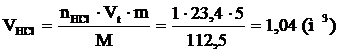

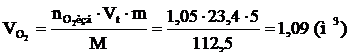
9. Определяем объемный состав компонентов продуктов горения. Принимаем общее количество вещества продуктов горения за 100 %.
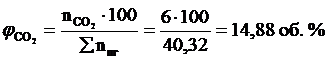


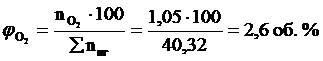

Ответ: для полного сгорания 5 кг хлорбензола в заданных условиях необходимо 39,85 м3 воздуха, при этом выделяется 41,93 м3 продуктов горения состава: оксид углерод (IV) - 6,24 м3 (14,88 %), вода - 2,08 м3 (4,96 %), хлороводород - 1,04 м3 (2,48 %), кислород - 1,09 м3 (2,6 %), азот - 31,48 м3 (75,07 %).
Задача 2. Рассчитать объём воздуха, необходимый для сгорания 17 м3 ацетилена, объём и объемный состав продуктов горения, если коэффициент избытка воздуха составляет 1,5.
Дано:
С2Н2 – ацетилен;
Vг.г. = 17 м3;
a = 1,5.
Найти: Vв, Vп.г., jп.г.?
Решение:
1. Составляем уравнение реакции горения ацетилена в воздухе и определяем коэффициент b (см. правила составления реакции горения в разделе 2).
C2H2 + (2,5О2 + 3,76N2) ® 2СО2 + Н2О + 2,5×3,76N2
b = 2,5
2. Рассчитываем объём воздуха, необходимый для полного сгорания заданного объёма ацетилена.
Vв = 4,76 × b × Vгг × a, м3;
Vв = 4,76 × 2,5 × 17 × 1,5 = 303,45 (м3)
3. Определяем количество вещества кислорода и азота в избытке воздуха.
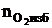 = b× (a - 1) = 2,5× (1,5 - 1) = 1,25 (кмоль)
= b× (a - 1) = 2,5× (1,5 - 1) = 1,25 (кмоль)
 = 3,76×b× (a - 1) =3,76×2,5× (1,5 - 1)= 4,7 (кмоль)
= 3,76×b× (a - 1) =3,76×2,5× (1,5 - 1)= 4,7 (кмоль)
4. Рассчитываем общее количество вещества продуктов горения.
ånпг = 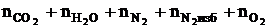 , кмоль;
, кмоль;
ånпг = 2 + 1 + 9,4 + 4,7 + 1,25 = 18,35 (кмоль)
5. Определяем общий объём образующихся продуктов горения.
Vпг = Vгг × Snпг = 17 × 18,35 = 311,95 (м3)
6. Рассчитываем объём компонентов продуктов горения.
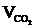 = Vгг ×
= Vгг × 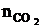 , м3;
, м3; 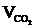 = 17 × 2 = 34 (м3)
= 17 × 2 = 34 (м3)
 = Vгг ×
= Vгг × 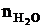 , м3;
, м3;  = 17 × 1 = 17 (м3)
= 17 × 1 = 17 (м3)
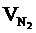 = Vгг ×
= Vгг × 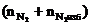 , м3
, м3 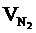 = 17 × (9,4 + 4,7) = 239,7 (м3)
= 17 × (9,4 + 4,7) = 239,7 (м3)
 = Vгг ×
= Vгг ×  , м3
, м3  = 17 × 1,25 = 21,25 (м3)
= 17 × 1,25 = 21,25 (м3)
7. Рассчитываем объемный состав продуктов горения, исходя из общего числа кмоль продуктов горения.
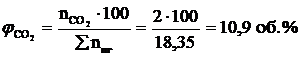 ;
;
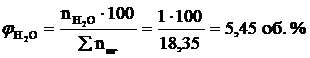 ;
;
 ;
;
 .
.
Ответ: для полного сгорания 17 м3 ацетилена в заданных условиях необходимо 303,45 м3 воздуха, при этом выделяется 311,95 м3 продуктов горения, состава: оксид углерод (IV) – 34 м3 (10,9%), вода – 17 м3 (5,45%), азот - 239,7 м3 (76,8%), кислород - 21,25 м3 (6,81%).
Задача 3. Рассчитать объём воздуха, необходимый для сгорания 2 кг каменного угля, имеющего состав в %: углерод - 79,81; водород - 5,63; кислород - 10,12; сера - 2,71; зола - 1,73. Если температура окружающей среды 17 оС, давление 100658 Па, коэффициент избытка воздуха 1,5. Определить объём и процентный состав продуктов горения.
Дано: каменный уголь состава:
w(С) - 79,81%; w(Н) - 5,63%; w(О) - 10,12%; w(S) - 2,71%; w(зола) - 1,73%.
m = 2 кг;
a = 1,5;
t = 17 оС;
Р = 100658 Па.
Найти: 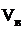 ;
; 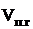 ; j(п.г.)?
; j(п.г.)?
Решение:
1. Рассчитываем объём воздуха, необходимый для сгорания заданной массы каменного угля при нормальных условиях.
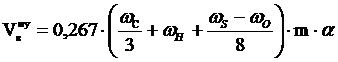 , м3;
, м3;
 = 25,07 (м3)
= 25,07 (м3)
2. Рассчитываем объём воздуха, необходимый для сгорания каменного угля, при заданных условиях.
 , м3;
, м3;
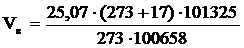 = 26,81 (м3)
= 26,81 (м3)
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения.
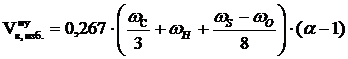 , м3
, м3
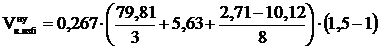 = 4,17 (м3)
= 4,17 (м3)
4. Определяем объём и состав продуктов горения 1 кг каменного угля при нормальных условиях, используя табл.1 приложения 2.
| № п/п | Элементный состав вещества на 1 кг | 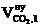 ,
м3 ,
м3
| 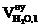 ,
м3 ,
м3
|  ,
м3 ,
м3
|  ,
м3 ,
м3
| 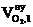 ,
м3 ,
м3
|
| 1 | mC = 0,7981 кг | 1,87 × 0,7981 = 1,492 | ____ | ____ | 7,02 × 0,7981 = 5,603 | ____ |
| 2 | mH = 0,0563 кг | ____ | 11,2 × 0,0563 = 0,6306 | ____ | 21,06 × 0,0563 = 1,186 | ____ |
| 3 | mO = 0,1012 кг | ____ | ____ | ____ | -2,63 × 0,1012 = - 0,266 | ____ |
| 4 | mS = 0,0271 кг | ____ | ____ | 0,7 × 0,0271 = 0,019 | 2,63 × 0,0271 = 0,071 | ____ |
| 5 | Избыток воздуха | ____ | ____ | ____ | 4,17 × 0,79 = 3,29 | 4,17 × 0,21 = 0,88 |
| 6 | Всего | 1,492 | 0,630 | 0,019 | 9,884 | 0,88 |
Примечание: при заполнении графы "элементный состав вещества на 1 кг" следует перевести массовую долю каждого элемента в доли единицы (wС = 79,81 %, что соответствует массе углерода mC = 0,7981 кг); жирным выделены постоянные коэффициенты, которые взяты из таблицы 2 приложения 2.
5. Определяем объём компонентов продуктов горения 1 кг каменного угля при нормальных условиях.
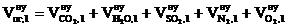 , м3;
, м3;
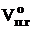 = 1,4924 + 0,6306 + 0,019 + 9,8835 + 0,88 = 12,91 (м3)
= 1,4924 + 0,6306 + 0,019 + 9,8835 + 0,88 = 12,91 (м3)
6. Рассчитываем общий объём продуктов горения, выделившихся при сгорании 2 кг каменного угля при нормальных условиях.
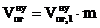 , м3 ;
, м3 ; 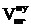 = 12,91 × 2 = 25,81 (м3)
= 12,91 × 2 = 25,81 (м3)
7. Определяем общий объём продуктов горения каменного угля, образующихся при заданных условиях.
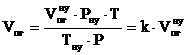 , м3;
, м3; 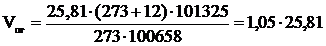 =27,6 (м3)
=27,6 (м3)
8. Рассчитываем объём компонентов продуктов горения каменного угля при заданных условиях.
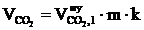 = 1,492 2 1,05 = 3,19 (м3);
= 1,492 2 1,05 = 3,19 (м3);
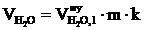 = 0,6306 2 1,05 = 1,35 (м3);
= 0,6306 2 1,05 = 1,35 (м3);
 = 0,019 2 1,05 = 0,04 (м3);
= 0,019 2 1,05 = 0,04 (м3);
 = 9,8835 2 1,05 = 21,14 (м3);
= 9,8835 2 1,05 = 21,14 (м3);
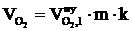 = 0,88 2 1,05 = 1,88 (м3);
= 0,88 2 1,05 = 1,88 (м3);
где
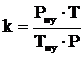 .
.
9. Находим объемный процентный состав компонентов продуктов горения.
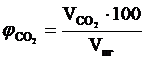 , %;
, %; 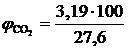 = 11,56 %
= 11,56 %
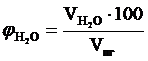 , %;
, %; 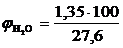 = 4,89 %
= 4,89 %
 , %;
, %; 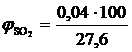 = 0,14 %
= 0,14 %
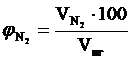 , %;
, %; 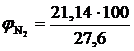 = 76,59 %
= 76,59 %
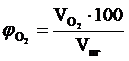 , %
, % 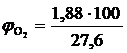 = 6,81 %
= 6,81 %
Ответ. Для полного сгорания 2 кг каменного угля в заданных условиях необходимо 26,81 м3 воздуха, при этом выделяется 27,6 м3 продуктов горения, состава: оксид углерода (IV) - 3,19 м3 (11,56 %), вода - 1,35 м3 (4,89 %), оксид серы (IV) - 0,04 м3 (0,14 %), азот - 21,14 м3 (76,59 %), кислород - 1,88 м3 (6,81 %).
Задача 4. Рассчитать объём воздуха, необходимый для сгорания 23 м3 смеси газов состава в % (об.): метан – 89 %; этан - 4,7 %; пропан – 3,7 %; оксид углерода (IV) - 2,4 %; азот - 0,2 %. Определить объём и процентный состав продуктов горения, если коэффициент избытка воздуха равен 1,5.
Дано: смесь газов следующего состава:
 = 89 %;
= 89 %;  = 4,7 %;
= 4,7 %; 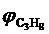 = 3,7 %;
= 3,7 %;  = 2,4 %;
= 2,4 %; 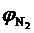 = 0,2 %.
= 0,2 %.
Vгсм = 23 м3,
a = 1,5.
Найти: Vв, Vпг, jпг?
Решение:
1. Составляем уравнения реакции горения горючих компонентов газовой смеси в воздухе и определяем стехиометрические коэффициенты b. Среди газов, входящих в состав смеси, гореть способны метан СН4 (обозначим его цифрой 1), этан С2Н6 (2) и пропан С3Н8 (3). Азот до 2000 0С в реакцию горения не вступает, углекислый газ также не горит.
СН4 + 2(О2 + 3,76 N2) ® СО2 + 2Н2О + 7.52 N2 b1 = 2
С2Н6 + 3,5(О2+ 3,76 N2) ® 2СО2 + 3Н2О + 3,16 N2 b2= 3,5
С3Н8 + 5(О2 + 3,76 N2) ® 3СО2 + 4Н2О + 18.80 N2 b3= 5
2. Определяем объём воздуха, необходимый для сгорания заданного объёма газовой смеси.
 , м3;
, м3;
 =
= 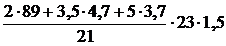 = 349,85 (м3)
= 349,85 (м3)
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения, при сгорании 1 м3 газовой смеси.
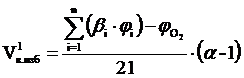 , м3;
, м3;
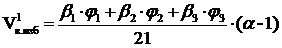 =
= 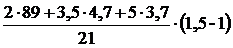 = 5,07 (м3)
= 5,07 (м3)
4. Определяем объём и состав продуктов горения 1 м3 газовой смеси, используя табл. 2 приложения 2. Для этого заполним таблицу:
| № п/п | Состав 1 м3 газовой смеси |  , м3 , м3
|  , м3 , м3
|  , м3 , м3
|  , м3 , м3
|
| 1 |  = 0,89 м3 = 0,89 м3
| 1×0,89=0,89 | 2×0,89=1,79 | 7,52×0,89=6,69 | ____ |
| 2 |  = 0,047м3 = 0,047м3
| 2×0,047=0,09 | 3×0,047=0,14 | 13,16×0,047=0,62 | ____ |
| 3 |  = 0,037м3 = 0,037м3
| 3×0,037=0,11 | 4×0,037=0,15 | 16,8×0,037=0,62 | ____ |
| 4 |  = 0,024 м3 = 0,024 м3
| 1×0,024=0,02 | ____ | ____ | ____ |
| 5 |  = 0,002 м3 = 0,002 м3
| ____ | ____ | 1×0,002=0,002 | ____ |
| 6 | Избыток воздуха | ____ | ____ | 5,07×0,79=4,01 | 5,07×0,21=1,06 |
| 7 | Всего | 1,11 | 2,08 | 11,94 | 1,06 |
5. Определяем объём продуктов горения 1 м3 смеси газов.
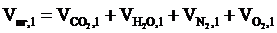 = 1,11 + 2,08 + 11,94 + 1,06 = 16,19 (м3)
= 1,11 + 2,08 + 11,94 + 1,06 = 16,19 (м3)
6. Рассчитываем объём продуктов горения 23 м3 природного газа.
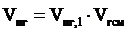 = 16,19 ×23 = 372,37 (м3)
= 16,19 ×23 = 372,37 (м3)
7. Рассчитываем объём каждого из компонентов продуктов горения.
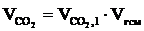 = 1,11 × 23 = 25,53 (м3);
= 1,11 × 23 = 25,53 (м3);
 =2,08 × 23 = 47,84 (м3);
=2,08 × 23 = 47,84 (м3);
 = 11,94 × 23 = 274,62 (м3);
= 11,94 × 23 = 274,62 (м3);
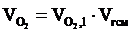 = 1,06 × 23 = 24,38 (м3).
= 1,06 × 23 = 24,38 (м3).
8. Определяем объемный состав компонентов продуктов горения.
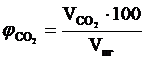 =
=  = 6,85 %
= 6,85 %
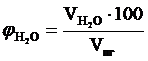 =
= 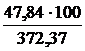 = 12,85 %.
= 12,85 %.
 =
=  = 6,55 %
= 6,55 %
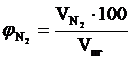 =
= 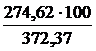 = 73,75 %
= 73,75 %
Ответ. Для полного сгорания 23 м3 газовой смеси в заданных условиях необходимо 349,85 м3 воздуха, при этом выделяется 372,37 м3 продуктов горения, состава: оксид углерода (IV) - 25,53 м3 (6,85 %), вода - 47,84 м3 (12,85 %), азот - 274,62 м3 (73,75 %), кислород - 24,38 м3 (6,55 %).






