Благодаря наличию пустой орбитали у атома углерода и неподеленных электронных пар у атома кислорода, по донорно-акцепторному механизму образуется третья связь. Это приводит к смещению электронной плотности от атома кислорода к атому углерода. Данное смещение настолько сильное, что избыточная электронная плотность оказывается не на атоме кислорода, а на атоме углерода. Молекула СО достаточно прочная, прочность молекулы сравнима с прочность молекулы N2. В структурных формулах две обменные cвязи изображаются черточками, а донорно-акцепторная – стрелкой, направленной от атома донора к атому-акцептору:
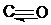
Пример 13. Пользуясь таблицей относительных электроотрицательностей (ОЭО), вычислите разность ОЭО для связей K-Cl, H-O, Cl-O, Fe-Cl, Na-F,Cl-Cl и дайте характеристику этих связей.
Решение.
Для того, чтобы дать характеристику связей этих пар атомов, используя таблицу относительных электроотрицательностей, нужно найти разность значений:
∆ОЭОCl-K = 3,0 – 0,8 = 2,2 - ∆ОЭО > 2, связь ионная;
∆ОЭОО-Н = 3,5 – 2,1 = 0,4 - ∆ОЭО < 1,5, связь ковалентная полярная;
∆ОЭОO-Cl = 3,5 – 3,0 = 0,5 - ∆ОЭО < 1,5, связь ковалентная полярная;
∆ОЭОCl-Fe = 3,0 – 1,9 =1,1 - ∆ОЭО < 1,5, связь ковалентная полярная;
∆ОЭОF-Na = 4,0 – 0,9 = 3,1 -∆ОЭО > 2, связь ионная;
∆ОЭОCl-Cl = 3,0 – 3,0 = 0 - ∆ОЭО = 0, связь ковалентная неполярная.
Химическая кинетика
Химическая кинетика изучает процессы протекания химической реакции во времени, а также механизмы химических реакций.
Реакции: а) гомогенные (отсутствуют границы раздела фаз между реагентами, протекают во всем объеме);
б) гетерогенные (протекают на поверхности раздела фаз).
Реакции: а) простые (элементарные) (протекают в одну стадию и отражаются записанным уравнением);
б) сложные (состоят из нескольких элементарных реакций);
Реакции: а) необратимые (хотя бы один из реагентов полностью расходуется в процессе реакции);
б) обратимые (в реакционной смеси всегда присутствуют как продукты реакции, так и исходные вещества).
Одним из основных понятий химической кинетики является понятие скорости химической реакции.
Под скоростью химической реакции понимают число элементарных актов реакции, в результате которых происходит превращение исходных веществ в продукты реакции, в единицу времени в единице объема.
На практике скорость реакций измеряют по изменению концентраций участвующих в ней веществ за определенный промежуток времени.

Очевидно, что в разные моменты времени концентрации реагирующих веществ изменяются, следовательно скорость реакции тоже изменяется. Мгновенная скорость реакции определяется пределом, к которому стремится выражение  при
при  , т.е. производной концентрации по времени.
, т.е. производной концентрации по времени.

Графически мгновенная скорость может быть определена как тангенс угла a наклона кривой 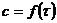 в точке, соответствующей какому-либо моменту времени.
в точке, соответствующей какому-либо моменту времени.
Из двух химических реакций с наибольшей скоростью идет та, в которой за одинаковое время образуется большее количество вещества.
Закон действия масс
Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение. Столкновение происходит тем чаще, чем больше молекул содержится в данном объеме, т.е. скорость химической реакции зависит от концентрации реагирующих веществ.

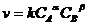
k – константа скорости химической реакции, численно равная скорости реакции при концентрациях реагирующих реагирующих веществ, равных 1моль/л;
a, b - простые числа, обычно не больше 3. Для простых реакций соответствует стехиометрическим коэффициентам.
Скорость реакции не зависит от концентрации твердого вещества, а только от площади их поверхности.
CaO + CO2  CaCO3
CaCO3


Кинетика сложной реакции лимитируется, т. е. определяется медленной стадией. Например, реакция 2HI + H2O2 ® 2H2O + I2 реально протекает в две стадии:
1. HI + H2O2 ® HOI + H2O (медленно)
2. HOI + HI ® I2 + H2O (быстро)
Выражение скорости этой реакции записывается как
 , а не
, а не 
В химической кинетике взаимодействие классифицируют по признаку молекулярности реакции или порядка реакции.
Молекулярность реакции определяется числом молекул, участвующих в элементарном акте реакции.
Реакции могут быть: мономолекулярными I2 ® 2I
бимолекулярными H2 + I2 ® 2HI
тримолекулярными 2NO+H2®N2O+H2O
Реакции более высокой молекулярности не встречаются.
Порядок реакции определяется зависимостью скорости реакции от концентрации каждого из реагирующих веществ.
Например, если скорость реакции aA + bB ® cC + dD, то  , то эта реакция а -го порядка по отношению A и порядка b по отношению к веществу В. Сумма показателей степеней (a + b) называется общим порядком реакции.
, то эта реакция а -го порядка по отношению A и порядка b по отношению к веществу В. Сумма показателей степеней (a + b) называется общим порядком реакции.
Порядок простой реакции определяется ее молекулярностью.
Порядок сложной реакции определяется порядком наиболее медленной стадии.
Влияние температуры
Скорость реакции зависит от числа эффективных столкновений. Эффективное столкновение происходит только между активными молекулами. Увеличение температуры увеличивает число активных молекул, сообщая им необходимую энергию активации, и увеличивает скорость реакции.
Энергия активации – это та дополнительная энергия, которую нужно передать системе для начала химической реакции.
Энергия активации – один из основных параметров, который характеризует скорость химического взаимодействия. Она зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше (при прочих равных условиях) скорость реакции. Энергия активации необходима, в основном, для ослабления химических связей в исходных веществах и для преодоления отталкивания между электронами, которое возникает при сближении молекул и атомов взаимодействующих веществ и мешает их столкновению.
Правило Вант Гоффа. При увеличении температуры на 10° скорость реакции возрастает в 2 – 4 раза.
 , где
, где
v 2 - скорость реакции при температуре T2,
v 1 - скорость реакции при температуре T1,
g - температурный коэффициент скорости, определяет изменение скорости реакции при изменении температуры на 10°. Для обычных реакций температурный коэффициент лежит в пределах 2 – 4. Исключение составляют ферментативные реакции, для которых g = 7 – 9.
Так как  , то можно доказать, что
, то можно доказать, что  , то есть константа скорости реакции зависит от температуры.
, то есть константа скорости реакции зависит от температуры.
Так как 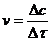 , то
, то 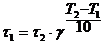 , где t - время реакции.
, где t - время реакции.
Уравнение Вант Гоффа лишь приблизительно оценивают зависимость скорости реакции от температуры. Более точную формулу установил шведский ученый С. Аррениус:
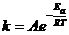 ,
,
где А – константа, не зависящая от температуры;
R – универсальная газовая постоянная (R = 8,31 Дж/К моль);
e – основание натурального логарифма (e = 2,72);
Т – абсолютная температура;
Еа – энергия активации реакции
Химическое равновесие
Если химическая реакция может протекать только в одном направлении, то она называется необратимой. Реакции, протекающие одновременно в двух направлениях, обратимы. С течением времени скорость прямой реакции (v  ) уменьшается, а скорость обратной реакции (v
) уменьшается, а скорость обратной реакции (v  ) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия:
) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия:
v  = v
= v  .
.
Состояние химического равновесия описывается константой равновесия, К.
Для обратимой химической реакции aA + bB  cC + dD
cC + dD
K =  , где
, где
CA, CB, CC, CD - концентрации газообразных или растворенных веществ.
Состояние химического равновесия - динамическое. Его можно смещать. Смещение химического равновесия подчиняется принципу Ле Шателье (принципу противодействия): еcли на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяются температура, давление, концентрация одного из исходных веществ или продуктов реакции), то положение равновесия смещается в ту сторону, которая ослабляет внешнее воздействие.
Увеличение температуры вызывает смещение равновесия в сторону протекания эндотермической реакции (DH>0), а уменьшение температуры - в сторону экзотермической реакции (DH<0).
Увеличение давления в системе вызывает смещение равновесия в сторону меньшего количества газообразных веществ, а уменьшение давления - в сторону большего количества газообразных веществ.
Увеличение концентрации одного из исходных веществ вызывает смещение равновесия реакции вправо (в сторону его расходования, то есть в сторону образования продуктов реакции), а увеличение концентрации одного из продуктов реакции - влево.
Примеры решения задач
Пример 14. Составить математическое выражение для скоростей следующих реакций:
2NO(г) + O2(г) = 2NO2(г);
СаО(тв) + СО2(г) = СаСО3(т)
Решение. В соответствии с законом действующих масс скорость первой реакции должна быть прямо пропорциональна произведению молярных концентраций NO и О2, взятых в степени равной стехиометрическим коэффициентам:
V = k∙CNO2 ∙ CO2;
Для математического выражения скорости второй реакции (гетерогенной системы) учитываются только концентрации газообразных компонентов:
V = k ∙ CCO2.
Пример 15. Скорость некоторой реакции увеличивается в 3 раза при повышении температуры реакционной смеси на 10ºС. Во сколько раз увеличится скорость реакции при повышении температуры от 30 до 60ºС?
Решение. По правилу Вант-Гоффа
V(T2) = V(T1)ּγT2-T1/10, следовательно,
V(T2)/V(T1) = γT2-T1/10= 360-30/10 = 33 = 27
Ответ: Скорость реакции увеличится в 27 раз.
Пример 16. Во сколько раз изменится скорость реакции при понижении температуры от 70 до 40ºС, если температурный коэффициент реакции равен 2?
Решение. По правилу Вант-Гоффа
V(T2) = V(T1)ּγT2-T1/10, следовательно,
V(T2)/V(T1) = γT2-T1/10= 2-3 = ½3 = 1/8.
Ответ: Скорость реакции уменьшится в 8 раз.
Пример 17. Как изменится скорость прямой реакции
2SO2(г) + O2(г) = 2SO3(г)
если уменьшить объем газовой смеси в три раза.
Решение. Скорость реакции до изменения объема:
V1 = k∙C2SO2∙CO2
При уменьшении объема системы в три раза во столько же раз возрастут концентрации реагирующих веществ (так как концентрация – это масса вещества в единице объема, при постоянной массе с уменьшением объема концентрация веществ возрастает). Тогда после уменьшения объема системы в три раза скорость реакции будет:
V2 = k∙(3CSO2)2∙3CO2 = 27k∙ C2SO2∙CO2
Т.е. скорость реакции увеличится в  27 раз.
27 раз.
Пример 18. Вычислите равновесные концентрации [NO] и [O2] и константу равновесия реакции 2NO(г) + О2(г)  2NO2(г), если исходные концентрации NO и О2 составляют по 0,08 моль/л, а равновесная концентрация [NO2] равна 0,06 моль/л.
2NO2(г), если исходные концентрации NO и О2 составляют по 0,08 моль/л, а равновесная концентрация [NO2] равна 0,06 моль/л.
Решение. Согласно уравнению реакции на образование 0,06 моль NO2 расходуется 0,06 моль NO и 0,03 моль О2, следовательно, их равновесные концентрации равны:
[NO] = 0,08 – 0,06 = 0,02 моль/л; [O2] = 0,08-0,03 = 0,05 моль/л.
Подставим эти значения в выражение константы равновесия, получим:
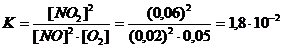
Пример 19. В момент равновесия системы N2 + 3H2  2NH3 концентрации веществ составляют: [N2] = 5 моль/л; [H2] = 9 моль/л; [NH3] = 7 моль/л. Какова была исходная концентрация азота?
2NH3 концентрации веществ составляют: [N2] = 5 моль/л; [H2] = 9 моль/л; [NH3] = 7 моль/л. Какова была исходная концентрация азота?
Решение. Равновесные концентрации реагирующих веществ – это их концентрации в момент химического равновесия. По уравнению реакции из 1 моль N2 образуется 2 моль NH3, следовательно, для нахождения исходной концентрации азота нужно составить пропорцию:
из 1 моль N2 образуется 2 моль NH3;
из x моль N2 - 7 моль NH3,
откуда х = 3,5 моль N2.
Таким образом, исходная концентрация азота равна (5 + 3,5) = 8,5 моль/л.
Пример 20. В системе 3А + В  2С + D концентрации веществ А, В и С в состоянии равновесия равны соответственно 0,030; 0,010 и 0,008 моль/л. Найдите исходные концентрации веществ.
2С + D концентрации веществ А, В и С в состоянии равновесия равны соответственно 0,030; 0,010 и 0,008 моль/л. Найдите исходные концентрации веществ.
Решение. Концентрация веществ С и D в исходной смеси была равна нулю, то есть все они образовалось в процессе химической реакции. Согласно уравнению реакции, в 1 л равновесной смеси
n(D) = ½ n(C) = ½ × 0,008 = 0,004 (моль).
В процессе реакции исходные концентрации веществ А и В уменьшаются (идет их превращение в продукты реакции). Сравнивая коэффициенты в уравнении реакции, получаем: n(B) = n(D) = 0,004 моль; n(A) = 3×n(B) = 0,012 моль.
Исходные концентрации А и В – это суммы оставшихся и прореагировавших количеств:
| 3 A | + | B | 
| 2 C | + | D | |
| Взято, моль/л | 0,042 | 0,014 | 0 | 0 | |||
| К моменту равно-весия прореагиро-вало, моль/л | 0,012 | 0,004 | |||||
| Образовалось, моль/л | 0,008 | 0,004 | |||||
| Осталось, моль/л | 0,030 | 0,010 |
Таким образом, исходная концентрация вещества А – 0,042 моль/л; исходная концентрация вещества В – 0,014 моль/л.
Пример 21. Какие факторы (давление, температура, катализатор) влияют на смещение равновесия в реакции: СО2(г) + С(тв)  2СО +∆Н в сторону образования СО? Ответ мотивируйте.
2СО +∆Н в сторону образования СО? Ответ мотивируйте.
Решение. Рассмотрим по очереди все факторы:
1.Давление. В правой и в левой части уравнения реакции есть газы. Однако V(CO2) = 2V(CO), поэтому по принципу Ле Шателье равновесие сместится в сторону уменьшения давления системы, т.е. влево. Чтобы сместить равновесие вправо, давление следует понизить.
2.Температура. Реакция идет с поглощением тепла. Следовательно, увеличение температуры смещает равновесие вправо.
3.Катализатор во всех случаях ускоряет наступление равновесия, но само равновесие не смещается.
АДСОРБЦИЯ
Адсорбция – это поглощение одного вещества поверхностью другого.
Абсорбция – это поглощение одного вещества в объеме другого.
Нескомпенсированность сил притяжения и отталкивания молекул вещества на поверхности приводит к возникновению поверхностного натяжения и способности к адсорбции молекул из окружающей среды:

По типу взаимодействия молекул поверхности (адсорбента) и молекул окружающей среды (адсорбата) адсорбцию делят на:
1. физическую (связана только с межмолекулярным взаимодействием. Такая адсорбция обратима и всегда сопровождается десорбцией);
2. химическую (сопровождается протеканием на поверхности химической реакции, например, возникновение оксидной пленки на поверхности металлов. Такая адсорбция необратима).
Адсорбция зависит от температуры (уменьшается при нагревании) и от давления (увеличивается при увеличении давления в случае адсорбции из газовой фазы).
Зависимость величины адсорбции от концентрации адсорбата (или давления) при постоянной температуре называется изотермой адсорбции:
Г = f (P) T = Const или Г = f (С) T = Const
Согласно теории Лэнгмюра, адсорбция происходит только в места максимального действия сил притяжения (активные места). Если все активные места поверхности заняты, то адсорбция не происходит. Если считать, что Г – адсорбция в данный момент времени, а Г max – максимально возможная адсорбция (все активные места адсорбента заняты адсорбатом), то
Г / Г max = q (степень заполнения поверхности);
1 – q - доля свободной поверхности, способной к адсорбции.
Скорость адсорбции пропорциональна концентрации адсорбата в окружающей среде и количеству свободных мест на поверхности адсорбента (доле свободных мест), а скорость десорбции пропорциональна числу занятых мест на поверхности адсорбента : v(адс.) = k (адс.) × (1 – q) [адсорбат]
v(дес.) = k (дес.) × q.
При достижении равновесия v(адс.) = v(дес.);
k (адс.) × (1 – q) [адсорбат] = k (дес.) × q;
k (дес.)/ k (адс.) = q / (1 – q) [адсорбат] = К.
Тогда Г = Г max × K × [адсорбат] / 1 + K × [адсорбат]
В начальный момент адсорбции концентрация адсорбата на поверхности адсорбента мала, то есть 1 >> K × [адсорбат], знаменатель выражения близок к единице, Г = Г max × K × [адсорбат], то есть адсорбция линейно зависит от концентрации адсорбата (линия 1 на графике).
После того, как все активные места адсорбции заняты, концентрация адсорбата велика, 1 << K × [адсорбат], знаменатель можно принять за K × [адсорбат], то есть Г = Г max (адсорбция постоянна и не зависит от концентрации адсорбата, что отражается линией 2, параллельной оси абцисс). В промежутке зависимость Г от концентрации адсорбата нелинейна, что отражается изотермой адсорбции:
 Г
Г
2
 |
1
 [адсорбат]
[адсорбат]
ПОНЯТИЕ КАТАЛИЗА
Процесс изменения скорости химической реакции за счет введения в реакционную систему веществ, не входящих в состав продуктов реакции, называется катализом. Различают положительный и отрицательный катализ, то есть ускоряющий или замедляющий скорость данной реакции. Катализаторами называют вещества, увеличивающие скорость реакции и остающиеся после реакции в неизменном виде. Вещества, замедляющие скорость реакции называются ингибиторами.
Реакции, в которых один из продуктов является катализатором данного процесса, называются автокаталитическими.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа реагирующие вещества и катализатор находятся в одной фазе. Примером может служить окисление газообразного оксида серы (IV) до оксида серы (VI) с участием катализатора - оксида азота (IV) - тоже газа. Явление гомогенного катализа объясняется теорией образования промежуточных соединений, согласно которой в присутствии катализатора реакция протекает с его участием в несколько стадий. Схематично это может быть выражено так: А + В = АВ (реакция без катализатора идет медленно).
В присутствии катализатора К:
1-ая стадия А + К = АК (быстро, АК - промежуточное соединение)
2-ая стадия АК + В = АВ + К (катализатор К после реакции остается в химически неизменном виде).
Главной причиной ускоряющего действия гомогенных катализаторов является снижение энергии активации, необходимой для протекания реакции.
В гетерогенном катализе реагирующие вещества и катализатор находятся в различных фазах (как правило, катализатором является твердое вещество, на поверхности которого происходит ускорение реакции). Примером может служить реакция окисления оксида серы (IV) кислородом на поверхности платины. Механизм гетерогенного катализа заключается в адсорбции реагирующих веществ на поверхности катализатора (активных местах). Увеличение поверхностной концентрации приводит к увеличению скорости реакции. Продукты реакции десорбируются с поверхности катализатора.
Скорость гетерогенного катализа, как и скорость адсорбции, будет определяться числом активных мест на поверхности катализатора, а графическая зависимость аналогична изотерме адсорбции.
Гетерогенный катализатор всегда более активный, чем гомогенный катализатор (в большей степени увеличивает скорость реакции).
Биологический (ферментативный) катализ – это катализ биохимических реакций с помощью биокатализаторов – ферментов.
Особенности ферментативного катализа:
1. Высокая каталитическая активность ферментов (в сотни раз активнее неорганических катализаторов).
2. Биокатализаторы в отличие от неорганических катализаторов имеют высокую специфичность (один фермент, как правило, катализирует одну биохимическую реакцию).
3. Необходимость создания специальных условий (даже небольшое изменение рН и температуры приводит к изменению каталитических свойств ферментов).
РАСТВОРЫ
Растворы - этооднородные (гомогенные) системы переменного состава.
Растворы состоят по меньшей мере из двух компонентов – растворителя и растворенного вещества. За растворитель принимают обычно то вещество, которое сохраняет свое агрегатное состояние в процессе образования растворов или то, которое находится в избытке.
Количество (масса) растворенного вещества в единице массы или объема раствора называют концентрацией раствора.
Наиболее распространенные способы выражения концентрации растворов:
Массовая доля – это масса вещества в 100 г раствора:

Молярная концентрация – это количество вещества в 1 л раствора:

Молярная концентрация эквивалента (нормальная концентрация) – это число эквивалентов вещества в 1 л раствора:

Растворимость – это способность одного вещества растворяться в другом при заданных условиях. Количественно она выражается коэффициентом растворимости, s. Он равен концентрации насыщенного раствора при данных условиях. В том случае, когда концентрация растворенного вещества меньше коэффициента растворимости, мы имеем дело с ненасыщенными растворами. В ряде случаев возможно получить пересыщенные растворы, однако они неустойчивы и легко выделяют избыток вещества, превращаясь в насыщенные растворы.
Растворимость веществ зависит от температуры и давления: для жидких и твердых веществ она увеличивается при повышении температуры, для газов – при понижении температуры и повышении давления.






