Можно также получить металлический натрий электролизом расплава NaCl: 2NaCl 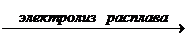 2Na + Cl2
2Na + Cl2
Пример 2. Осуществите превращения:
Cr  A
A  В
В  C
C
Решение.
1) Металлы реагируют с неметаллами:
2Cr + 3Cl2 = 2CrCl3 (A = CrCl3)
2) Действие избытка NaOH на соли хрома в водном растворе приводит к образованию гидроксосоли:
CrCl3 + 6NaOH = Na3[Cr(OH)6] + 3NaCl (B = Na3[Cr(OH)6])
3) При действии окислителей (Br2) степень окисления хрома (+3) переходит в степень окисления +6. В щелочной среде образуются хроматы (окислительно-восстановительная реакция):

| (окислитель) | 
| (восстановление) | 
|
| (восстановитель) | 
| (окисление) | 
|
 (C = Na2CrO4).
(C = Na2CrO4).
Пример 3. Напишите в молекулярной и ионной формах уравнения реакций, при помощи которых можно осуществить следующие превращения:

Решение.
1. Si + 2Mg  Mg2Si
Mg2Si
2. Mg2Si + 2H2SO4 → 2MgSO4 + SiH4↑
Mg2Si + 4H+ → 2Mg2+ + SiH4
3. SiH4 + 2O2 → 2H2O + SiO2
4. Si + O2 → SiO2
5. SiO2 + 2Mg → 2MgO + Si
6. Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
Si + 2OH- + H2O → SiO32- + 2H2
7. Na2SiO3 + CaCl2 → CaSiO3 + 2NaCl
SiO32- + Ca2+ → CaSiO3
8. SiO2 + Ca(OH)2 → CaSiO3 + H2O
SiO2 + 2OH- + Ca2+→ CaSiO3 + H2O
Основы химической термодинамики
К изучению химических процессов следует подходить через ряд последовательных приближений. На первом этапе целесообразно рассмотреть лишь начальное и конечное состояния взаимодействующих тел, не учитывая путь, по которому протекает процесс, и развитие процесса во времени. Такой подход называется термодинамический. Для удобства изучения необходимо изолировать объекты исследования. Такая совокупность тел, выделенная из пространства, называется системой. Если между системой и окружающей внешней средой отсутствует массо- и теплообмен, то такая система называется изолированной. Если это условие не соблюдается, то система называется открытой. Если в системе возможен только теплообмен, то она называется закрытой.
Состояние любой системы характеризуется определенными термодинамическими параметрами, к которым относятся температура (Т), давление (Р), объем (V), химический состав. Изменение хотя бы одного из параметров ведет к изменению состояния системы.
Состояние системы можно представить в виде так называемого уравнения состояния: j (Р, V, T) = 0
Для идеального газа уравнением состояния является уравнение Менделеева – Клапейрона, для реальных газов часто применяют уравнение Ван-дер-Ваальса. Для жидкостей и твердых тел, особенно в условиях высокихдавлений и температур являются эмпирические, то есть экспериментально полученные уравнения, описыващие поведение вещества в определенных пределах по давлению и температуре.
Для термодинамического описания системы обычно пользуются функциями состояния, которые могут быть однозначно определены через параметры Р, V и T. Значения этих функций не зависят от характера процесса, приводящего систему в данное состояние. К функциям состояния относятся: 1) внутренняя энергия системы (U);
2) энтальпия (теплосодержание) системы (Н);
3) энтропия (мера беспорядка) системы (S);
4) свободная энергия Гиббса (G);
5) свободная энергия Гельмгольца (F).
Химические реакции сопровождаются выделением или поглощением энергии как правило в форме теплоты. Реакции, в которых теплота выделяется, называются экзотермическими, а реакции, идущие с поглощением теплоты, - эндотермическими. Так как выделение теплоты приводит к уменьшению теплосодержания системы, то Q = - D H, где Q – теплота реакции, а D H – изменение энтальпии системы.
Таким образом, условием экзотермической реакции является Q > 0 или DH < 0, а условием эндотермической реакции - Q < 0 или DH > 0.
Уравнение химической реакции, включающее величину теплового эффекта (энтальпии), называется термохимическим уравнением: 2Н2(г) + О2(г) = 2Н2О(ж) + 571,6 кДж или
2Н2(г) + О2(г) = 2Н2О(ж); DH = - 571,6 кДж
Теплотой образования соединения называется количество теплоты, выделяемой или поглощаемой при образовании 1 моль соединения из простых веществ в их наиболее устойчивых модификациях. Так, теплота образования воды
DHобр(Н2О) = - 571,6/2 = - 285,8 кДж/моль
Теплота образования вещества, измеренная в стандартных условиях (Т = 298 К, Р = 101325 Па), называется стандартной теплотой образования и обозначается D H 0. Стандартная теплота образования простого вещества в его наиболее устойчивой модификации принимается равной нулю.
Вычисление теплоты реакции по теплотам образования участвующих в ней веществ производится на основании закона Гесса: тепловой эффект химической реакции зависит только от состояния исходных и конечных продуктов и не зависит от того, через какие стадии реакция проходит. Тепловой эффект процесса равен сумме тепловых эффектов отдельных стадий процесса.
Например, горение угля может протекать в одну стадию:
С(тв) + О2(г) = СО2(г); DH1 = - 395,4 кДж,
или через промежуточное образование оксида углерода (II):
а) С(тв) + 1/2О2(г) = СО(г); DH2 = - 110,7 кДж,
б) СО(г) + 1/2О2(г) = СО2(г); DH3 = - 284,7 кДж.
Суммарная теплота, выделяемая в результате реакции, в обоих случаях одинакова: DH1 = DH2 + DH3.
Согласно следствию из закона Гесса, теплота реакции равна разности между суммами стандартных теплот образования конечных продуктов и исходных веществ. Например, для реакции
MgO(тв) + CO2(г) = MgCO3(тв)
DH0реакции = DH0(MgCO3) – [DH0(MgO) + DH0(CO2)] =
= +115,6 – (– 602,0 – 395,4) = 1113,0 кДж.
Стандартные теплоты образования веществ – табличные данные.
Для протекающих в природе процессов известны две движущие силы – стремление перейти в состояние с наименьшим запасом энергии (DH < 0) и стремление перейти в состояние наибольшего беспорядка (S > 0). Так как в химических реакциях обычно изменяются и энергия системы, и ее энтропия, то реакция протекает в том направлении, в котором суммарная движущая сила реакции уменьшается. В изобарно-изотермических условиях (при прстоянных давлении и температуре) общая движущая сила реакции называется энергией Гиббса:
DG = DH – TDS
Отрицательное значение изменения энергии Гиббса (DG < 0) является условием самопроизвольного протекания реакции.
Температуру, при которой DG = 0, называют температурой начала реакции. В этом случае ТDG = 0 = DH / DS.
Изменения энергии Гиббса и энтропии в химических реакциях аналогичны изменениям энтальпии (теплового эффекта) и определяются в соответствии со следствием из закона Гесса:
DН0 = (SDН0продуктов – SDН0исх. в-в),
DG0 = (SDG0продуктов – SDG0исх. в-в),
DS0 = (SS0продуктов – SS0исх. в-в).
Примеры решения задач
Пример 4. Теплота образования сульфида меди (II) равна 48,534 кДж. Сколько теплоты выделяется при образовании 144 г сульфида меди (II)?
Решение.
Запишем термохимическое уравнение реакции:
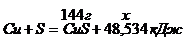
M(CuS) = M(Cu) + M(S) = 64 + 32 = 98 (г/моль)
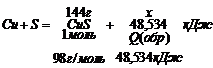

 71,315 (кДж)
71,315 (кДж)
СТРОЕНИЕ ВЕЩЕСТВА
Понятие строения вещества складывается из следующих моментов: 1) строение атома; 2) строение молекул; 3) строение агрегатов молекул.
Строение атома
Атом – сложная частица, состоящая из положительно заряженного ядра и электронных оболочек, на которых помещаются отрицательно заряженные электроны.
Положительный заряд ядра равен сумме отрицательных зарядов электронов, окружающих ядро, поэтому в целом атом электронейтрален.
Атом
 |

|  Ядро Ядро
|
| ||
| протоны (р) | нейтроны (n) | электроны (е) | ||
| Масса (кг) | 1,672×10-27 | 1,674×10-27 | 9,1×10-31 | |
| Масса (а.е.м.) | 1 | 1 | 1/1860 | |
| Заряд (Кл) | +1,602×10-19 | 0 | –1,602×10-19 | |
| Заряд (е) | +1 | 0 | –1 | |
Протоны, нейтроны и электроны называются элементарными частицами.
Масса атома, выраженная в атомных единицах массы, называется относительной атомной массой или массовым числом атома, М r. Она близка к сумме масс всех элементарных частиц. Так как массовые числа протона и нейтрона равны 1, а масса электрона пренебрежимо мала, то массовое число атома равно сумме числа протонов и нейтронов.
Символы химических элементов представляются обычно в виде:
 ,
,
где X – символ элемента;
a – массовое число (сумма числа протонов и нейтронов);
b – порядковый номер элемента (число протонов);
с – заряд иона.
Природные химические элементы существуют в виде смеси изотопов.
Изотопы – атомы одного химического элемента, имеющие одинаковое число протонов, но разные массовые числа (число нейтронов). Например, природный хлор существует в виде двух изотопов:  , ядро которого содержит 17 протонов и 18 нейтронов, и
, ядро которого содержит 17 протонов и 18 нейтронов, и  (17 протонов и 20 нейтронов). Атомная масса элемента, приведенная в периодической системе элементов, есть средняя масса его природных изотопов.
(17 протонов и 20 нейтронов). Атомная масса элемента, приведенная в периодической системе элементов, есть средняя масса его природных изотопов.
Протоны и нейтроны объединяются в компактное ядро за счет ядерных сил, возникновение которых приводит к дефекту массы (масса ядра всегда несколько меньше суммы масс протонов и нейтронов). Дефект массы определяет устойчивость атомного ядра и энергию связи нуклонов (протонов и нейтронов) в ядре.
Элементы с порядковыми номерами Z = 84 – 92 имеют только неустойчивые изотопы.
Элементы с порядковыми номерами больше 92 настолько нестабильны, что не существуют в природе, все они были получены искусственным путем.
Самопроизвольное разложение атомных ядер неустойчивых изотопов носит название «радиоактивность», а реакции, которые протекают в этих случаях – ядерные реакции.
Примеры ядерных реакций.
 – выделение a-частиц;
– выделение a-частиц;
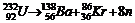 – выделение нейтронов;
– выделение нейтронов;
 (нейтрино) – электронный захват.
(нейтрино) – электронный захват.
Строение электронных оболочек
Сведения о строении электронных оболочек накапливались и развивались с конца XIX до середины ХХ века. Для строгого описания движении электронов вокруг атомного ядра необходимо использовать понятие корпускулярно-волнового дуализма электрона (электрон обладает одновременно свойствами частицы и волны).
Количественно волновой дуализм электрона и других элементарных частиц описывается уравнением Луи де Бройля:
 ,
,
где l – длина волны частицы;
m – масса частицы;
v – скорость ее движения;
h – постоянная Планка (h = 6,62×10-34 Дж×с).
Микрочастицы подчиняются принципу неопределенности Гейзенберга – для микрочастиц невозможно одновременно определить координату (х) и составляющую импульса (р) вдоль этой координаты: D х × D рх ³ h
В связи с этим, для описания поведения микрочастиц вводят особую функцию, которую называют функцией состояния или волновой функцией, Y. Она вводится таким образом, что квадрат ее модуля пропорционален вероятности обнаружить частицу (электрон) в данной точке в указанное время (плотность вероятности). Функция плотности вероятности достигает максимального значения на некотором конечном расстоянии от ядра. Например, для электрона атома водорода функция плотности вероятности имеет следующее распределение по всем осям координат:
 |
 ½Y2½
½Y2½
 r0 r
r0 r
Волновая функция электрона носит название «орбиталь». Она характеризует энергию и форму пространственного распределения электронного облака.
Количественные соотношения в теории строения атома определяются волновым уравнением Шредингера:
 , где
, где
U – потенциальная энергия электрона;
Е – полная энергия электрона;
m – масса электрона;
x, y, z – координата электрона;
y – волновая функция;
Решение уравнения Шредингера содержит набор квантовых чисел, характеризующих поведение электрона в атоме.
n – главное квантовое число, оно определяет общий запас энергии электрона, т.е. энергетический уровень.
n = 1,2,3…
l – орбитальное квантовое число, определяет форму электронной орбитали (энергетический подуровень).
l = 0,1,2…(n-1).
Если l = 0, то орбиталь называется s -орбиталь (движение электрона по сфере). При l = 1 мы имеем р -орбиталь (гантелевидная форма движения). Формы движения электронов по d - и f - орбиталям (l = 2 и 3 соответственно) имеют еще более сложный вид.
Число подуровней на энергетическом уровне совпадает с его номером. Так, для первого уровня (n = 1) существует только один подуровень (l = 0), то есть 1 s -орбиталь. Аналогично для n = 2 (второй уровень) имеем два подуровня (l = 0, 1) или 2 s,2 p -орбитали; для третьего уровня (n = 3, l = 0, 1, 2) – 3 s,3 p,3 d -орбитали и т.д.
ml – магнитное квантовое число, характеризует проекцию магнитного момента электрона на внешнее магнитное поле, то есть определяет ориентацию электронной орбитали в пространстве. Его значения определяются орбитальным квантовым числом: ml = ± l; ±(l -1); ±(l -2)…0.
При значении орбитального квантового числа l = 0 магнитное квантовое число имеет одно возможное значение (ml = 0), то есть возможен только один способ ориентации s -орбитали в пространстве. Аналогично получаем, что для р -орбиталей (l = 1, ml = –1, 0, +1) существуют три возможных способа ориентации (вдоль осей координат), для d -орбиталей – пять возможных способов ориентации (l = 2, ml = –2, –1, 0, +1, +2) и т.д.
На основе представлений о квантовых числах можно уточнить понятие электронной орбитали. Атомная орбиталь – это совокупность положений электрона в атоме, характеризуемых определенными значениями главного, орбитального и магнитного квантовых чисел. Условно атомные орбитали обозначают в виде клетки (энергетической ячейки):
ms – спиновое квантовое число, определяет собственный момент вращения электрона. Это квантовое число вытекает не из решения уравнения Шредингера, а из анализа атомных спектров. Магнитное квантовое число может принимать два значения:
ms = ± ½.
Условно электроны, имеющие разные значения спинового квантового числа, обозначаются противоположно направленными стрелками: ¯.
Размещение электронов в атоме
Если атом находится в основном состоянии (не обладает избыточной энергией), то его электроны занимают наиболее низкие по энергии орбитали. Энергия электрона в многоэлектронных атомах зависит не только от его притяжения к ядру, но и от отталкивания от других электронов. Взаимное влияние приводит к тому, что энергия электронов зависит не только от главного, но и от орбитального квантового числа.
Правила Клечковского
1. Увеличение энергии электронных подуровней идет в порядке увеличения суммы главного и орбитального квантовых чисел (n+l).
2. В случае равенства суммы (n+l) увеличение энергии подуровней идет в порядке увеличения главного квантового числа.
Графически правила Клечковского можно представить в виде:
| n l | 0 | 1 | 2 | 3 |
| 1 | 1 s | |||
| 2 | 2 s | 2 p | ||
 3 3
| 3 s | 3 p | 3 d | |
  4 4
| 4 s | 4 p | 4 d | 4 f |
| 5 | 5 s | 5 p | 5 d | 5 f |

Заполнение электронами орбиталей происходит в следующем порядке: 1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p и т.д.
Принцип Паули
В атоме не может существовать двух электронов с одинаковым набором квантовых чисел. В связи с тем, что каждая электронная орбиталь характеризуется набором трех квантовых чисел (главного, орбитального и магнитного), электроны на одной орбитали могут отличаться только значением спинового квантового числа (ms = ± ½). Следствием принципа Паули является то, что на одной орбитали не может находится более двух электронов.
В связи с вышесказанным на первом энергетическом уровне может максимально находиться два электрона:
| ¯ | или 1 s 2; |
| 1 s |
на втором энергетическом уровне – 8 электронов:
| ¯ | ¯ | ¯ | ¯ | или 2 s 22 p 6 и т.д. | |
| 2 s | 2 p |
Максимальное число электронов на уровне N = 2 n 2, где n – главное квантовое число.
Правило Хунда
Внутри подуровня электроны заполняют орбитали таким образом, чтобы суммарное спиновое квантовое число было максимальным (орбитали подуровня сначала заполняются по одному электрону и только после этого происходит их спаривание).
Например, четыре электрона на р -подуровне можно расположить двумя разными способами:
| ¯ | | | или | ¯ | ¯ | |
| S(ms) = + 1 | S(ms) = 0 | |||||
Так как в первом случае суммарное спиновое число больше, то заполнение электронами р -орбиталей идет именно этим способом.
Электронные формулы атомов и ионов
Число электронов в атоме определяется порядковым номером элемента в периодической системе. Используя правила размещения электронов в атоме, для атома натрия (11 электронов) можно получить следующую электронную формулу:
11 Na: 1 s 22 s 22 p 63 s 1
| ¯ | ¯ | ¯ | ¯ | ¯ | | |||
| 1 s | 2 s | 2 p | 3 s |
Электронная формула атома титана:
22Ti: 1s22s22p63s23p64s23d2
| ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | | | |||||||||
| 1 s | 2 s | 2 p | 3 s | 3 p | 4 s | 3 d | ||||||||||||||
Если до полного или половинного заполнения d -подуровня (d 10 или d 5-конфигурации) не хватает одного электрона, то происходит «проскок электрона» - переход на d -подуровень одного электрона с соседнего s -подуровня. В результате электронная формула атома хрома имеет вид 24Cr: 1s22s22p63s23p64s13d5, а не 24Cr: 1s22s22p63s23p64s23d4, а атома меди – 29Cu: 1s22s22p63s23p64s13d10, а не 29Cu: 1s22s22p63s23p64s23d9.
Число электронов в отрицательно заряженном ионе – анионе – превышает число электронов нейтрального атома на величину заряда иона: 16 S 2– 1s22s22p63s23p6 (18 электронов).
При образовании положительно заряженного иона – катиона – электроны прежде всего уходят с подуровней с большим значением главного квантового числа: 24Cr3+: 1s22s22p63s23p64s03d3 (21 электрон).
Электроны в атоме можно разделить на два типа: внутренние и внешние (валентные). Внутренние электроны занимают полностью завершенные подуровни, имеют низкие значения энергии и не участвуют в химических превращениях элементов.
Валентные электроны – это все электроны последнего энергетического уровня и электроны незавершенных подуровней.
Валентные электроны принимают участие в образовании химических связей. Особую активность имеют неспаренные электроны. Число неспаренных электронов определяет валентность химического элемента.
Если на последнем энергетическом уровне атома имеются пустые орбитали, то возможно распаривание на них валентных электронов (образование возбужденного состояния атома).
Например, валентные электроны серы - это электроны последнего уровня (3 s 23 p 4). Графически схема заполнения электронами этих орбиталей имеет вид:
| 16S | ¯ | ¯ | | | |||||||
| 3 s | 3 p | 3 d |
В основном (невозбужденном) состоянии атом серы имеет 2 неспаренных электрона и может проявлять валентность II.





 Электронные оболочки
Электронные оболочки
