Гидролизом соли называетсявзаимодействие ионов соли с молекулами воды, сопровождающееся изменением рН раствора. Гидролиз протекает только тогда, когда при взаимодействии ионов и воды образуются малодиссоциированные вещества. Известны следующие виды гидролиза солей.
1. Гидролиз по аниону.
В этом случае гидролизуются соли сильного основания и слабой кислоты, при этом реакция среды становится щелочной (рН > 7). Например
СН3СООNa ® СН3СОО – + Na+;
Na+ + HOH®реакция практически не идет;
СН3СОО – + HOH Û СН3СООН + ОН –,рН > 7.
Молекулярное уравнение гидролиза
СН3СООNa + HOH Û СН3СООН + NaОН.
Если анион многозарядный, то гидролиз протекает ступенчато, например
Na2CO3 + HOH Û NaHCO3 + NaOH;
I ступень гидролиза: CO 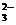 + HOH Û HCO
+ HOH Û HCO  + OH –;
+ OH –;
II ступень гидролиза: НCO  + HOH Û H2CO3 + NaOH.
+ HOH Û H2CO3 + NaOH.
Накапливающиеся в растворе ионы ОН –препятствуют протеканию II ступени гидролиза, поэтому практически гидролиз идет только по I ступени.
2.Гидролиз по катиону.
В этом случае гидролизуются соли слабого основания и сильной кислоты, при этом реакция среды становится кислой (рН < 7). Например
(NH4)2SO4 ® 2NH4+ + SO  ;
;
SO  + HOH ® реакция практически не идет;
+ HOH ® реакция практически не идет;
NH4+ + HOH Û NH4OH + H+, рН < 7.
Молекулярное уравнение гидролиза
(NH4)2SO4 + HOH Û NH4OH + NH4HSO4 .
Гидролиз не доходит до конца, так как накопление в растворе ионов водорода препятствует образованию свободной кислоты.
3. Гидролиз по катиону и аниону одновременно.
Такому виду гидролиза подвергаются соли слабого основания и слабой кислоты. В реакции участвуют и катион, и анион соли. Реакция среды определяется относительной силой образующихся слабой кислоты и слабого основания. Если K Д (кислоты) > K Д (основания), то рН < 7; если K Д (кислоты)) < K Д (основания), то рН > 7, а когда K Д (кислоты) = K Д (основания), то рН» 7. Например
NH4COOH + HOH Û NH4OH + HCOOH, рН = 7,
так как K Д(HCOOH) = K Д(NH4OH) = 1,76 × 10-5.
4. Необратимый полный гидролиз.
Если кислота и основание, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием газообразных продуктов, то гидролиз, как правило, протекает практически необратимо, например
Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S ;
2Al3+ + 3S2– + 6HOH ® 2Al(OH)3¯ + 3H2S .
Количественно гидролиз соли характеризуется степенью гидролиза h и константой гидролиза K г.
Степень гидролиза h показывает,какая часть соли находится в гидролизованном состоянии и выражается в долях единицы или в процентах
h = С г/ С 2, (51)
где С г – концентрация гидролизованной части соли; С 2– общая концентрация растворенной соли.
Расчет константы гидролиза K г и степени гидролиза h следует вести по формулам:
1) гидролиз по аниону
K г =  , h =
, h =  =
=  , (52)
, (52)
где K кислоты – константа диссоциации слабой кислоты.
Если гидролиз протекает ступенчато, то в выражение для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени.
Концентрация ионов ОН– и рН раствора соли могут быть вычислены по формулам
[ОН–] =  = h × С 2 , (53)
= h × С 2 , (53)
рН = 14 – рОН = 14 + lg  . (54)
. (54)
2) гидролиз по катиону
K г =  , h =
, h =  =
=  , (55)
, (55)
где K осн – константа диссоциации слабого основания.
[H+] =  = h × С 2 , (56)
= h × С 2 , (56)
рН = –lg[H+] = –lg  . (57)
. (57)
3 ) гидролиз по катиону и аниону одновременно:
K г =  . (58)
. (58)
Для этого случая концентрация раствора соли практически не влияет на степень гидролиза
h = 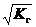 . (59)
. (59)
[H+] =  , (60)
, (60)
рН = –lg  . (61)
. (61)
Примеры решения задач
Пример 1. Определите характер среды водного раствора бората натрия.
Р е ш е н и е
Гидролиз соли, образованной сильным основанием NaOHи слабой многоосновной кислотой H3BO3 определяется ступенчатым характером диссоциации борной кислоты и обратного процесса – соединения ионов BO 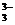 с ионами Н+.
с ионами Н+.
Процесс гидролиза бората натрия можно выразить уравнениями:
I ступень: ВO 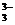 + HOH Û HВO
+ HOH Û HВO 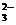 + OH– ;
+ OH– ;
II ступень: НВO 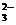 + HOH Û H2ВO
+ HOH Û H2ВO  + OH– ;
+ OH– ;
III ступень: H2ВO  + НOH Û H3BO3 + OH– .
+ НOH Û H3BO3 + OH– .
Как правило, гидролиз заканчивается на I ступени. Тогда молекулярное уравнение гидролиза имеет вид:
Na3BO3 + HOH Û Na2НBO3 + NaOH, рН > 7(среда щелочная).
Пример 2. В какую сторону сместится гидролитическое равновесие при смешивании растворов карбоната натрия и сульфата алюминия?
Р е ш е н и е
Al2(SO4)3 + 3Na2CO3 + 6HOH ® 2Al(OH)3¯ + 3H2O + 3CO2 + 3Na2SO4 .
В результате смешивания растворов катионы Н+, образующиеся при гидролизе Al2(SO4)3, соединяются с анионами ОН–, образующимися при гидролизе Na2CO3, что приводит к смещению равновесия реакции в сторону образования продуктов гидролиза. Смещение усиливается за счет разложения образующихся молекул Н2CO3 и выделения малорастворимого основания Al(OH)3, поэтому реакция идет практически до конца. В ионной форме уравнение реакции имеет вид
2Al3+ + 3CO + 6HOH ® 2Al(OH)3¯ + 3H2O + 3CO2
Пример 3. Вычислите константу гидролиза, степень гидролиза и рН 0,02 М раствора СН3СООK. К Д(СН3СООН) = 1,8 · 10–5.
Р е ш е н и е
Соль СН3СООKобразована сильным основанием КОНи слабой кислотой СН3СООН. Ионное уравнение гидролиза имеет вид
СН3СОО– + НОН Û СН3СООН + ОН–.
Для расчета константы и степени гидролиза используем формулу (52)
K г =  = 5,56×10-10;
= 5,56×10-10;
h =  = 1,67×10-4.
= 1,67×10-4.
Пример 4. Вычислите константу гидролиза, степень гидролиза и рН 0,2 М раствора K3PO4, если константы диссоциации ортофосфорной кислоты по первой, второй и третьей ступеням соответственно равны
КI = 7,5∙10–3; КII = 6,25∙10–8; КIII = 2,2∙10–13.
Р е ш е н и е
Соль K3PO4образована сильным основанием КОНи слабой кислотой H3PO4. Так как гидролиз преимущественно протекает по первой ступени, тогда молекулярное и ионное уравнение гидролиза имеют вид
K3PO4 + Н2O Û K2HPO4 + KОН
PO43– + Н2O Û HPO42– + ОН–
Для расчета константы гидролиза берем константу диссоциации ортофосфорной кислоты по третьей ступени
K г = 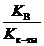 =
=  = 4,55×10–2.
= 4,55×10–2.
Степень гидролиза рассчитываем по формуле (52)
h =  =
= 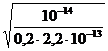 = 0,477.
= 0,477.
Концентрацию гидроксид ионов оценим по уравнению (53)
[ОН–] = h × С 2 = 0,477×0,2 = 9,53×10–2.
рН раствора вычислим по формуле (54)
рН = 14 + lg  = 14 + lg
= 14 + lg 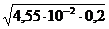 = 12,98.
= 12,98.
Список литературы
1. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. – М.: ООО «Дрофа», 2002.
2. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. – Мн.: Унiверсiтэцкае, 1996.
3. Задачи по общей и неорганической химии: Учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; Под ред.
Р.А. Лидина. – М.: Гуманитар. изд. центр ВЛАДОС, 2004.
4. Задачи и упражнения по общей химии: Учеб. пособие / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; Под ред. Н.В. Коровина. – М.: Высш. шк., 2003.
5. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. – М.: Высш. шк., 2004.
6. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.И. Лещинская, В.А. Суханова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1991.
7. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для вузов. – М.: Интеграл-Пресс, 2001.
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Высш. шк., 1991.
9. Литвинова Т. Н., Сборник задач по общей химии: Учеб. пособие для вузов. – 3-е изд., перераб. - М.: ООО «Издательство Оникс»: ООО «Издательство «Мир и Образование», 2007. – 224 с.
Содержание
Введение.................................................................................................... 3
Растворимость. Способы выражения состава растворов...................... 3
Краткие теоретические сведения........................................................... 3
Примеры решения задач....................................................................... 6
Разбавленные растворы неэлектролитов................................................. 11
Краткие теоретические сведения........................................................... 11
Примеры решения задач....................................................................... 13
Растворы электролитов............................................................................ 15
Краткие теоретические сведения........................................................... 15
Примеры решения задач....................................................................... 18
Ионное произведение воды. Буферные растворы................................... 21
Краткие теоретические сведения........................................................... 21
Примеры решения задач....................................................................... 22
Произведение растворимости.................................................................. 26
Краткие теоретические сведения........................................................... 26
Примеры решения задач....................................................................... 27
Гидролиз солей......................................................................................... 30
Краткие теоретические сведения........................................................... 30
Примеры решения задач....................................................................... 32
Литература................................................................................................ 34






