ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общих математических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(Для студентов заочной формы обучения)
Часть 3
Учебно-методическое пособие
Специальности: 240301 Химическая технология
неорганических веществ; 280201 Охрана окру-
жающей среды и рациональное использование
природных ресурсов; 240801 Машины и аппара-
ты химических производств
Череповец
2007
Примеры решения задач по дисциплине «Общая и неорганическая химия» для студентов заочной формы обучения: В 3 ч. Ч. 3: Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2007. – 35 с.
Рассмотрено на заседании кафедры химии, протокол № 9 от 14.05. 07.
Одобрено редакционно-издательской комиссией факультета общих математических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 8 от 15.05. 07.
Составители: О.А. Калько – канд. техн. наук, доцент;
Ю.С. Кузнецова;
Н.В. Кунина
Рецензенты: С. Н. Балицкий – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Л.Ю. Кудрявцева – канд. техн. наук, доцент (ГОУ ВПО ЧГУ)
Научный редактор: Г.А. Котенко – канд. хим. наук, профессор
© Калько О.А., Кунина Н.В.,
Кузнецова Ю.С., 2007
©ГОУ ВПО Череповецкий государст-
 венный университет, 2007
венный университет, 2007
ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по теме «Растворы» курса «Общая и неорганическая химия». Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства для самостоятельной работы при выполнении домашних контрольных работ. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
РАСТВОРИМОСТЬ. СПОСОБЫ ВЫРАЖЕНИЯ
СОСТАВА РАСТВОРОВ
Краткие теоретические сведения
Раствор – однофазная гомогенная система, состоящая из двух или более компонентов, а также продуктов их взаимодействия, состав которой может непрерывно меняться в пределах, ограниченных взаимной растворимостью веществ.
Вещество называют растворителем, если при образовании раствора оно не меняет своего агрегатного состояния, остальные компоненты раствора считают растворенными веществами. В случае, когда все компоненты при образовании раствора остаются в том же агрегатном состоянии, растворителем является компонент, которого в системе больше.
Растворимостью называют, как способность вещества образовывать раствор с данным растворителем, так и количественную характеристику этой способности. Качественно растворимость характеризуется понятиями «хорошо растворимо», «мало растворимо», «нерастворимо». Количествен-ной мерой растворимости является масса вещества в граммах, которая способна раствориться в 100 г растворителя при данной температуре с образованием насыщенного раствора.
Раствор называется насыщенным, если в нем находится предельное при данных условиях количество растворенного вещества. Если в растворе содержится больше растворенного вещества, чем это определяется растворимостью, раствор называется пересыщенным, а если меньше – ненасыщенным.
Важнейшей характеристикой раствора является количественное содержание растворенных веществ. На практике состав раствора принято выражать с помощью следующих величин:
1. Массовая доля растворенного вещества w2 (иначе процентная массовая концентрация) – отношение массы растворенного вещества m 2 к массе раствора m
 (1)
(1)
Здесь и далее у величин, относящихся к растворителю, применяется индекс «1», индекс «2» относится к растворенному веществу, а отсутствие индекса указывает на свойство раствора как целого.
Это безразмерная величина, выраженная в долях единицы или в процентах, % масс. Таким образом, w2 показывает, сколько грамм растворенного вещества содержится в ста массовых частях раствора.
2. Моляльная концентрация вещества С m (иначе моляльность раствора) – отношение числа моль растворенного вещества n 2 к массе растворителя m 1 в килограммах
 , (2)
, (2)
где М 2 – молярная масса растворенного вещества, г/моль.
Если массу растворителя выражать в граммах, то для расчета моляльности следует пользоваться формулой
 . (3)
. (3)
Данный способ выражения состава раствора показывает, сколько моль растворенного вещества содержится в 1 кг растворителя. Его единицы измерения – моль/кг.
3. Молярная концентрация вещества С 2 (иначе молярность раствора) – отношение числа моль растворенного вещества к объёму раствора V в дм3 (иначе в литрах)
 . (4)
. (4)
Она показывает, сколько моль растворенного вещества содержится в 1 дм3 раствора. Единицы измерения – моль/дм3 или М.
4. Молярная концентрация эквивалента вещества С 2  (иначе нормальность раствора, нормальная концентрация или эквивалентная концентрация) – отношение числа моль эквивалентов растворенного вещества n 2
(иначе нормальность раствора, нормальная концентрация или эквивалентная концентрация) – отношение числа моль эквивалентов растворенного вещества n 2  к объёму раствора в дм3
к объёму раствора в дм3
 , (5)
, (5)
где М 2  – молярная масса эквивалента растворенного вещества, г/моль; z – число эквивалентности растворенного вещества.
– молярная масса эквивалента растворенного вещества, г/моль; z – число эквивалентности растворенного вещества.
Нормальность раствора показывает, сколько моль эквивалентов растворенного вещества содержится в 1 дм3 раствора. Единицы измерения –моль/дм3 или н.
Взаимосвязь между молярной и нормальной концентрациями одного и того же растворенного вещества выражается соотношением
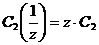 . (6)
. (6)
То есть, эквивалентная концентрация в z раз больше молярной концентрации.
5. Титр раствора Т – масса растворенного вещества в граммах, которая содержится в одном см3 (иначе 1 мл) раствора
 . (7)
. (7)
Единицы измерения данного способа выражения состава раствора –г/мл или г/см3.
6. Мольная доля растворенного вещества х 2 – отношение числа моль растворенного вещества к общему числу моль всех компонентов раствора n
 . (8)
. (8)
Это безразмерная величина, выраженная в долях единицы.
Общее правило, используемое для приготовления разбавленных растворов из концентрированных: при одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу:
w1 × m 1 = w2 × m 2, (9)
где m 1(m 2) – масса исходного (конечного) раствора. Если массу раствора представить через его плотность и объем, то формула (9) примет вид
ω1 · ρ1 · V 1= ω2 · ρ2 · V 2, (10)
где V 1(V 2) – объем исходного (конечного) раствора; r1 (r2) – плотность исходного (конечного) раствора.
Если раствор получают путем смешивания двух растворов с различной концентрацией одного и того же растворенного вещества, то содержание растворенного вещества в конечном растворе можно определить с помощью правила смешивания: массы смешиваемых растворов m 1 и m 2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3
m 1 / m 2 = (w3 – w2) / (w1 – w3). (11)
При использовании правила смешивания применяют так называемое правило креста (иначе квадрат Пирсона):
w1 w3 – w2 m 1
w3
w2 w1 – w3 m 2
m 1 / m 2 = (w3 – w2) / (w1 – w3)
Пояснение: по диагонали из большей концентрации вычитают меньшую, получают (w1 – w3), так какw1 >  w3, и (w3 – w2), так как w3 >
w3, и (w3 – w2), так как w3 >  w2. Затем составляют отношение масс исходных растворов m 1 / m 2.
w2. Затем составляют отношение масс исходных растворов m 1 / m 2.
Если при сливании двух растворов, содержащих различные по природе растворенные вещества, между ними происходит химическое взаимодействие, то по закону эквивалентов вещества реагируют в количествах, пропорциональных их эквивалентам. Например, для процесса взаимодействия кислоты с основанием будет выполняться соотношение
 . (12)
. (12)
Примеры решения задач
Пример 1. Растворимость KClO3 при 20 °С равна 7,3 г/100 г воды, а при 100 °C – 56,2 г/100 г воды. Какая масса хлората калия выкристаллизуется из 50,0 г раствора данной соли насыщенного при 100 °C, если раствор охладить до 20 °C?
Р е ш е н и е
При охлаждении раствора масса воды, остается постоянной, а масса растворенного вещества, а значит, и масса раствора в целом, меняются. Из определения растворимости следует, что при 100 °C раствор содержит 100,0 г воды и 56,2 г KClO3. Масса такого раствора составляет (100 + 56,2) = 156,2 г. По пропорции определяем массу воды в 50 г раствора
156, 2 г раствора — 100,0 г Н2О;
50,0 г раствора — m 1 г Н2О;
Откуда m 1 = 32,0 г Н2О.
Тогда масса соли в 50,0 г горячего раствора равна: (50,0 – 32,0) = 18,0 г.
По значению растворимости при 20 °C определяем, сколько соли будет растворено в 32 г воды
в 100 г Н2О — 7,3 г KClO3;
в 32,0 г Н2О — х 1 г KClO3;
Откуда m 2 = 2,3 г KClO3.
Тогда масса KClO3, выкристаллизовавшаяся после охлаждения раствора, равна (18,0 – 2,3) = 15,7 г.
Пример 2. Рассчитайте массовую долю и моляльную концентрацию глюкозы в растворе, полученном путем растворения 25 г глюкозы (С6Н12О6) в 100 см3 воды.
Р е ш е н и е
Находим массу раствора, считая плотность воды равной 1 г/см3
 .
.
Тогда по формуле (1)  .
.
Для определения моляльной концентрации раствора найдем молярную массу глюкозы
М 2(С6Н12О6) = 12·6 + 1·12 + 6·16 = 180 г/моль.
Тогда по формуле (3)  .
.
Пример 3. В дистиллированной воде объёмом 250 мл растворили кристаллогидрат FeSO4 ·7H2О массой 50 г. Определите массовую долю кристаллогидрата и безводного сульфата железа (II) в растворе.
Р е ш е н и е
Найдем массу раствора, считая плотность воды равной 1 г/мл
 .
.
Тогда по формуле (1) массовая доля кристаллогидрата FeSO4 ·7H2О
 .
.
Определяем молярную массу безводного сульфата железа (II) и молярную массу кристаллогидрата
М 2(FeSO4) = 56 + 32 + 16·4= 152 г/моль;
М 2(FeSO4 ·7H2О) = 152 + 7·18 = 278 г/моль.
Массу безводной соли в 50 г FeSO4 ·7H2О определяем по пропорции
1 моль (278 г) FeSO4 ·7H2О содержит 1 моль (152 г) FeSO4 ;
50 г FeSO4 ·7H2О содержит m 2 г FeSO4 ;
Откуда 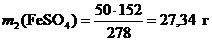 .
.
Массовая доля безводной соли FeSO4 в 300 г раствора равна

Пример 4. Вычислите массовую долю (% масс.), молярную и молярную эквивалентную концентрации растворенного вещества, а также определите моляльность и титр раствора, полученного при растворении 18 г фосфата калия в 250 см3 воды, если плотность раствора r = 1,31 г/см3 = = 1310 г/дм3.
Р е ш е н и е
Находим массу раствора, считая плотность воды равной 1 г/см3
 .
.
Тогда по формуле (1)  .
.
Определяем молярную массу растворенного вещества
М 2(К3РO4) = 3∙39 + 31 + 4∙16 = 212 г/моль.
Молярную концентрацию находим по формуле (4)
 .
.
Для расчета молярной концентрации эквивалента вещества используем формулу (6)
 ,
,
где 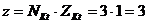 ; N Kt – число катионов в 1 молекуле соли; Z Kt – заряд катиона соли.
; N Kt – число катионов в 1 молекуле соли; Z Kt – заряд катиона соли.
Рассчитываем моляльную концентрацию раствора по формуле (3)
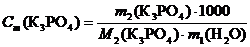
 .
.
Вычисляем титр раствора по формуле (7)
 .
.
Пример 5. Определите мольную долю сульфата алюминия в растворе с концентрацией 10 % масс.
Р е ш е н и е
Определяем молярные массы компонентов раствора
М 2(Al2(SO4)3) = 2∙27 + 3∙(32 + 16·4) = 342 г/моль;
М 1(H2О) = 18 г/моль.
По условию w2(Al2(SO4)3) = 10 % масс., значит в 100 г раствора содержится 10 г соли и 90 г воды. Тогда по формуле (8)
 .
.
Пример 6. Рассчитайте массовый процент Al2(SO4)3 в растворе с мольной долей соли х 2 = 0,25.
Р е ш е н и е
Пусть общее количество раствора n = 1 моль, тогда мольная доля растворенного вещества будет равна числу моль данного компонента в растворе
 .
.
Число моль растворителя определяем по формуле
 .
.
Рассчитаем массы веществ, которые содержатся в 1 моль раствора
 ;
;  .
.
Массовый процент Al2(SO4)3 в растворе равен

Пример 7. Рассчитайте, какой объём 2,5 %-ного раствора КMnO4 и воды нужно взять для приготовления 40 мл 0,05 %-ного раствора. Плотность 0,05 %-ного раствора равна 1,003 г/мл, а 2,5 %-ного – 1,017 г/мл.
Р е ш е н и е
Примем обозначения для величин, указанных в условии задачи:
Исходный раствор: w1 = 2,5 % масс.; r1 = 1,0175 г/мл; V 1 –?;
Конечный раствор: w2 = 0,05 % масс.; r2 = 1,003 г/мл; V 2 = 40 мл.
Приготовление раствора с концентрацией 0,05 % масс. из раствора с концентрацией 2,5 % масс. происходит путем разбавления последнего чистым растворителем, то есть водой, поэтому используем формулу (10). Из которой выражаем V 1

Объем воды найдем по формуле, считая плотность воды r(Н2О) = 1 г/мл
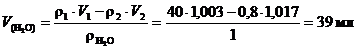 .
.
Пример 8. Сколько граммов 90 %-ного и 10 %-ного раствора серной кислоты необходимо взять для приготовления 800 г 40 %-ного раствора?
Р е ш е н и е
Пользуясь правилом смешивания (иначе правилом креста), определяем соотношение весовых частей, в которых необходимо смешать 90 %-ный. и 10 %-ный растворы серной кислоты, чтобы получить 40 %-ный раствор по формуле (11)
m 1 / m 2 = (w3 – w2) / (w1 – w3) = (40 – 10) / (90 – 40) = 3/5.
Таким образом, исходные растворы серной кислоты необходимо смешать в соотношении 3: 5.
По условию задачи необходимо получить 800 г 40 %-ного раствора серной кислоты. Поэтому 800 г делим на две части пропорциональные полученному отношению
 ;
;  .
.
Следовательно, необходимо взять 300 г 90 %-ного и 500 г 10 %-ного раствора серной кислоты.
Пример 9. Какой объем 0,52 М раствора гидроксида натрия потребуется для нейтрализации 15,45 см3 раствора серной кислоты с массовой долей 3 % масс. и плотностью 1,018 г/см3.
Р е ш е н и е
Объем гидроксида натрия следует находить по закону эквивалентов. Для этого необходимо пересчитать концентрацию раствора серной кислоты из % масс. в нормальность.
Находим массу раствора кислоты, используя объем и плотность
 .
.
Тогда из формулы (1) найдем массу серной кислоты
 .
.
Определяем молярную массу эквивалента серной кислоты
М 2( Н2SO4) =
Н2SO4) =  .
.
По формуле (5) определяем нормальность раствора Н2SO4
 .
.
По формуле (6) определяем нормальность раствора гидроксида натрия
 .
.
Объем NaOH найдем по формуле (12)
 .
.
Пример 10. Какое количество (см3) потребуется для приготовления 0,1 дм3 раствора серной кислоты с концентрацией 3,55 н из 96 %-ного Н2SO4 плотностью r = 1,836 г/см3.
Р е ш е н и е
Массу Н2SO4, содержащуюся в растворе найдем из формулы (5)
 ;
;
 .
.
Объем 96 %-ного раствора серной кислоты, необходимый для приготовления 0,1 дм3 3,55 н раствора найдем из формулы (1)
 .
.






