Група піридину. Найважливішим представником шестичленних гетеро циклів з одним гетеро атомом є піридин – шестичленний гетероцикл з одним атомом азоту.

Безбарвна рідина з характерним неприємним запахом. Без обмежень змішується з водою та практично з усіма органічними розчинниками. З водою (41,3 мас%) утворює азеотропну суміш з температурою кипіння 93,6 °C. Піридин вперше був виділений з кісткової олії (Т. Андерсон, 1849 р.), яка утворюється при піролізі кісток. У 1854 р. його виділили з кам'яновугільної смоли, але наразі практично весь промисловий обсяг піридину виробляється синтетично, – взаємодією оцтового альдегіду, формальдегіду та аміаку. В наш час піридин і його гомологи добувають з кам'яновугільної смоли і синтетично, оскільки вміст піридинових основ у кам'яновугільній смолі незначний (менше 0,1 %). Піридин, наприклад, добувають піролізом суміші ацетилену з синильною кислотою:
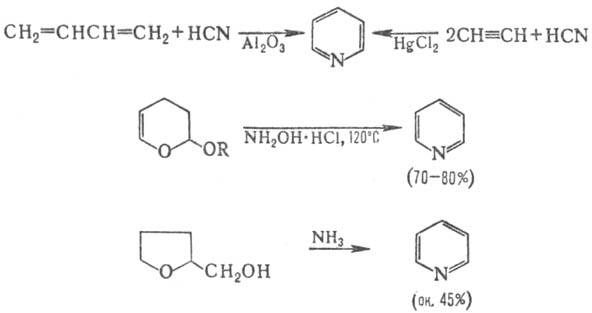
Гомологи піридину синтезують конденсацією карбонільних сполук з аміаком. Так, при нагріванні акролеїну з аміаком утворюється b-піколін, а з оцтового альдегіду і аміаку – 2-метил-5-етилпіридин:
 ,
, 
Піридин і його гомологи називають піридиновими основами. Піридин чудовий розчинник, особливо для процесів за участю неорганічних солей та для екстракції антибіотиків. Однак головним чином піридин є сировиною для виробництва лікарських засобів, гербіцидів, інсектицидів та інших агрохімічних препаратів.
Структура піридину дуже подібна до структури бензолу. Встановлено, що молекула піридину, як і молекула бензолу, плоска. Проте піридинове ядро, на відміну від бензольного, не є рівностороннім шестикутником, тому що довжина зв'язків С–С (0,139 нм) і С–N (0,134 нм) у молекулі піридину не однакова. Крім того, азот більш електронегативний, ніж вуглець, і молекула піридину, на відміну від молекули бензолу, полярна.
Як і бензол, він містить шість p-електронів, які утворюють загальну p-електронну хмарку, що обумовлює велику стійкість піридину. Подібно до бензолу піридин важко окислюється; водні піридинового ядра здатні заміщуватися нітрогрупою, сульфогрупою і галогенами, хоча ці реакції йдуть значно важче, ніж з бензолом; на відміну від бензолу він дуже важко нітрується.
Фізичні і хімічні властивості. Піридин і його найближчі гомологи – безбарвні рідини з неприємним запахом, розчинні у воді, досить отруйні. Температура кипіння піридину дорівнює 115,6°С, тобто дещо вища, ніж бензолу.
Піридин, як і бензол, має замкнену електронну систему із секстету p-електронів. Завдяки ньому він має ароматичні властивості і вступає, як і бензол, у реакції заміщення і приєднання.
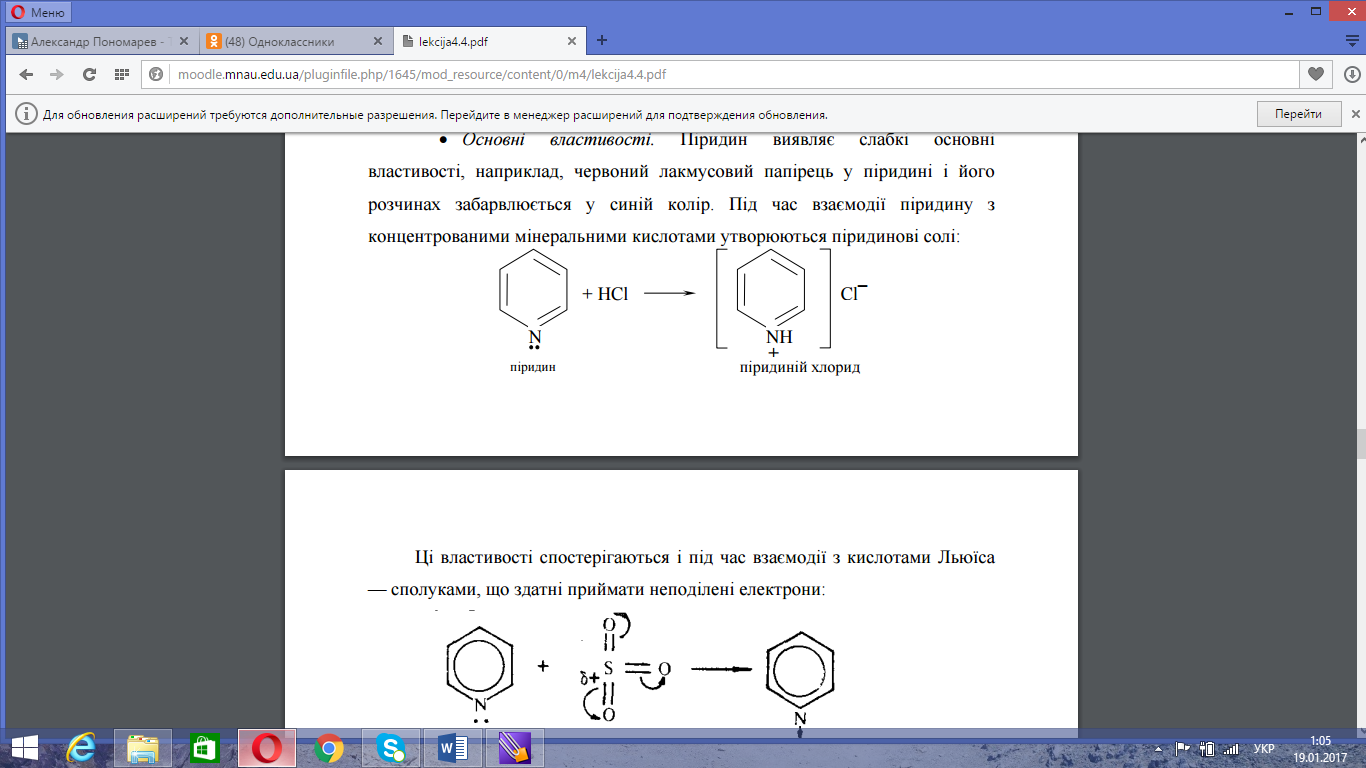
1. Основні властивості.
Піридин є слабкою основою. Тому червоний лакмусовий папірець в піридині забарвлюється у синій колір. При взаємодії з концентрованими мінеральними кислотами утворює піридинієві солі:
2. Реакції заміщення. Атоми водню піридинового ядра можуть заміщуватись як електрофільними, так і нуклеофільними частинками.
Електрофільне заміщення. Внаслідок дезактивуючої дії гетероатома електрофільне заміщення в піридинах здійснюється дуже повільно. У кислому середовищі кільце ще більше дезактивується, оскільки утворюється йон піридинію, в якому наявність позитивного заряду на атомі Нітрогену ускладнює електрофільне заміщення.
Піридин досить важко і в жорстких умовах вступає в SЕ-реакції, а в реакцію ацилування за методом Фріделя-Крафтса зовсім не вступає (подібно до нітробензолу).
Піридин бромується тільки при сильному нагріванні і наявності активованого вугілля і утворює при цьому 3-бромпіридин. Сульфування піридину також здійснюється під час тривалого нагрівання його з 20 %-м олеумом при наявності каталізатора (солі Hg2+). При цьому утворюється 3-піридин-сульфокислота (вихід ~70%). Нітрування піридину відбувається під час його нагрівання з сумішшю селітри з концентрованою Н2SO4 і призводить до утворення з невисоким виходом (~20 %) 3-нітропіридину, який при відновленні може перетворюватись у 3-амінопіридин:

Нуклеофільне заміщення. Зменшення електронної густини піридинового ядра полегшує нуклеофільне заміщення в ньому. Тому піридин, на відміну від бензолу, досить легко реагує з нуклеофільними реагентами. Нуклеофільне заміщення (SN-реакції) здійснюється в положення 2, 4 і 6 піридинового ядра, в яких електронна густина найменша. Реакційна здатність піридину в SN-реакціях настільки висока, що під час їх перебігу в піридиновому ядрі заміщується гідрид-аніон:Н-. Найважливішими SN-реакціями піридину є його взаємодія з амідом натрію і з порошкоподібним КОН.
Піридин при нагріванні з амідом натрію утворює 2-амінопіридин (Тпл = 57°С, реакція Чичибабіна):
 .
.
При нагріванні піридину з порошкоподібним КОН при 250 – 300°С утворюється 2-оксипіридин (О.Є. Чичибабін):

Отже, висока електронегативність атома азоту зумовлює малу реакційну здатність піридину в реакціях електрофільного заміщення і високу активність у реакціях нуклеофільного заміщення.
Реакції приєднання. Піридин, подібно до бензолу, може приєднувати водень. Проте, на відміну від бензолу, він гідрується воднем у момент виділення (гідрування за методом О.М. Вишнеградського) і перетворюється при цьому на гексагідропіридин (піперидин, Ткип = 106 °С):
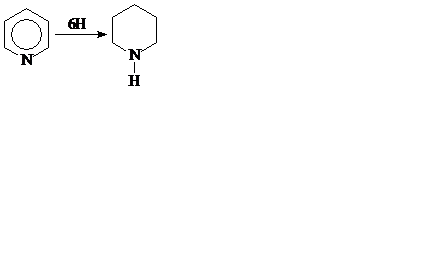
Піперидин – рідина з характерним запахом, виявляє сильні основні властивості.
Реакції окислення. Піридинове ядро, подібно до бензольного, стійке до окислення. Піридин, як і бензол, не знебарвлює розчин КМnO4, а b-піколін, подібно до толуолу, окислюється КМnO4 до b-піридинкарбонової, або нікотинової кислоти:

Біологічне і фармакологічне значення похідних піридину. Багатопохідних піридину є фізіологічно активними речовинами.
Наприклад, вітамін РР (В5), або нікотинамід, є амідом b-піридинкарбонової (нікотинової) кислоти. Цей вітамін запобігає розвитку пелагри і є складовою частиною небілкових компонентів ряду ферментів, що каталізують окислювально-відновні процеси в організмах. Відсутність нікотинової кислоти в організмі спричиняє захворювання шкіри пелагру.
Похідне цієї ж кислоти – її діетиламід під назвою кордіамін використовують як засіб, що збуджує серцеву діяльність.
Ядро піридину складає основу вітавміну В6. Вітамін B6 – загальна назва трьох речовин: піридоксина, пірідоксаля, піридоксаміна, а також їх фосфатів, серед яких найбільш важливий пірідоксальфосфат. Вітамін B6 міститься в рослинах. Відсутність його в організмі призводить до захворювань шкіри, ураження нервової системи, порушення кровотворення. Ефір піридоксалю з фосфорною кислотою входить до складу ряду ферментів, які каталізують перебіг окремих груп реакцій перетворення амінокислот в організмі, а також біосинтез пуринових основ та гемоглобіну.
Ядро гідрованого піридину (піперидину) входить до складу деяких алкалоїдів, зокрема алкалоїду перцю – піперину (від лат. рурег – перець), алкалоїду рослини болиголова – коніїну та інших.
Найважливішим алкалоїдом групи піридину є нікотин. Міститься в листі тютюнових рослин. Дуже отруйний (смертельна доза від 30 до 60 мг). У малих дозах збуджує нервову систему (підвищує тиск за рахунок звуження кровоносних судин). Нікотин – сильна отрута для комах, тому використовується в с/г як інсектицид.
Коніїн міститься в рослині болиголова, дуже отруйний. У стародавніх Афінах смертельний вирок виконували з допомогою водної витяжки з цієї рослини. Від неї ж загинув Сократ.
Група індолу. Індол, або бензопірол, являє собою конденсовану систему, яка складається з ядер бензолу і піролу.
Індол досить поширений у природі, міститься в запашному маслі жасмину і деяких інших квітів, кам’яновугільному дьогті, фекаліях. Вперше індол був добутий у 1865 p. німецьким хіміком А. Байєром при сухій перегонці індиго в присутності цинкового пилу, звідки і дістав свою назву. Синтетично індол можна добути за методом О.Є. Чичибабіна, розробленим у 1915 p., пропусканням пари аніліну з ацетиленом через трубку, нагріту до 600 – 700°С.
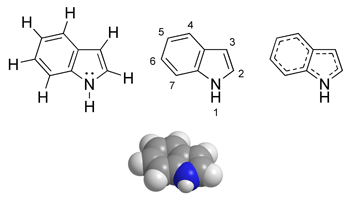

Індол – кристалічна речовина світло-жовтого кольору, розчиняється в гарячій воді і багатьох органічних розчинниках. За хімічними властивостями індол дуже подібний до піролу: забарвлює в червоний колір соснову тріску, змочену соляною кислотою, швидко темнішає на повітрі внаслідок окислення, осмолюється кислотами. Індол майже не виявляє основного характеру; навпаки, атом водню, зв’язаний з азотом, може заміщуватися на метал, наприклад при сплавленні з лугами.
Індол застосовують у парфумерії для надання одеколонам освіжаючого квіткового запаху. Індольне ядро лежить в основі індиго і індигоїдних барвників, а також входить до складу деяких алкалоїдів, наприклад стрихніну. Похідні індолу містять замісники як у бензольному, так і в пірольному ядрі.
Багато похідних індолу, наприклад скатол, триптофан, гетероауксин та ін., мають велике біологічне значення.
Скатол, або 3-метиліндол, утворюється в кишечнику внаслідок розкладу триптофану який входить до складу білкових речовин. Запах фекалій обумовлений головним чином вмістом у ньому скатолу. Розведений розчин скатолу має приємний запах квітів.
Триптофан, або a-аміно-b-індолілпропіонова кислота, входить до складу багатьох білків. В організмі деяких тварин він є вихідною речовиною для синтезу вітаміну РР – нікотинової кислоти та гормонів серотоніну та мелатоніну. Серотонін – відповідає за психічну діяльність людини. Мелатонін бере участь у регулюванні зміни денного і нічного ритму фізіологічних функцій.
Гетероауксин, або b-індолілоцтова кислота, зустрічається в розчинах як продукт окисного дезамінування амінокислоти триптофану. Вона утворюється також мікроорганізмами – дріжджами, пліснявими грибками, бактеріями. Гетероауксин застосовують як стимулятор росту рослин.
Група хіноліну. Хінолін належить до гетероциклів з конденсованою системою з ядра бензолу і ядра піридину:
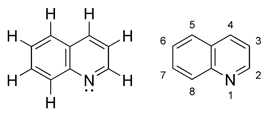

Хінолін – органічна речовина, ароматична гетероциклічна сполука. Молекула складається з двох конденсованих ароматичних шестичленних кілець – бензольного та піридинового. Брутто-формула C9H7N. Хінолін може розглядатися як молекула нафталіну у якій один з вуглеців заміщено на азот. Хінолін – безбарвна, гігроскопічна рідина.
У вільній формі хінолін у природі не зустрічається. Проте хінолінове ядро входить до складу багатьох алкалоїдів.
Методи добування:
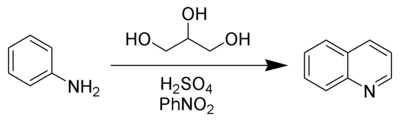
Синтез Скраупа. Синтез хіноліну з аніліну та гліцерину:
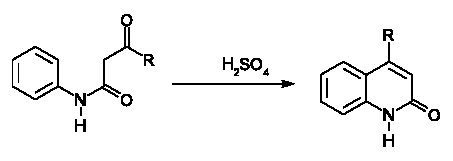
Синтез Кнора – циклізація β-кетоаніліду в 2-гідроксихінодін в присутності сірчаної кислоти:
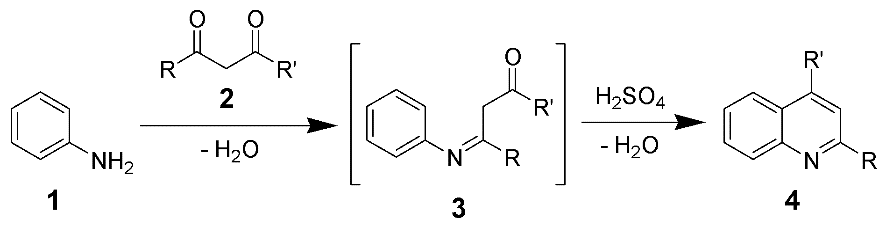
Синтез Комба – конденсація незаміщеного аніліну з β-дикетоном, що протікає через основу Шифа та дає хінолін після циклізації в кислому середовищі:
Деякі похідні хіноліну є алкалоїдами. Більшість з них в клітинах синтезується виходячи з триптофану:

Він міститься в кам’яновугільній смолі і кістковому маслі. Синтетично хінолін та його гомологи добувають синтезом Скраупа – нагріванням суміші гліцерину, аніліну, нітробензолу і сірчаної кислоти.
Фізичні властивості. За нормальних умов хінолін – безбарвна рідина (Тк=237,2 °C, Тпл = –14,8 °C., з високим показником заломлення світла (1,6262 при 21°C і λ=589 нм. Густина 1,10 г/см3На противагу піридину, хінолін погано розчиняється у воді (6г/л при 20 °C). З органічними розчинниками (етанол, ацетон, вуглеводи) хінолін змішується повністю.
Хімічні властивості. Хінолін – слабка основа. Він протонується сильними кислотами по азоту утворюючи солі (скажімо гідрохлорид (C9H7N•HCl). Він важче вступає в реакції електрофільного заміщення та окислення, які переважно протікають в бензольному ядрі. Натомість реакції нуклеофільного заміщення характерні для позицій 2 та 4 піридинового ядра.
Електрофільне заміщення.
Піридинове кільце хіноліну дезактивоване, електрофільне заміщення протікає в положення 5 та 8 бензольного ядра:
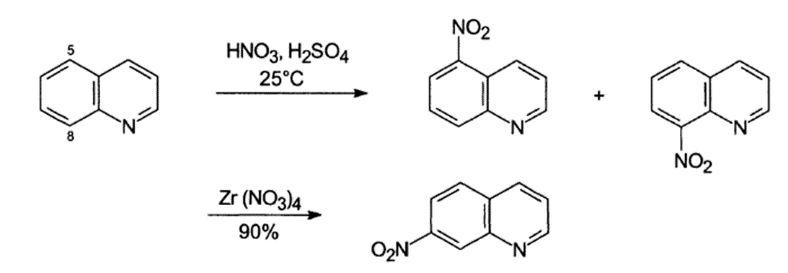
Сульфування олеумом при помірних температурах (90°С) відбувається у позицію 8 (і частково 5), оскільки перехідний стан має нижчу енергію (кінетичний контроль реакції). Натомість при температурі 250 – 300 °C утворюється термодинамічно стабільніший ізомер заміщений по позиції 6. Відносно чистий продукт сульфування по позиції 5 можна отримати проводячи реакцію в присутності сульфату ртуті (ІІ).
Галогенування хіноліну молекулярними галогенами потребує жорстких умов. Бромування в сірчаній кислоті дає 5- та 8-бромхінолін. Виходячи з гідроброміду хіноліну можна провести заміщення по позиції 3.
Нуклеофільне заміщення.
Багато реакцій нуклеофільного заміщення хіноліну протікають аналогічно реакціям піридину, переважно в електронно-дефіцитне положення 2 піридинового кільця. Реакція Чичибабіна (амінування за допомогою аміду калію в рідкому аміаку) протікає в a-положення до азоту.
Хінолін може бути напряму проалкільований бутиллітієм; утворений продукт приєднання по позиції 2 гідролізується водою та легко ароматизується (дегідрується) нітробензолом.
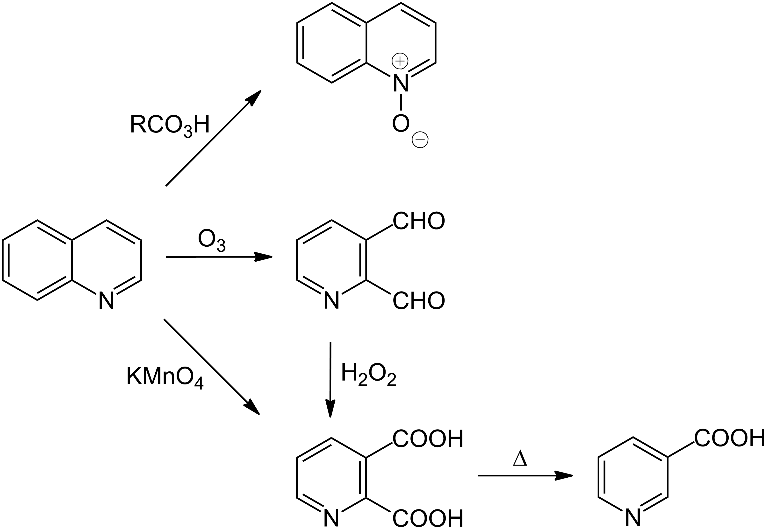
Окислення та відновлення. Хінолін можна окислити парабензойною кислотою в N-оксид (аналог піридин-N-оксиду). При дії KMnO4 (перманганат калію) утворюється хінолінова кислота, MnO2 чи азотна кислота дають той же продукт. Озоноліз хіноліну призводить до утворення піридин-2,3-діальдегіду, який може бути окиснено використовуючи пероксид водню в хінолінову кислоту:
У залежності від умов реакції можна селективно прогідрувати як бензольне так і піридинове кільце хіноліну. Водень в метанолі на платиновому каталізаторі відновлює піридинове ядро. Це ж кільце гідрується ціаноборгідридом натрію, боргідридом натрію, боргідридом цинку в присутності хлориду нікелю (ІІ). Селективне гідрування бензольного ядра можливе в сильнокислому середовищі (H2/Pt). (або TFA/PtO2/H2) При дещо жорсткіших умовах і тривалішому проведенні реакції можна досягти повного гідрування подвійних зв'язків. Літійалюмогідрид може відновити хінолін до 1,2-дигідрохіноліну. В той же час обробка літієм в рідкому аміакові дає 1,4- та/чи 3,4-дигідрохінолін. Останні сполуки легко вступають в подальші реакції та ізомеризуються:

Хінолінова циклічна система значно поширена в природі. Хіноліновий кістяк протягом тривалого часу був основою для пошуку синтетичних противомалярійних препаратів. Один з таких препаратів – хлорохін. Ціанінові барвники також складають значну частку в комерційній продукції на основі хінолінової сировини. Вони застосовуються для сенсибілізації фотографічних емульсій до червоних і інфрачервоних променів, що не діють на бромисте срібло без сенсибілізації. Найпростішим барвником цього типу є етиловий червоний. Тетрагідропохідна оксамніхін використовується для боротьби із шистосомою, що служить основною причиною захворювання в тропічних регіонах. На основі синтезу похідних хіноліну з ізатину, можна одержати багато інших хіміко-фармацевтичних препаратів. 8 оксихінолін (оксин) широко використовується в аналітичній хімії для виявлення багатьох металів, що дають з ними внутрішньокомплексні солі оксинати (хелати) за рахунок участі вільної пари електронів азоту, а також як дезинфікуючі засоби (хіназол), 5-хлор-7-йод-8-оксихінолін (ентеросептол) застосовується для боротьби з кишковими захворюваннями. Він настільки повно зв'язує іонний кобальт (кобаламіну – вітаміну B12), що вижити бактерії не можуть. Хінолін часто використовується в лабораторії в якості висококиплячого основного розчинника.






