Рассмотрим как меняется энергия Гиббса веществ при равновесии химической реакции:
аА(г)  bВ(г).
bВ(г).
При достижении равновесия энергия Гиббса реакции станет равной нулю:
∆G реакции = b G B – а G А = 0илиа G А = b G B. (3.20)
При равенстве энергий Гиббса продуктов реакции и исходных веществ движущая сила реакции исчерпана, и реакция останавливается, т.е. парциальные давления (концентрации) всех веществ становятся постоянными и не меняются как угодно долго (при данных условиях). Такое состояние химической системы называется состоянием химического равновесия. Установившиеся при этом парциальные давления (концентрации) веществ называются равновесными.
Запишем условие равновесия с учетом уравнений (3.16) и (3.20):
a(G oА+ RT ln р A)=b(G oB+ RT ln р B).
Для рассмотренной реакции:
∆G реакции=b(G oB+ RT ln p B)−a(G oА+ RT ln p A)=0,

Соотношение равновесных парциальных давлений − величина для данных условий постоянная и называется константой равновесия (Кр):
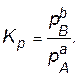
Следовательно, можно записать, что:
∆ G o p=−RTlnKp. (3.21)
Константа равновесия равна отношению произведения равновесных парциальных давлений продуктов реакции и исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам веществ в рассматриваемой реакции.
Например, для реакции N2(г) + 3H2(г) 2NH3(г) константа равновесия запишется как
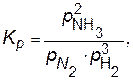
где р – равновесные относительные парциальные давления соответствующих веществ.
Константу равновесия можно рассчитать, объединяя уравнения (3.17) и (3.21):
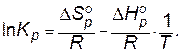 . (3.22)
. (3.22)
Из уравнения (3.24) видно, что Кр для данной системы зависит только от температуры. При данной температуре это величина постоянная и не зависит от первоначальных количеств взятых для реакции веществ.
При использовании молярных концентраций веществ, участвующих в реакции, равновесие характеризуется концентрационной константой равновесия (Кс), которая равна отношению произведений равновесных концентраций продуктов реакции и исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам веществ в рассматриваемой реакции.
Например, для рассмотренной выше реакции константа равновесия запишется как
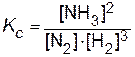 ,
,
где, [N2], [NH3], [H2] - равновесные концентрации веществ, участвующих в реакции, моль/л.
Если все реагенты газообразны и их поведение подчиняется закону идеальных газов, то связь между Кр и Кс можно выразить уравнением
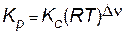 , (3.23)
, (3.23)
где R − газовая постоянная, равная 0,082 л×атм/моль×К; Dn− изменение числа молей газообразных веществ в результате реакции: Dn=(b–а) − для приведенной выше реакции.
Например, для реакции синтеза аммиака N2(г)+3H2(г) 2NH3(г)
Dn=2–(1+3)=–2 и Кр = Кс (RT)-2.
Если реакция идет без изменения объема (количества молей газообразных веществ в результате реакции не меняется) или реакция протекает в растворе, то Кр = Кс.
Например, для реакции N2(г) + O2(г) 2NO(г), Кр = Кс.
Парциальные давления (концентрации) твердых веществ, принимающих участие в реакции, в выражение константы равновесия не включаются. Например, для реакции
MgCO3(тв) 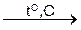 MgO(тв) + CO2(г)
MgO(тв) + CO2(г)
константа равновесия запишется как
Кр = р 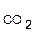 , Kс =[CO2]равн.
, Kс =[CO2]равн. 






