Обратимся к уравнению, связывающему энергию Гиббса и константу равновесия.
DG0 = - RT ln Kравн
По уравнению Гиббса DG0 = DН0 - ТDS0, тогда
 , где
, где
DН0 – стандартное изменение энтальпии реакции при температуре Т;
DS0 – стандартное изменение энтропии реакции при температуре Т.
Отсюда константа равновесия будет равна
 .
.
С помощью этого уравнения можно определить влияние температуры на равновесие.
Если реакция экзотермическая, то энтальпия имеет знак “-“, DН0 < 0.
В этом случае
 . При увеличении температуры Т величина
. При увеличении температуры Т величина 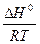 становится меньше, а, следовательно, уменьшается и Кравн. Таким образом, нагревание не способствует протеканию экзотермических реакций.
становится меньше, а, следовательно, уменьшается и Кравн. Таким образом, нагревание не способствует протеканию экзотермических реакций.
И наоборот, если реакция эндотермическая, то энтальпия имеет знак “+“, DН0 > 0. Энтальпийный фактор уравнения для Кравн имеет вид
 . В этом случае увеличение температуры приводит к увеличению константы равновесия, т.е. нагревание способствует протеканию эндотермических реакций.
. В этом случае увеличение температуры приводит к увеличению константы равновесия, т.е. нагревание способствует протеканию эндотермических реакций.
Таким образом, направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта. Степень смещения равновесия определяется величиной теплового эффекта; чем больше DН, тем значительнее влияние температуры.
В соответствии с принципом Ле Шателье:
Повышение температуры смещает равновесие в сторону эндотермических реакций, а понижение температуры – в сторону экзотермических реакций.
Рассмотрим реакцию
А + В D С + Д + Q (DН < 0) экзотермическая реакция
Эта же реакция в обратном направлении будет эндотермической:
(DН > 0) Q + А + В D С + Д
В соответствии с принципом Ле Шателье для этой реакции нагревание будет смещать равновесие в сторону обратной (эндотермической реакции). А для того, чтобы реакция протекала в прямом направлении необходимо температуру понижать.
| Температурные условия проведения процессов | |
| экзотермических | эндотермических |
| Примеры | |
| получение аммиака 3Н2 + N2 ® 2NH3 + Q реакции полимеризации С2Н4 ® (С2Н4)n + Q | реакции дегидрирования С2Н6 ® С2Н4 + Н2 – Q реакции разложения СаСО3 ® СаО + СО2 |
| Условия проведения процессов | |
| Для увеличения выхода конечных веществ (продуктов реакции) необходима система охлаждения (понижение температуры). Пожарную опасность представляют ситуации с нарушением системы охлаждения (перегрев), пожароопасными являются и некоторые хладоагенты. | Для увеличения выхода конечных веществ (продуктов реакции) необходим постоянный нагрев реакционной смеси (в некоторых случаях огневой обогрев). Пожарную опасность представляют постоянно действующие источники тепла. |






