Пример 1. Рассчитать рН и степень гидролиза в 0,1моль/дм3 растворе
СН3СООNa, КCH3COOH = 1,76*10-5.
Решение.
Соль образована катионом сильного основания и анионом слабой кислоты, т.е. гидролизуется в растворе по аниону. Записывают уравнение гидролиза
СН3СОО- + НОН Û СН3СООН + ОН-
рН > 7
[ОН-] = 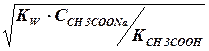 =
=  = 0,75 · 10-5 моль/дм3
= 0,75 · 10-5 моль/дм3
рОН = - lg [ОН-] = - lg 7,5-10-5 = 6 - 0,88 = 5,12
pH = 14-5,12 = 8,88 среда основная

h = 0,75*10-5/0,1 = 0,75*10-4 или 0,75*10-2 %среда основная
Пример 2. Вычислить рН и рОН 0,01 моль/дм3 раствора NH4CI, КNH3*Н20 =1,76*10-5
Решение.
Соль образована катионом слабого основания и анионом сильной кислоты, т.е. гидролизуется в растворе по катиону. Записывают уравнение гидролиза
NH4+ + НОН Û NH4ОН + Н+ рН < 7
[Н+] =  =
=  =
=
2,37 • 10-6 моль/дм3
рН = - lg [Н+] = - lg 2,37 • 10-6 = 6 - 0,38 = 5,62 рОН = 14 - 5,62 = 8,38 среда слабокислая
Занятие 13. Буферные растворы.Расчет рН буферных растворов. Влияние факторов на буферную емкость.
Контрольные вопросы.
1.Протолитическое равновесие в буферных растворах. Классификация буферных растворов. Механизм буферного действия.
2.Буферная емкость и её определение.
3.Значение рН в буферных растворах (уравнение Гендерсона-Гассельбаха).
4. Роль буферных систем в организме человека. Использование буферных систем в анализе.
Буферные растворы.
Буферные растворы поддерживают постоянное значение рН среды при добавлении небольших количеств сильных кислот и оснований, а также при разбавлении или концентрировании раствора.
Механизм действия их основан на смещении ионных равновесий, поскольку буферные растворы представляют собой сопряжённую кислотно-основную пару. Буферные растворы имеют две количественные характеристики: рН и буферную ёмкость.
Расчёт рН буферных растворов
Для буферных растворов величина рН определяется природой и концентрациями растворённых веществ.
А) Буферный раствор, состоящий из слабой кислоты и её соли
[Н+] = Ка • Сна / Ссоли Þ

|
Б) Буферный раствор, состоящий из слабого основания и его соли
[ОН-] = Kb Cb / Ссоли Þ
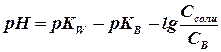
|
Примеры решения задач по расчёту рН буферных растворов.
Пример 3. Рассчитать рН буферной смеси, содержащей 0,02 моль/дм3 раствор NН4ОН в присутствии 0,2 моль/дм3 раствора NH4Cl.
Решение.
Из справочных таблиц находят рК NH4OH = 4,75, подставляют в формулу
рН = 14- рКNH4ОН + lgCNH4OH / CNH4CI
рН = 14- 4,75 + lg 0,02 / 0,2 = 9,35 среда основная.
Пример 4. К 100 см3 0,2 моль/дм3 раствора НСООН прибавили 50 см3 0,5 моль/дм3 HCOONa. Вычислить рН полученного раствора.
Решение.
Для расчёта новой концентрации кислоты и соли используют закон эквивалентов: C1 • V1 = C2 • V2, где:C1 и V1 - начальные концентрации объёмы кислоты и соли,
C2 и V2 - концентрации и объёмы их после смешивания растворов. Поскольку НСООН - одноосновная кислота, то СЭ = CM.
C2 НСООН = C1 НСООН • V2 НССОН/Vобщ = 0,2•100/150 = 0,13 моль/дм3
С2 HCOONa = C1 HCOONa•V1 HCOONa/Vо6щ= 0,5 • 50/150 = 0,17 моль/дм3
Из справочных таблиц находим рК НСООН = 3,75, тогда:
рН = рКнсоон – lgchcooh /CHCOONa = 3,75 - lg 0,13/0,17 = 3,87 среда кислая
Пример 5. Вычислить рН буферной смеси СН3СООН + СНзСООNa, содержащей каждый компонент в концентрации 0,1 моль/дм3. Рассчитать, как изменится рН при добавлении к 1дм3 смеси: а) 0,01 моль/дм3 раствора НС1;
б) 0,01 моль/дм раствора NaOH;
в) при разбавлении смеси водой в 10 раз.
Решение.
Находят в справочных таблицах рКCH3СООН = 4,76, тогда:
рН = рКCH3СООН - lg СCH3СООН / CCH3COONa = 4,76 - lg 0,1/ 0,1 = 4,76 среда слабокислая
а) при добавлении НС1:
CH3COONa + HCI = СН3СООН + NaCI
При добавлении к 1 дм буферной смеси 0,01 моль/дм3 раствора НС1 концентрация СН3СООН увеличится, а концентрация CH3COONa уменьшится на 0,01 моль и станут равными:
ССН3СООН = 0,11 моль/дм3, ССН3СООNа= 0,0900 моль/дм3.
рН = 4,76 - lg 0,11 / 0,09 = 4,76 - 0,09 = 4,67
б) при добавлении NaOH:
СН3СООН + NaOH = CH3COONa + H2O
При добавлении 0,01 моль/дм  раствора NaOH к 1дм3 буферной смеси концентрация СН3СООН уменьшится, а концентрация CH3COONa увеличится на 0,01 моль и станут равными: СCH3СООН= 0,09 моль/дм3 CCH3COONa= 0,1100 моль/дм3.
раствора NaOH к 1дм3 буферной смеси концентрация СН3СООН уменьшится, а концентрация CH3COONa увеличится на 0,01 моль и станут равными: СCH3СООН= 0,09 моль/дм3 CCH3COONa= 0,1100 моль/дм3.
рН = 4,76- lg 0,09: 0,11 = 4,76 + 0,1 = 4,86
в) при разбавлении буферного раствора водой в 10 раз получают:
рН= 4,76 - lg 0,01: 0,01 = 4,76
Как видно, буферный раствор во всех приведенных случаях поддерживает рН на одинаковом уровне.
Задачи:
1 Как изменится pH и степень диссоциации CH3COOH в 0,2М растворе, если к 100 мл этого раствора прибавили 30 мл 0,3М CH3COONa.
2 Вычислить pH раствора, если к 2 литрам воды прибавили 23г HCOOH и 21г HCOOK.
3 Какую среду (кислую, нейтральную или щелочную) имеют водные растворы солей (NH4)2CO3, Na3PO4, Al2(SO4)3, KCl?
4.К 20мл воды прибавили 5мл 3М раствора KNO2. Вычислить pH раствора и степень гидролиза соли.
5 Вычислить концентрацию ионов [H+] и pH раствора полученного смешением 15мл 0,1М раствора HCOOH и 12мл 0,2М раствора HCOONa.
6 В 500мл раствора содержится 2,52г Na2CO3. Определить pH и степень гидролиза соли.
7 Рассчитать pH полученного раствора, если к 100мл 0,0375М CH3COOH прибавили 0,102г CH3COONa.
8 Вычислить рН смеси, содержащей равные объёмы 5%-ных растворов азотистой кислоты и её натриевой соли. (Ответ:3,23)
9 Вычислить рН буферной смеси, содержащей равные объёмы 5%-ных растворов аммиака и хлорида аммония. (Ответ:9,44)
10 Рассчитать рН аммиачной буферной системы, содержащей по 0,5 моль/дм3 раствора аммиака и хлорида аммония. Как изменится рН при добавлении к 1дм этой смеси:
а) 0,1 моль/дм3 раствора хлороводородной кислоты;
б) 0,1 моль/дм3 раствора гидроксида натрия;
в) при разбавлении водой в 10 раз. (Ответ: 9,25; 9,12; 9,39, 9,25)
11 Вычислить рН буферной смеси, содержащей 0,01 моль/дм3 раствор уксусной кислоты и 0,1 моль/дм3 раствор ацетата натрия. (Ответ: 5,76)






