На иономере рН раствора определяют с точностью до ±0,02 единицы рН. Датчиком, регистрирующим величину рН раствора, является стеклянный электрод, электродом сравнения – хлоридсеребряный.
Проверку электродов и настройку иономера проводят по буферным растворам.
Перед началом измерений стеклянный электрод должен быть выдержан не менее суток в 0,1 М растворе HCl или в дистиллированной воде.
Оборудование и реактивы
Иономер.
Буферные растворы со значениями рН: 1,65; 4,01; 9,18.
Индикаторный электрод, стеклянный.
Электрод сравнения, хлоридсеребряный.
Стаканы стеклянные на 100, 250 мл.
Фильтровальная бумага.
Описание определения
Иономер после включения в сеть и прогревания в течение 30 минут настраивают по двум буферным растворам – в кислой и щелочной областях рН. Для этого в стакан наливают соответствующий буферный раствор, опускают в него электроды, фиксируют значение рН и, если необходимо, корректируют его с помощью специальной настройки. Перед каждым погружением в буферный или исследуемый раствор электроды тщательно промывают дистиллированной водой и осторожно удаляют избыток воды с их поверхности фильтровальной бумагой. После измерений их оставляют погруженными в воду или буферный раствор.
Результаты измерений записывают в тетрадь. По значению рН вычисляют концентрацию ионов [H+] и [OH−] в растворе. Полученные результаты сдают преподавателю.
Потенциометрическое титрование (ПТ)
ПТ – регистрация изменения потенциала в процессе химической реакции между определяемым элементом и титрантом. Конечную точку титрования (КТТ) находят по скачку потенциала, отвечающему моменту завершения реакции.
Реакции должны протекать быстро, необратимо, возможно полнее.
В ПТ реакции делятся на:
1). нейтрализации 2). окислительно-восстановительные 3). осаждения и комплексообразования
Индикаторный электрод выбирают в зависимости от типа химической реакции и природы потенциалопределяющих ионов.
Результаты титрования записывают по форме табл 15.2.
Таблица 15.2
Результаты титрования
| Номер | Объем добавляемого титранта V, мл | Измеренная ЭДС, В | 
| Концентрация определяемого элемента, г |
Лабораторная работа № 28
Определение соляной кислоты в травильной ванне
Водные растворы соляной кислоты достаточно широко используются в тонкопленочной технологии для травления тонких металлических пленок. В частности, в солянокислых растворах, содержащих различные неорганические добавки, можно успешно проводить селективное и локальное растворение хромовых пленок с диэлектрических подложек. Представляет практический интерес измерение рН травильных растворов и определение изменения концентрации НС1 в процессе растворения хромовых покрытий.
Оборудование и реактивы
Иономер (рН-метр).
Индикаторный электрод, стеклянный.
Электрод сравнения, хлоридсеребряный.
Стаканы стеклянные на 100, 250 мл.
Фильтровальная бумага.
Мешалка магнитная.
Гидроксид натрия 0,1000 н.раствор (титр устанавливается по щавелевой
кислоте).
Описание определения
Иономер после включения в сеть и прогревания в течение 30 минут и устанавливают в режим работы рН-метра..
В стакан для титрования пипеткой переносят 10,00 мл исследуемого раствора, добавляют туда 50-60 мл дистиллированной воды, тщательно перемешивают и погружают стеклянный и хлорсеребряный электроды. Перед каждым погружением в буферный или исследуемый раствор электроды тщательно промывают дистиллированной водой и осторожно удаляют избыток воды с их поверхности фильтровальной бумагой. После измерений их оставляют погруженными в воду или буферный раствор.
Бюретку заполняют титрантом – рабочим раствором NaOH и подготавливают к работе.
Титрование 0,1000 н. раствором NaOH проводят два раза. Первый раз добавляют титрант по 0,5 - 1,0 мл для ориентировочного определения точки эквивалентности. При повторном титровании добавляют сначала по 0,5, а вблизи эквивалентной точки по 0,1 - 0,2 мл титранта. После каждой порции добавленного титранта измеряют рН раствора.
Результаты измерений и расчета представляют графически в координатах Е –V и (Δ Е /Δ V) – V.
Рассчитывают нормальную концентрацию (N) НСl:
V1N1 = V2N2; 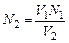 ,
,
где V1 и N1 – объем (мл) и нормальная концентрация раствора NaOH,
а V2 и N2 – раствора НСl.
Содержание соляной кислоты в г во всем объеме анализируемого раствора рассчитывается по формуле
m (HCl) = NHCl·ЭHCl· n ·10–3,
где n – число аликвотных частей анализируемого раствора.
Лабораторная работа № 29






