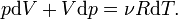Частные случаи
1. Если  , то это означает, что тепло к системе подводится.
, то это означает, что тепло к системе подводится.
2. Если  , аналогично — тепло отводится.
, аналогично — тепло отводится.
3. Если  , то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Первое начало термодинамики:
· при изобарном процессе

· при изохорном процессе ( )
)

· при изотермическом процессе 

Здесь 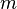 — масса газа,
— масса газа,  — молярная масса газа,
— молярная масса газа,  — молярная теплоёмкость при постоянном объёме,
— молярная теплоёмкость при постоянном объёме,  — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
— давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
Адиабатический процесс - термодинамический процесс, при котором система не обменивается тепловой энергией с окружающим пространством. [кароч: при этом процессе ТЕПЛООБМЕНА НЕТ (Q=0) ]
Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной и изменения энтропии не происходит.
Первое начало термодинамики для адиабатического процесса: 
где  — изменение внутренней энергии тела,
— изменение внутренней энергии тела, 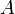 — работа, совершаемая системой.
— работа, совершаемая системой.

где  — его объём,
— его объём,  — показатель адиабаты,
— показатель адиабаты,  и
и  — теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
— теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
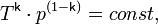
где 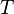 — абсолютная температура газа. Или к виду
— абсолютная температура газа. Или к виду

Поскольку  всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (то есть при уменьшении
всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (то есть при уменьшении  ) газ нагревается (
) газ нагревается (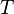 возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов. Нагревание при сжатии больше для того газа, у которого больше коэффициент
возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов. Нагревание при сжатии больше для того газа, у которого больше коэффициент  .
.
Вывод уравнения
Согласно закону Менделеева — Клапейрона для идеального газа справедливо соотношение

где R — универсальная газовая постоянная. Вычисляя полные дифференциалы от обоих частей уравнения, полагая независимыми термодинамическими переменными  , получаем
, получаем
|

или, введя коэффициент  :
:
 .
.
Это уравнение можно переписать в виде

что после интегрирования даёт:
 .
.
Потенцируя, получаем окончательно:

что и является уравнением адиабатического процесса для идеального газа.
Теорема Гаусса
Выражает связь (а именно равенство с точностью до постоянного коэффициента) между потоком напряжённости электрического поля сквозь замкнутую поверхность и зарядом в объёме, ограниченном этой поверхностью
Общая формулировка: Поток вектора напряжённости электрического поля через любую произвольно выбранную замкнутую поверхность пропорционален заключённому внутри этой поверхности электрическому заряду.
Интегральная форма:

где
·  — поток вектора напряжённости электрического поля через замкнутую поверхность
— поток вектора напряжённости электрического поля через замкнутую поверхность  .
.
·  — полный заряд, содержащийся в объёме, который ограничивает поверхность
— полный заряд, содержащийся в объёме, который ограничивает поверхность  .
.
·  — электрическая постоянная.
— электрическая постоянная.
Дифференциальная форма:

Здесь — объёмная плотность заряда (в случае присутствия среды — суммарная плотность свободных и связанных зарядов), а — оператор набла.