ак известно, между внутренней и наружной поверхност€ми мембраны существует разность потенциалов dφ, котора€ обуславливает наличие в мембране толщиной d х электрического пол€ с напр€жЄнностью
 , (9)
, (9)
где dφ / d х Ц градиент потенциала на мембране. Ќа отдельный ион зар€дом n∙e в мембране будет действовать сила  , где е Ц элементарный зар€д, n Ц валентность иона. “огда, сила, действующа€ на 1 моль ионов:
, где е Ц элементарный зар€д, n Ц валентность иона. “огда, сила, действующа€ на 1 моль ионов:
 , (10)
, (10)
где Nј Ц число јвагадро, а F = е∙Nј Ц число ‘араде€.
—корость  установившегос€ направленного движени€ частиц под воздействием силы
установившегос€ направленного движени€ частиц под воздействием силы  :
:
 , (11)
, (11)
где um Ц подвижность одного мол€ ионов Ц коэффициент пропорциональности между скоростью  и силой (
и силой ( ):
):  = um∙
= um∙  .
.
“еперь поток ионов через поперечное сечение S:
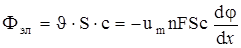 , (12)
, (12)
где c Ц мол€рна€ концентраци€ ионов.
ѕлотность потока ионов обусловленна€ градиентом потенциала Jэл = ‘эл / S = υ∙c:
 . (13)
. (13)
¬ общем случае перенос ионов через мембрану определ€етс€ двум€ факторами: градиентом концентрации частиц и градиентом потенциала
электрического пол€ мембраны Ц уравнением Ќернста-ѕланка:
 (14)
(14)
— энергетической точки зрени€ €влени€ переноса будут описыватьс€ через изменение электрохимического потенциала. ¬ общем случае плотность потока частиц через мембрану определ€етс€ уравнением “еорелла:
 , (15)
, (15)
где с Ц концентраци€ носител€, u Ц его подвижность, dμ / d х Ц градиент электрохимического потенциала Ц dμ.
 . (16)
. (16)
4. ћ≈“ќƒџ »«”„≈Ќ»я ѕ–ќЌ»÷ј≈ћќ—“»
¬ насто€щее врем€ дл€ исследовани€ и оценки про≠ницаемости мембран примен€ют следующие основные ме≠тоды: осмотические, индикаторные, химические, радиоактивных изотопов, измерени€ электропроводности.
ќсмотические методы основаны на наблюдении за кинетикой изменени€ объема клеток при помещении их в гипертонические растворы разной концентрации. огда клетки помещают в гипертонический раствор исследуе≠мого вещества, то вследствие выхода из них воды объем их уменьшаетс€. ѕо мере поступлени€ исследуе≠мого вещества в клетку разность осмотического давле≠ни€ между клеткой и средой уменьшаетс€, и клетка вос≠станавливает свой первоначальный объем. Ќаблюда€ за скоростью восстановлени€ объема клеток, можно судить о скорости проникновени€ в них вещества. — целью объ≠ективной регистрации этих процессов примен€ют цент≠рифугирование взвеси клеток и визуальное определение их суммарного объема с помощью гематокрита, измерение прозрачности, а также определение изменений показател€ преломле≠ни€ клеток и суспензионной жидкости.
Ќедостатком данного метода: он применим только дл€ работы с отдельными и довольно крупными клетками (водоросл€ми, эритроцитами). Ётот метод неприменим так же при исследовании проницаемости дл€ сахаров и аминокислот, так как при больших концентраци€х этих веществ мембрана дл€ них непроницаема, а при малых концентраци€х трудно уло≠вить изменени€ объема клеток.
»ндикаторные методы основаны на изменении окрас≠ки клеточного содержимого при поступлении в клетку определенных веществ. ¬ клетку вначале ввод€т индика≠тор, а затем помещают ее в раствор исследуемого ве≠щества. ѕри поступлении в клетку этих веществ наблю≠даетс€ окрашивание. ≈сли исследуемое вещество само €вл€етс€ красителем, то необходимость в предваритель≠ном введении индикатора отпадает. недостаткам дан≠ного метода следует отнести то, что небольшие концент≠рации красителей трудно обнаружить, а большие токсичны. ƒанный метод дает в основном лишь качественный ответ: проникает вещество в клетку или не проникает.
|
|
|
’имические методы основаны на обычном качествен≠ном и количественном определении содержани€ веществ в клетках или в среде. летки помещают в раствор исследуемого вещества и через некоторое врем€ определ€ют концентрацию этого вещества в клетках или в растворе. ћетод дает особенно хорошие результаты при работе с крупными клетками.
ћетоды радиоактивных изотопов основаны на приме≠нении изотопов, обладающих радиоактивностью. ѕри этом исследуемое вещество мет€т, т. е. включают в состав молекулы иссле≠дуемого вещества радиоактивный (меченый) атом, взамен такого же, но не радиоактивного ≈сли исследуемое вещество находитс€ в виде атомов или ионов, то просто подмешивают в вещество их радиоактивные изото≠пы. “еперь поступление этого вещества в клетку можно зафиксировать с помощью счетчика радиоактивных частиц. ѕоскольку радиоактивность клетки пропорциональна количеству поступившего в нее вещества, этот метод дает количе≠ственные результаты. ѕри измерении потока вещества из клеток в среду предварительно ввод€т ме≠ченные атомы в клетки. Ёто производитс€ или путем микроинъекции, или путем выращивани€ культуры клеток в среде, содержащей данное радиоак≠тивное вещество. ¬ последующем измер€ют выход€щие из клеток потоки данного вещества.
»зотопный метод €вл€етс€ наиболее совершенным и точным методом исследовани€ клеточной проницаемости. ѕользу€сь им, можно вводить в клетку исследуемое вещество в низких концентраци€х, не нарушающих жиз≠неде€тельность клеток. ѕрименение изотопов позволило изучить проницаемость не только дл€ молекул чужерод≠ных или €довитых веществ, но и дл€ тех соединений, которые вход€т в состав клеток и тканевых жидкостей самого организма. — помощью изотопного метода удаЄтс€ изучать одновременно потоки вещества из среды в клетку и из клетки в среду. ќсоба€ ценность метода заключает≠с€ в том, что он удобен дл€ изучени€ кинетики входа и выхода веществ и позвол€ет исследовать эти процессы в естественных услови€х, когда клетка находитс€ в ста≠ционарном состо€нии.
ћетод измерени€ электропроводности примен€етс€ при исследовании проницаемости клеток дл€ ионов. Ёлектропроводность клеток определ€етс€ активностью ионов в клетках и проницаемостью клеточных мембран. ѕри определенных услови€х, например при измерении на низких частотах переменного тока, электропроводность €вл€етс€ мерой проницаемости мембран.






