Студенты анализируют отдельно каждую серию таблеток, полученных при разных давлениях прессования, в соответствии с нормативно-технической документацией. Распадаемость определяют по методу ГФХ (стр. 668), механическую прочность - по методу ГФ IХ (стр. 513), а также с помощью модифицированного прибора Стокса (И. А. Муравьев, 1977, стр. 613). Делают выводы о качестве полученных таблеток обеих серий.
1.2 ТЕМА №2: Влияние физико-химических свойств и технологических факторов на биологическую доступность лекарственных веществ из твердых лекарственных форм (продолжение).
ЦЕЛЬ ЗАНЯТИЯ: Экспериментальная оценка скорости и полноты высвобождения натрия гидрокарбоната из таблеток, полученных при разных давлениях прессования.
ЗАДАЧИ: 1.Определение скорости высвобождения натрия гидрокарбоната из таблеток, приготовленных при разных давлениях прессования (продолжение).
2. Изучить влияние явления полиморфизма лекарственных веществ на биологическую доступность лекарства.
Вопросы для обсуждения:
1. Производственные процессы и терапевтическая эффективность таблетированных лекарственных препаратов.
2. Физико-химические свойства лекарственных веществ и их биологическая активность:
· растворимость;
· поверхностные свойства;
· полиморфизм;
· химическая модификация.
3. Методы определения биодоступности лекарств в опытах in vitro, критерии оценки.
4. Методы определения биодоступности лекарств в опытах in vivo, критерии оценки.
Необходимые материалы и аппаратура:
1. Прибор для определения скорости высвобождения лекарственного вещества из лекарственной формы.
2. Пипетки 100 мл для забора проб - 2 шт.
3. Колбы конические для титрования на 50 или 100 мл - 6 шт.
4. Бюретка для титрования - 1шт.
5. Кислотахлористоводородная - 0,1 н.
6. Индикатор - раствор метилоранжа по ГФХ.
7. Химические стаканы объемом 250 мл - 4 шт.
8. Весы ручные - 6шт.
9. Разновесы - 6 шт.
Учебный материал
Высвобождение и резорбция препаратов из твердых лекарственных форм зависят от многих факторов:
1. Скорость растворения. Водорастворимые препараты быстро растворяются и быстро всасываются. У нерастворимых веществ скорость резорбции можно повысить:
-уменьшением размера частиц,
-изменением химической модификации,
-добавлением ПАВ,
-изменением рН,
-приданием рационального физического состояния (аморфное, кристаллическое, сольватированное, несольватированное).
2. Наличие вспомогательных веществ и их характер:
-наполнители,
-скользящие, разрыхляющие, склеивающие компоненты,
-оболочки, капсулы, покрытия.
3. Виды технологических процессов:
-измельчение,
-наличие грануляции и её вид,
-способ прессования.
4. Вид лекарственной формы:
-порошки, таблетки, гранулы, капсулы, драже и т. д.
Существуют следующие методы определения скорости перехода лекарственного вещества из лекарственной формы в раствор:
1. Методы с естественной конвекцией растворяющей среды.
Лекарственные формы (таблетки или капсулы) помещают в относительно неподвижный растворитель, перемешивание в котором осуществляется благодаря разности удельных весов.
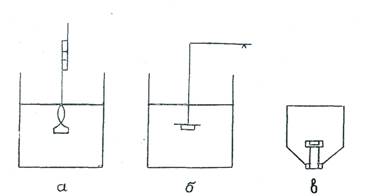
Рисунок 1 - Схема приборов для определения скорости растворения с естественной конвекцией среды.
а) При сольватометрии лекарственную форму помещают в специальный приемник в форме лодочки, которая погружается в растворяющую среду. «Лодочка» соединяется стрелкой со специальной калибровочной шкалой. Вместе с «лодочкой» до нижней позиции погружается и стрелка, которая поднимается вверх по мере растворения ингредиента и таблетки.
б) В случае метода подвешенной таблетки лекарственная форма крепится к алюминиевой полоске, соединенной с рычагом баланса и поддерживается так в течение всего процесса растворения.
в) При методе неподвижного диска лекарственную форму помещают в гнездо акрилового держателя, вводимого в сосуд объемом 25 мл. Сосуд наполняют 0,1н раствором соляной кислоты. Скорость растворения определяют в перевернутом сосуде при постоянной температуре (37°С) путем забора пробы растворителя для анализа через установленные интервалы времени.
2. Методы с искусственной конвекцией растворяющей среды
Методы с искусственной (принудительной) конвекцией растворяющей среды предусматривают постоянный контакт исследуемой лекарственной формы с новыми порциями растворителя.
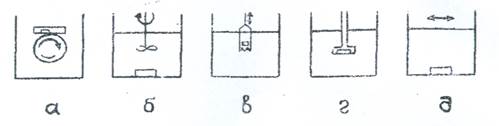
Рисунок 2 - Схема приборов для определения скорости растворения с искусственной конвекцией среды.
а) Метод Врубле. Твердую лекарственную форму помещают в неподвижные трубки, находящиеся в растворяющей среде. Трубки крепят к диску, вращающемуся со скоростью 6 - 12 об/мин.
б) Метод с пропеллерной мешалкой. Определение осуществляют в приборе, который представляет собой сосуд емкостью 400 мл, содержащий 250 мл растворяющей среды. Исследуемую таблетку опускают на дно емкости. Перемешивание производят трехлопастной мешалкой, которая погружается на глубину 27 мм и вращается со скоростью 59 об/мин. Длина полиэтиленовых лопастей мешалки 5 см.
в) Метод качающейся корзинки. Определение скорости растворения твердых пероральных лекарственных форм производится в среде 0,1N НС1 параллельно с определением времени распадения.
г) Метод вращающегося диска для плоских таблеток. Таблетку укрепляют в специальном держателе из акрилового пластика так, чтобы действию растворяющей среды подвергалась только одна плоскость. Скорость растворения определяют в 0,1 N растворе кислоты хлористоводородной, 200 мл которой наливают в 500мл круглодонную колбу. Таблетка с держателем погружается в растворяющую среду на глубину 25 мм. Перемешивание жидкой среды обеспечивается мешалкой, вращающейся со скоростью до 400 об/мин. Объем проб 5 - 10 мл.
д) Метод встряхивания. Испытуемую твердую лекарственную форму помещают в колбу Эрленмейера объемом 150 мл, куда наливают 50 мл 0,1N раствора соляной кислоты при 37±1°. Частота колебаний колбы 65 кол/мин.
 3. Метод фармакопеи США (XVIII изд.)
3. Метод фармакопеи США (XVIII изд.)
В сосуд наливают растворяющую среду 750 - 900 мл, в качестве которой, в зависимости от природы препарата, используют воду очищенную, раствор кислоты хлористоводородной различной концентрации, буферные растворы и т. д. Через отверстия в крышке сосуда вводят термометр, трубку для взятия проб и ось мотора с насаженной на нее цилиндрической корзинкой из нержавеющей стали. Исследуемая лекарственная форма помещается в цилиндрическую корзинку (длина 3,6 см, диаметр 2,5 см). Размер отверстий в корзинке около 0,351 мм. Скорость вращения корзинки в зависимости от свойств препаратов 25 - 200 об/мин. Температура растворяющей среды 37±0,5°. Через установленные интервалы времени с помощью введенной в сосуд трубки отбирают для анализа пробы по 2 - 3 мл на определение содержания лекарственного вещества. Взятый объем растворителя тотчас же восполняют новым. Исследуемая лекарственная форма соответствует требованиям на скорость растворения в том случае, если за известные интервалы времени из нее переходит в раствор установленное количество препарата.
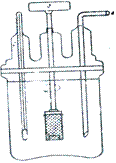
Рисунок 3 - Прибор для определения скорости растворения по
фармакопее США.
Оформление результатов по методам растворения.
На основании химического или физико-химического анализа проб делают расчеты на содержание препарата во всем объеме раствора по формуле 3:
X=P*V*100/ A*B % (3),
X- количество препарата в %, перешедшего в раствор,
Р- количество г препарата в пробе раствора,
V- общий объем в мл,
А- объем пробы в мл,
В - содержание препарата в г в лекарственной форме (анализируемое количество).
Данные определения заносят в таблицу.
Таблица 1 - Динамика растворения таблеток калия бромида
| Время (мин) | Растворение (в %) |
ПРИМЕЧАНИЕ: принято считать, что таблетки приготовлены удовлетворительно, если за 30—120 минут в раствор переходит не менее 75-90% препарата.
По статистически достоверным данным таблицы строят кривую растворения и делают вывод о пригодности (доброкачественности) таблеток или другой лекарственной формы.
4.Метод растворения для мягких лекарственных форм (суппозиториев)
Около 2,5 г (точная навеска) мелкоизмельченных суппозиториев помещают в коническую колбу емкостью 100 мл, добавляют 25 мл воды, нагревают на кипящей водяной бане до полного расплавления основы и нагревают еще в течение 3 - 4 мин. Далее смесь охлаждают до 15 - 20°С, фильтруют через бумажный фильтр в мерную колбу, доводят объем до метки. Затем раствор анализируют. При анализе суппозиториев, приготовленных на водорастворимых основах, количественное определение проводят и в контрольном опыте, т. е. в основе без препарата.
Оформление результатов
На основании данных количественного определения вычисляют процент высвобождения препарата из лекарственной формы по формуле 4:
X=A/B*100% (4),
X - высвобождение препарата из лекарственной формы, в %,
А - количество препарата в растворе в г,
В - количество препарата в лекарственной форме в %.
3.Разделительный метод. П редназначен для пероральных лекарств, суппозиториев и мазей с препаратами, способными растворяться в гидрофобной фазе. По этому методу используется способность полного перехода высвобождающегося в водной фазе препарата в органический растворитель, образующий один слой вприборе (вода, раствор кислоты хлористоводородной, физиологический раствор и т. д. образует другой слой).
Пробу лекарственной формы помещают в водную фазу. Переход препарата в гидрофобную фазу может осуществляться как естественной конвекцией, так и при периодическом взбалтывании. Через заданный промежуток времени (30-120 мин.) воду сливают, а в органическом растворителе определяют содержание препарата.
Оформление результатов как в предыдущем случае.
4. Биологические методы оценки высвобождения препаратов из лекарственных форм
В опытах in vivo определяют содержание лекарственных веществ или их метаболитов в крови или интенсивность выделения их из организма животных.
Исследования обычно проводят на крупных лабораторных животных - собаках, кроликах и др. Препарат вводится в соответствии со спецификой той или иной лекарственной формы из расчета определенного количества - на 1 кг веса животного. После забора «проб» (кровь, моча) через определенные промежутки времени определяют количественное содержание в них препарата. По скорости всасывания или выведения из организма препарата или его метаболитов судят о рациональности технологических процессов и лекарственной формы.
Практическая часть занятия:
Задание №1. Определение скорости высвобождения натрия гидрокарбоната из таблеток, приготовленных при разных давлениях прессования.
Студенты анализируют отдельно каждую серию таблеток, приготовленных на предыдущем занятии.
В термостатированный сосуд емкостью 250 мл наливают 200 мл воды очищенной при температуре 20°С, помещают в него 4 таблетки натрия гидрокарбоната, полученных при давлении прессования 50 кгс/см2 и включают мешалку со скоростью 50 об/мин. Отбор проб объемом 10 мл производят пипеткой через 5, 10, 15, 20 мин. от начала эксперимента. После забора каждой пробы в стакан сразу же добавляют 10 мл воды очищенной. Пробы раствора, взятые из стакана через указанные промежутки времени, помещают в колбы емкостью 50 мл и титруют 0,1 N раствором хлористоводородной кислоты по метилоранжу. Параллельно готовят стандартный раствор путем растворения 2 г гидрокарбоната натрия в 200 мл воды очищенной и 10 мл этого раствора титруют в тех же условиях. Количество кислоты в мл, пошедшее на титрование 10 мл стандартного раствора, будет соответствовать 100%высвобождения препарата.
Пример расчета: На титрование 10 мл стандартного раствора пошло 11,2 мл 0,1 н. HCI. На титрование пробы, взятой через 5 мин. из опытного термостатированного сосуда, затрачено 1,2 мл 0,1 N HCI. Составляем пропорцию,
1,2 мл 0,1 N НCl — Хг NaHCO3 Х=1,2*2/11,2= 0,21г NaHCO3
11,2мл 0,1N HCI — 2 г NaHCO3
Таким образом, за 5 мин. опыта в раствор высвободилось 0,21 г или:
2 г — 100% Х=10,5% NaHCO3
0,21 г — Х%
Подобным образом анализируют и рассчитывают скорость высвобождения препарата из серии таблеток, полученных при давлении прессования 100 кгс/см2.
Полученные данные фиксируют в дневниках в виде таблицы:
Таблица 2 – Влияние давления прессования на скорость высвобождения натрия гидрокарбоната
| Давление прессования | Время | Содержание натрия гидрокарбоната в пробах, граммах, через (мин) | |||
| 5 10 15 20 | |||||
| 50кгс/см² (серия А) | |||||
| 100кгс/см² (серия Б) |
Строят графики, выражающие зависимость количества вещества, перешедшего в раствор препарата (по оси ординат) от времени (по оси абсцисс) для обеих серий. Определяют скорость высвобождения гидрокарбоната натрия из таблеток серии А и Б графическим способом.
На основании проведенных исследований делают выводы о влиянии давления прессования на скорость высвобождения натрия гидрокарбоната.
Задание № 2. Явление полиморфизма лекарственных веществ и его влияние на биологическую доступность лекарства.
Полиморфизм лекарственных веществ, обусловливающий разнообразие их физико-химических свойств может явиться одной из причин их терапевтической неэквивалентности. В этом случае в основе различия фармакотерапевтической активности одного и того же лекарственного вещества лежит использование его различных кристаллических модификаций, обладающих разной физической и химической активностью.
Ход испытания: мужчины-добровольцы, клинически здоровые, в возрасте 20—25 лет разделяются на 3 группы по 5—6 человек в каждой. Утром, натощак им назначают:
1группа — новобиоцин кристаллическая форма в дозе 12,5 мг/кг;
2группа — новобиоцин аморфная форма в той же дозе;
3группа — новобиоцин натриевая соль в эквивалентной дозе.
Концентрацию препарата в плазме крови определяли через определенные промежутки времени. Данные опыта представлены в таблице:
Таблица 3 - Содержание биоцина в плазме крови
| Время после назначения (в часах) | Содержание в мкг/мл | ||
| Кристаллическая форма | Аморфная форма | Натриевая соль | |
| 0,5 | Не обнаружен | 5,0 | 0,5 |
| ---- | 10,6 | 0,5 | |
| ---- | 29,5 | 14,6 | |
| ---- | 22,3 | 22,3 | |
| ---- | 23,7 | 16,9 | |
| ---- | 20,2 | 10,4 | |
| ---- | 17,5 | 6,4 |
Содержание таблицы переносят в дневники, строят графики и делают выводы об эквивалентности испытанных форм препарата по времени обнаружения в крови, интенсивности всасывания, времени достижения максимальной концентрации и значения максимальной концентрации.
1.3 ТЕМА №3: Влияние вспомогательных веществ и вида лекарственной формы на биологическую доступность лекарственного вещества.
ЦЕЛЬ ЗАНЯТИЯ: Изучение особенности приготовления модельных таблеток с использованием различных вспомогательных веществ.
ЗАДАЧИ: 1.Изучить влияние вспомогательных веществ на скорость высвобождения рибофлавина из таблеток.
2.Провести биофармацевтическую оценку суппозиториев с трифтазином, приготовленных на различных основах.
ОБОСНОВАНИЕ ТЕМЫ: Среди фармацевтических факторов группа вспомогательных веществ играет особую роль. Она чрезвычайно многочисленна и разнопланова. Сюда относятся самые различные вещества как по своему происхождению, так и по тому, с какой целью они используются. Это вещества природного, синтетического или полусинтетического происхождения, которые используются в технологии лекарств в качестве основообразующих, склеивающих, скользящих, антифрикционных, корригирующих, стабилизирующих и т. д. веществ. Другими словами — это вещества, которые придают фармакологическому средству соответствующую лекарственную форму и превращают его, в конечном счете, в лекарственный препарат.
Открытие феномена терапевтической неэквивалентности лекарств и введение биофармацией понятия «биологическая доступность» в корне изменило отношение к фармацевтическим факторам, в том числе и к роли вспомогательных веществ. Оказалось, что вспомогательные вещества могут в такой степени изменять фармакокинетику действующего вещества, что она может полностью потерять свою терапевтическую активность. Биофармацевтический подход к роли вспомогательных веществ в системе лекарственный препарат — организм показал, что они не являются индифферентными и в каждом конкретном случае необходимо строго индивидуально подбирать их в соответствии с той или иной группой активных субстанций, в той или иной лекарственной форме.
На примере таблетированных препаратов мы предлагаем студентам экспериментально изучить влияние вспомогательных веществ (в данном случае склеивающих) на скорость высвобождения активной субстанции.
Вопросы для обсуждения
1. Вспомогательные вещества, определение и классификация.
2. Какова роль основообразующих веществ в лекарственном препарате с точки зрения биофармации?
3. Что такое корригирующее вещество и каково его влияние на высвобождение лекарственного вещества из лекарственной формы?
4. Влияние других вспомогательных веществ на биодоступность лекарственного вещества из твердой лекарственной формы.






