Первичные спирты при окислении в зависимости от условий протекания реакции могут образовать не только альдегиды, но и кислоты.
Например, окисление этанола дихроматом калия на холоду заканчивается oбразованием уксусной кислоты, а при нагревании – ацетальдегида:
3CH3–CH2OH + 2K2Cr2O7 + 8H2SO4 = 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O, 3CH3–CH2OH + K2Cr2O7 + 4H2SO4 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Помним о влиянии среды на продукты реакций окисления спиртов, а именно:
горячий нейтральный раствор KMnO4 окисляет метанол до карбоната калия, а остальные спирты – до солей соответствующих карбоновых кислот: 
Окисление гликолей
1,2-Гликоли легко расщепляются в мягких условиях при действии иодной кислоты. В зависимости от строения исходного гликоля продуктами окисления могут быть альдегиды или кетоны: 
Если три или более ОН-групп связаны с соседними атомами углерода, то при окислении иодной кислотой средний или средние атомы превращаются в муравьиную кислоту.
Окисление гликолей перманганатом калия в кислой среде проходит аналогично окислительному расщеплению алкенов и также приводит к образованию кислот или кетонов в зависимости от строения исходного гликоля. 
Альдегиды и кетоны
Альдегиды легче, чем спирты, окисляются в соответствующие карбоновые кислоты не только под действием сильных окислителей (кислород воздуха, подкисленные растворы KMnO4 и K2Cr2O7), но и под действием слабых (аммиачный раствор оксида серебра или гидроксида меди(II)):
5CH3–CHO + 2KMnO4 + 3H2SO4 = 5CH3–COOH + 2MnSO4 + K2SO4 + 3H2O,
3CH3–CHO + K2Cr2O7 + 4H2SO4 = 3CH3–COOH + Cr2(SO4)3 + K2SO4 + 4H2O,
CH3–CHO + 2[Ag(NH3)2]OH CH3–COONH4 + 2Ag + 3NH3 + H2O
Особое внимание!!! Окисление метаналя аммиачным раствором оксида серебра приводит к образованию карбоната аммония, а не муравьиной кислоты:
HCHО + 4[Ag(NH3)2]OH = (NH4)2CO3 + 4Ag + 6NH3 + 2H2O.
Для составления уравнений окислительно- восстановительных реакций используют как метод электронного баланса, так и метод полуреакций (электронно-ионный метод).
Для органической химии важна не степень окисления атома, а смещение электронной плотности, в результате которого на атомах появляются частичные заряды, никак не согласующиеся со значениями степеней окисления.
Многие вузы включают в билеты для вступительных экзаменов задания по подбору коэффициентов в уравнениях ОВР ионно-электронным методом (методом полуреакций). Если в школе и уделяется хоть какое-то внимание этому методу, то, в основном при окислении неорганических веществ. Попробуем применить метод полуреакций для окисления сахарозы перманганатом калия в кислой среде. 
Преимущество этого метода заключается в том, что нет необходимости сразу угадывать и записывать продукты реакции. Они достаточно легко определяются в ходе уравнения. Окислитель в кислой среде наиболее полно проявляет свои окислительные свойства, например, анион MnO-превращается в катион Mn2+, легко окисляющиеся органические соединения окисляются до CO2.
Запишем в молекулярном виде превращения сахарозы: 
В левой части не хватает 13 атомов кислорода, чтобы устранить это противоречие, прибавим 13 молекул H2O. 
Левая часть теперь содержит 48 атомов водорода, они выделяются в виде катионов Н+: 
Теперь уравняем суммарные заряды справа и слева: 
Схема полуреакций готова. Составление схемы второй полуреакции обычно не вызывает затруднений: Объединим обе схемы: 
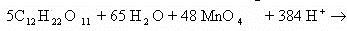

Сократив обе части уравнения на 65 H2O и 240 Н, получим сокращенное ионное уравнение окислительно-восстановительной реакции: 

Задание для самостоятельной работы: Закончите УХР и расставьте коэффициенты методом электронного баланса или методом полуреакций:
CH3-CH=CH-CH3 + KMnO4 + H2SO4 →
CH3-CH=CH-CH3 + KMnO4 + H2О →
(CH3)2C=C-CH3 + KMnO4 + H2SO4 →
CH3-CH2-CH=CH2 + KMnO4 + H2SO4 →
СH3-CH2-C≡C-CH3 + KMnO4 + H2SO4 →
C6H5-CH3 + KMnO4+ H2O →
C6H5-C2H5 + KMnO4 + H2SO4 →
C6H5-CH3 + KMnO4 + H2SO4 →






