Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение).
2) определение с.о. каждого атома углерода:
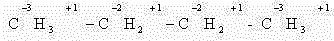 В этом случае степень окисления любого атома углерода в органическом соединении равна алгебраической сумме чисел всех связей с атомами более электроотрицательных элементов, учитываемых со знаком «+» у атома углерода, и числа связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-» у атома углерода. При этом связи с соседними атомами углерода не учитывают.
В этом случае степень окисления любого атома углерода в органическом соединении равна алгебраической сумме чисел всех связей с атомами более электроотрицательных элементов, учитываемых со знаком «+» у атома углерода, и числа связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-» у атома углерода. При этом связи с соседними атомами углерода не учитывают.
В качестве простейшего примера определим степень окисления углерода в молекуле метанола. 
Атом углерода связан с тремя атомами водорода (эти связи учитываются со знаком «–»), одной связью – с атомом кислорода (ее учитывают со знаком «+»). Получаем: -3 + 1 = -2.Таким образом, степень окисления углерода в метаноле равна -2.
Вычисленная степень окисления углерода хотя и условное значение, но оно указывает на характер смещения электронной плотности в молекуле, а ее изменение в результате реакции свидетельствует об имеющем место окислительно-восстановительном процессе.
Уточняем, в каких случаях лучше использовать тот или иной способ.
Процессы окисления, горения, галогенирования, нитрования, дегидрирования, разложения относятся к окислительно-восстановительным процессам. При переходе от одного класса органических соединений к другому и увеличения степени разветвленности углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется.
Органические вещества, в молекулах которых содержатся атомы углерода с максимальными (- и +) значениями СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых к воздействию мягких окислителей и окислителей средней силы.
Вещества, в молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко, восстановительные способности их близки, поэту их неполное окисление может быть достигнуто за счет одного из известных окислителей малой и средней силы. Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя, подобно тому, как это присуще неорганическим веществам.

При написании уравнений реакций горения и разложения органических веществ лучше использовать среднее значение с.о. углерода.
Например: 
Составим полное уравнение химической реакции методом баланса. Среднее значение степени окисления углерода в н-бутане:
10/4 = 2,5.
Степень окисления углерода в оксиде углерода(IV) равна +4.
Составим схему электронного баланса: 
Обратите внимание на первую половину электронного баланса: у атома углерода в дробном значении с.о. знаменатель равен 4, поэтому расчет передачи электронов ведем по этому коэффициенту.
Т.е. переход от -2,5 до +4 соответствует переходу 2,5 + 4 = 6,5 единиц. Т.к. участвует 4 атома углерода, то 6,5 · 4 = 26 электронов будет отдано суммарно атомами углерода бутана.
C учетом найденных коэффициентов уравнение химической реакции горения н-бутана будет выглядеть следующим образом: 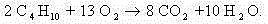
Можно воспользоваться методом определения суммарного заряда атомов углерода в молекуле:
(4C)-10 …… → (1C)+4, учитывая, что количество атомов до знака = и после должно быть одинаково, уравниваем (4C)-10 …… →[(1C)+4] · 4
Следовательно, переход от -10 до +16 связан с потерей 26 электронов. В остальных случаях определяем значения с.о. каждого атома углерода в соединении,обращая при этом внимание на последовательность замещения атомов водорода у первичных, вторичных, третичных атомов углерода: 

Вначале протекает процесс замещения у третичных, затем – у вторичных, и, в последнюю очередь – у первичных атомов углерода.
Алкены
Процессы окисления зависят от строения алкена и среды протекания реакции.

1.При окислении алкенов концентрированным раствором перманганата калия KMnO4 в кислой среде (жесткое окисление) происходит разрыв σ- и π-связей с образованием карбоновых кислот, кетонов и оксида углерода(IV). Эта реакция используется для определения положения двойной связи.

а) Если двойная связь находится на конце молекулы (например, у бутена-1), то одним из продуктов окисления является муравьиная кислота, легко окисляющаяся до углекислого газа и воды: 
б) Если в молекуле алкена атом углерода при двойной связи содержит два углеродных заместителя (например, в молекуле 2-метилбутена-2), то при его окислении происходит образование кетона, т. к. превращение такого атома в атом карбоксильной группы невозможно без разрыва C–C-связи, относительно устойчивой в этих условиях: 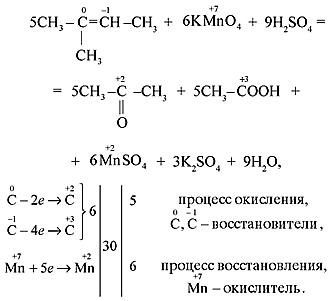
в) Если молекула алкена симметрична и двойная связь содержится в середине молекулы, то при окислении образуется только одна кислота: 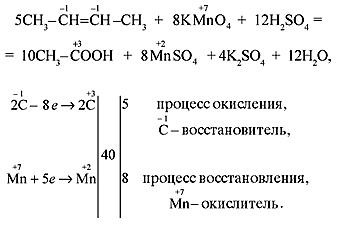
Особенностью окисления алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, является образование двух кетонов: 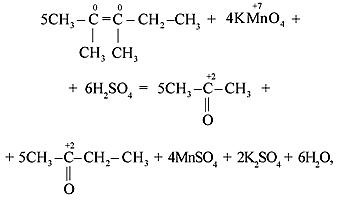
2. В нейтральной или слабощелочной средах окисление сопровождается образованием диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам углерода, между которыми существовала двойная связь: 
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены (реакция Вагнера).
3. Окисление алкенов в присутствии солей палладия (Вакер-процесс) приводит к образованию альдегидов и кетонов:
2CH2=CH2 + O2 PdCl2/H2O → 2 CH3-CO-H
Гомологи окисляются по менее гидрированному атому углерода:
СH3-CH2-CH=CH2 + 1/2O2 PdCl2/H2O → CH3- CH2-CO-CH3
Алкины
Окисление ацетилена и его гомологов протекает в зависимости от того, в какой среде протекает процесс. 
а) В кислой среде процесс окисления сопровождается образованием карбоновых кислот:  Реакция используется для определения строения алкинов по продуктам окисления:
Реакция используется для определения строения алкинов по продуктам окисления: 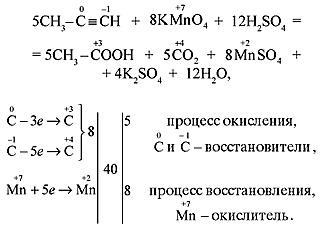
В нейтральной и слабощелочной средах окисление ацетилена сопровождается образованием соответствующих оксалатов (солей щавелевой кислоты), а окисление гомологов – разрывом тройной связи и образованием солей карбоновых кислот: 
Для ацетилена:
1) В кислой среде:
H-C≡C-H KMnO4, H2SO4→ HOOC-COOH (щавелевая кислота)
2) В нейтральной или щелочной среде:
3CH≡CH +8KMnO4 H2O→ 3KOOC-COOK оксалат калия +8MnO2↓+ 2KOH+ 2H2O Арены (бензол и его гомологи)
При окисления аренов в кислой среде следует ожидать образования кислот, а в щелочной – солей.
Гомологи бензола с одной боковой цепью (независимо от ее длины) окисляются сильным окислителем до бензойной кислоты по α -углеродному атому. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
а.5C6H5–CH3 + 6KMnO4 + 9H2SO4 = 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O, 5C6H5–б.C2H5 + 12KMnO4 + 18H2SO4 = 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O, в.C6H5–CH3 + 2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O.
Подчеркиваем, что если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты: 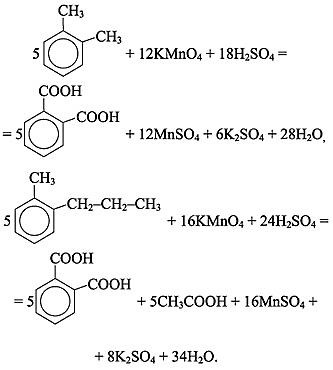
1) В кислой среде:
С6H5-CH2-R KMnO4, H2SO4→ С6H5-COOH бензойная кислота+ CO2↑
2) В нейтральной или щелочной среде:
С6H5-CH2-R KMnO4, H2O/(OH)→ С6H5-COOK + CO2↑
3) Окисление гомологов бензола перманганатом калия или бихроматом калия при нагревании:
С6H5-CH2-R KMnO4, H2SO4, t˚C→ С6H5-COOHбензойная кислота+ R-COOH
4) Окисление кумола кислородом в присутствии катализатора (кумольный способ получения фенола):
C6H5CH(CH3)2 (O2, H2SO) → C6H5-OH фенол + CH3-CO-CH3 ацетон
5C6H5CH(CH3)2 + 18KMnO4 + 27H2SO4 → 5C6H5COOH + 42H2O + 18MnSO4 + 10CO2 + K2SO4
C6H5CH(CH3)2 + 6H2O – 18ē → C6H5COOH + 2CO2 + 18H+ | x 5
MnO4- + 8H+ + 5ē → Mn+2 + 4H2O | x 18
Следует обратить внимание на то, что при мягком окислении стирола перманганатом калия КMnO4 в нейтральной или слабощелочной среде происходит разрыв π -связи,образуется гликоль (двухатомный спирт). В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV).
Окисление же сильным окислителем – перманганатом калия в кислой среде – приводит к полному разрыву двойной связи и образованию углекислого газа и бензойной кислоты, раствор при этом обесцвечивается.
C6H5−CH═CH2 + 2 KMnO4 + 3 H2SO4 → C6H5−COOH + CO2 ↑ + K2SO4 + 2 MnSO4 +4 H2O
Спирты
Следует помнить, что:
1) первичные спирты окисляются до альдегидов:
3CH3–CH2OH + K2Cr2O7 + 4H2SO4 = 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O;
2) вторичные спирты окисляются до кетонов: 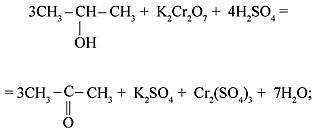
3) для третичных спиртов реакция окисления не характерна.
Третичные спирты, в молекулах которых нет атома водорода при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В жестких условиях (при действии сильных окислителей и при высоких температурах) они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е. происходит деструкция углеродного скелета.






