Әлсіз қышқылдың ертіндісінде протолиттік реакция оңнан солға қарай ығысқан, сондықтан ертіндіде қышқыл НА түрінде жүреді, тек оның азғантай мөлшері гидроксоний ионына айналады. Жуық есептеулерде [НА] ≈ СНА деп алуға болады. Сонымен қатар:
НА + Н2О ↔ Н3О+ + А- теңдігінен [Н3О+] = [А-].
Келтірілген мәндерді қышқылдық константаның теңдігіне қойсақ:

Егер К0а= КСа деп алсақ:
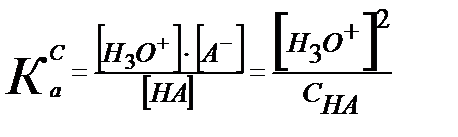
 -lg [Н3О+] = –
-lg [Н3О+] = –  lg K CHA –
lg K CHA –  lg CHA;
lg CHA;
pH =  pKCHA –
pKCHA –  lg CHA (5.19)
lg CHA (5.19)
Мысалы: 0,01М а) сірке қышқылының, б) аммоний хлоридінің судағы ертінділерінің рН-ы: 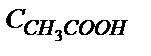
а) рН =  pK
pK 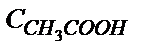 –
–  lg
lg 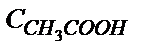 =
=  4,76 –
4,76 –  lg 10-2 = 3,40;
lg 10-2 = 3,40;
б) NН4++Н2О↔Н3О++NН3; 
Әлсіз негіздердің судағы ертіндісінде протолитті реакция оңнан солға қарай ығысқан: В+ Н2О↔ВН++ОН-. Жуық есептеулерде [В] ≈ СВ; [ВН+] = [ОН-]


рОН = 1/2рКСВ – 1/2 lg CВ
рН = pKW – pOH =pKW -(1/2) pKCB +(1/2) lg CB (5.20)
Мысалы: 0,01M а) амиактың, б) сірке қышқылды натрийдің судағы ертінділерінің рН-ы:
а) рН = 14 –  ·4,6 +
·4,6 +  lg 10-2 = 14 – 2,3 – 1 = 10,70;
lg 10-2 = 14 – 2,3 – 1 = 10,70;
б) СН3СОО- +Н2О ↔ СН3 СООН + ОН-
рН=14–  pKCСН3СОО-+
pKCСН3СОО-+  lgССН3СОО- =14 –
lgССН3СОО- =14 –  ·9,2+
·9,2+  lg10-2=14–4,6–1=8,40.
lg10-2=14–4,6–1=8,40.
Егер протолиттердің ертіндісі өте сұйытылған болса, не қышқылдық (негіздік) константалардың мәні үлкен болса рН – мәнін есептеу күрделенеді:
НА + Н2О ↔ Н3О+ + А- ; [Н3О+] = [А-] = X; [НА] = СНА – Х

Х 2 + Ка ·Х + Ка ·СНА = 0
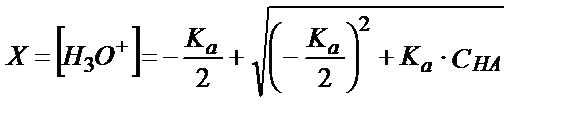
не 
Лсіз қышқыл мен қосарласқан негіздің немесе әлсіз негізбен қосарласқан қышқылдың ерітінділері. Буферлі ерітінділер
Қосарласқан қышқылды-негіздік жұбы бар ертінді екі бәсекелес тепе-теңдікке байланысты қышқылдық, сілтілік, не бейтарап болуы мүмкін.
НА-әлсіз қышқылы мен оның натрий тұзының NaА қоспасы бар ертіндіде:
НА + Н2О ↔ Н3О+ + А-,  (5.21)
(5.21)
А- + Н2О ↔ ОН- + НА, 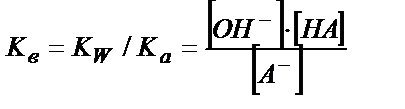 (5.22)
(5.22)
Егер (5.21) тепе-теңдік (5.22) тепе-теңдікке қарағанда оң жаққа көбірек ығысқан болса ертіндінің қышқылдығы (5.21) тепе – теңдіктен анықталады:
 ; [НА] = СНА; [А-] = СА-
; [НА] = СНА; [А-] = СА-
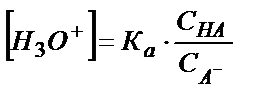 ;
; 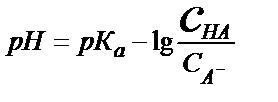 (5.23)
(5.23)
Мысалы, 0,40 М құмырсқа қышқылы мен 1,0 М құмырсқа қышқылды натрий (натрий формиаты) қоспасы бар ертіндінің рН табайық:
НСООН + Н2О ↔ Н3О+ + НСОО- (5.24)
 ; Кв = КW /Ка = 5,6. 10-11
; Кв = КW /Ка = 5,6. 10-11
Ка> Кв , сондықтан ертіндіде (5.24) тепе – теңдік басым жүреді:

рН = 4,15.
Сол сияқты әлсіз негіз ертіндісінде, мысалы аммиак пен аммоний хлориді бар ертіндіде:
NН3 + Н2О ↔ NН4 ++ ОН-  (5.25)
(5.25)
NН4+ + Н2О↔ NН3 +Н3О+

Кв > Ка, сондықтан ертіндіде басым жүретін тепе-теңдік (5.25). Ертіндінің қышқылдығы (5.25) теңдігінен анықталады:
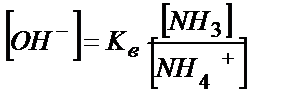 ; [NН3] = С NН3 ; [NН4 +] = С NН4СІ
; [NН3] = С NН3 ; [NН4 +] = С NН4СІ
 ;
; 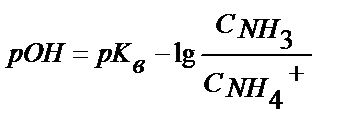 ;
;
 (5.26)
(5.26)
Мұндай қоспалардың ерітінділері буферлі ерітінділер деп аталады. Буферлі ерітінділердің рН-ы оларды сұйылтқанда, не аздап қышқыл мен негіз қосқанда іс жүзінде өзгермейді.
Буферлі ерітіндіні сұйылтқанда қоспаның құрамындағы компоненттердің концентрациялары бірдей өзгереді, сондықтан олардың қатынасы тұрақты болып қалады. (5.23, 5.26-теңдіктері).
Егер бұл ерітіндіге Н3О+ концентрациясын өзгертетін күшті қышқыл қоссақ (5.21) теңдігі бойынша НА концентрациясы көбейеді (СНА+[Н3О+]), ал А- концентрациясы азаяды (СА- – [Н3О+]). Бұл мәндерді (5.23) теңдікке қойсақ

Керісінше, күшті негіз құйсақ НА концентрациясы азайып, А- концентрациясы артады: (СНА-[ОН-]); (СА- + [ОН-]).

Мысалы, құрамында 0,1М СН3СООН және 0,1М СН3СООNa бар буферлі ерітіндінің рН осы ерітіндіге 0,01М НCl, 0,01М NaOH қосса былай өзгереді ( = 1,75∙10-5; рКа= 4,76):
= 1,75∙10-5; рКа= 4,76):
1) 
2) 0,01М НСl қосқаннан кейін:

Егер 0,01 М НСl- ды таза суға қосса ерітіндінің рН 7-ден 2-ге дейін өзгерер еді, ал буферлі қоспаның рН 0,09-ға ғана өзгереді.
1) 0,01М NaOH қосқанда:

Буферлі қоспа аналитикалық химияда кең қолданылады. Буферлі қоспа буферлік сыйымдылық π деген мәнмен сипатталады, бұл 1 л ерітіндінің рН-ын бір бірлікке өзгертуге жеткілікті қышқыл мен сілтінің мөлшері (моль):
π =  (∆С/∆рН)
(∆С/∆рН)
Ең жоғарғы буферлік сыйымдылық бар ерітінді бұл компоненттерінің қатынасы 1:1 тең ерітінді.






