Важнейшие химические свойства оксидов
1. Основные оксиды щелочных и щелочно-земельных металлов взаимодействуют с водой с образованием оснований (щелочей):
ВаО + Н2О ® Ва(ОН)2.
2. Основные оксиды взаимодействуют с кислотными оксидами и кислотами, образуя соли:
СаО + СО2 ® СаСО3
СuО + 2 НСl ® СuСl2 + Н2О.
3. Кислотные оксиды взаимодействуют с водой, образуя кислоты:
SO2 + H2O ® H2SO3.
4. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду:
N2O5 + 2 NaOH ® 2 NaNO3 + H2O.
5. Амфотерные оксиды вступают в реакции солеобразования и с кислотами и с основаниями:
Cr2O3 + 6 HCl ® 2 CrCl3 + 3 H2O
Cr2O3 + 2 NaOH ® 2 NaCrO2 + H2O.
Гидроксиды – продукты соединения оксидов с водой. Они бывают трех видов: основные (основания), кислотные (кислоты) и амфотерные (амфолиты).
Основания – это сложные соединения, состоящие из катионов металла или аммония  и одной или нескольких гидроксо-групп ОН–. С точки зрения теории электролитической диссоциации основания – электролиты, которые при диссоциации в водных растворах в качестве анионов образуют только гидроксид-ионы.
и одной или нескольких гидроксо-групп ОН–. С точки зрения теории электролитической диссоциации основания – электролиты, которые при диссоциации в водных растворах в качестве анионов образуют только гидроксид-ионы.
NaOH ® Na+ + OH–
Кислотность основания определяется числом ионов OH-, образующихся при диссоциации. Многокислотные основания диссоциируют ступенчато:
Mg(OH)2 ↔ (MgOH)+ + OH–
(MgOH)+ ↔ Mg2+ + OH– .
По растворимости в воде различают:
а) основания, растворимые в воде, – щелочи. Это основания щелочных и щелочно-земельных металлов (LiOH, KOH, CsOH, Ca(OH)2, Ba(OH)2 и др.).
б) основания, нерастворимые в воде, например, Cu(OH)2, Fe(OH)3, Al(OH)3.
Амфолиты (амфотерные основания) – это гидроксиды, которые проявляют как основные, так и кислотные свойства. К ним относятся, например, Cr(OH)3, Zn(OH)2, Be(OH)2, Al(OH)3, Fe(OH)3, Sn(OH)4 и др.
Важнейшие химические свойства оснований
1. Водные растворы щелочей изменяют окраску индикаторов:
лакмус – в синий;
фенолфталеин – в малиновый;
метилоранж – в желтый.
2. Щелочи реагируют с кислотами с образованием соли и воды (реакция нейтрализации):
КОН + НСl ® КСl + Н2О.
3. Щелочи реагируют с растворимыми в воде солями, если в результате реакции образуется осадок, газ или слабый электролит:
2 КОН + СuSО4 ® ¯ Сu(ОН)2 + К2SО4
Са(ОН)2 + Na2CO3 ® ¯ CaCO3 + 2 NaOH.
4. Щелочи реагируют с кислотными оксидами:
2 КОН + СО2 ® К2СО3 + Н2О.
5. Амфотерные и нерастворимые в воде основания взаимодействуют с сильными кислотами (HCl, HNO3, H2SO4):
Mg(OH)2 + 2 HNO3 ® Mg(NO3)2 + 2 Н2О
Zn(OH)2 + 2 HCl ® ZnCl2 + 2 Н2О.
6. Амфотерные и нерастворимые в воде основания разлагаются при термолизе, теряя воду:


7. Амфотерные основания, проявляя кислотные свойства, реагируют со щелочами, образуя соли:
Al(OH)3 + NaOH ® Na[Al(OH)4]
Zn(OH)2 + 2 KOH ® K2[Zn(OH)4].
Кислоты – это сложные химические соединения, состоящие из ионов водорода, способных замещаться на металл, и анионов кислотных остатков. С точки зрения теории электролитической диссоциации кислоты – электролиты, которые при диссоциации в водных растворах в качестве положительно заряженных частиц образуют только катионы водорода Н+ (точнее ионы гидроксония Н3О+):
НСl ® Н+ + Сl–.
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Многоосновные кислоты диссоциируют ступенчато:
Н2СО3 «Н+ + 
НСО3– «Н+ +  .
.
Кислоты можно разделить на бескислородные (НСl, НСN, Н2S) и кислородсодержащие (Н2SO4, HNO3, H3PO4).
Важнейшие химические свойства кислот
1. Водные растворы кислот изменяют окраску индикаторов:
лакмус – в красный;
фенолфталеин – остается бесцветным;
метилоранж – в розовый.
2. Кислоты взаимодействуют с металлами, стоящими левее водорода в электрохимическом ряду напряжений металлов, образуя соль и водород. Водород не выделяется при взаимодействии с концентрированными азотной и серной кислотами:
Fe + H2SO4 (разб) ® FeSO4 + H2
Zn + 2 H2SO4 (конц) ® ZnSO4 + SO2 + 2 H2O.
3. Кислоты реагируют с основными и амфотерными оксидами и основаниями:
H2SO4 + Mg(OH)2 ® MgSO4 + 2 H2O
HNO3 + CaO ® Ca(NO3)2 + H2O.
4. При взаимодействии кислот с солями могут образовываться новые соль и кислота:
2 HCl + CaCO3 ® CaCl2 + H2O + CO2 ,
H2SO4 + BaCl2 ® ¯ BaSO4 + 2 HCl.
Соли – электролиты, при диссоциации которых образуются катионы металлов (или ионы аммония  и анионы кислотных остатков. Соли делятся на средние, кислые и основные.
и анионы кислотных остатков. Соли делятся на средние, кислые и основные.
Средние соли – это продукты полного замещения атомов водорода в кислоте на катион металла. Например, Na2CO3, K2SO4, Ca3(PO4)2. Средние соли образуют все кислоты: как одно-, так и многоосновные. Уравнения диссоциации средних солей можно записать:
K3PO4 ® 3 K+ + 
NH4Cl ®  + Cl–.
+ Cl–.
Кислые соли (гидросоли) – продукты неполного замещения атомов водорода многоосновных кислот атомами металла. Их образуют только многоосновные кислоты. Например, NaHCO3, Ca(H2PO4)2, KHSO3. Диссоциацию кислой соли можно выразить уравнением:
NaHCO3 ® Na+ +  .
.
Основные соли (гидроксосоли) – продукты неполного замещения гидроксогрупп основания на кислотные остатки. Основные соли об-разуются только многокислотными основаниями. Например, (CuOH)2CO3, AlOH(NO3)2, FeOHCl. Диссоциация основной соли выражается уравнением
MgOHCl ® MgOH+ + Cl– .
Важнейшие химические свойства солей
1. Соли взаимодействуют с кислотами и щелочами (см. выше).
2. При взаимодействии двух растворимых в воде солей образуются две новые соли, одна из которых должна выпадать в осадок:
Ba(NO3)2 + K2SO4 ® 2 KNO3 + BaSO4¯.
3. Реакция металла с солью менее активного металла приводит к образованию соли и металла:
Fe + CuSO4 ® FeSO4 + Cu.
Ионные уравнения реакций
Сущность обменных реакций, протекающих в растворах, отражают ионные (ионно-молекулярные) уравнения реакций. Такие реакции
в общем виде записываются в виде трех уравнений: а) молекулярного; б) полного ионного; в) сокращенного ионного. Например, при взаимодействии карбоната натрия с соляной кислотой все три уравнения выглядят так:
молекулярное
Na2CO3 + 2 HCl ® 2 NaCl + H2O + CO2,
полное ионное
2 Na+ +  +2 H+ + 2 Cl– ® 2 Na+ + 2 Cl– + H2O + CO2.
+2 H+ + 2 Cl– ® 2 Na+ + 2 Cl– + H2O + CO2.
сокращенное ионное
2 H+ +  ® H2O + CO2.
® H2O + CO2.
В сокращенном ионном уравнении отсутствуют те ионы, которые до и после реакции остались неизменными.
При записи ионных уравнений принято придерживаться следующих правил.
1. Не записывают в виде ионов как в левой, так и в правой частях уравнения формулы:
а) слабых электролитов, т.е. веществ, которые в водных растворах лишь частично распадаются на ионы. К слабым электролитам относятся: вода, кислоты (H2CO3, H2SiO3, H2S, CH3COOH, H3PO4, H2SO3, HF, HNO2, HClO, HClO2, H2SO4(конц.)), основания, за исключением гидроксидов щелочных и щелочно-земельных металлов (NH4OH, Cu(OH)2, Al(OH)3, Fe(OH)2 и др.);
б) нерастворимых и малорастворимых в воде веществ, которые устанавливаются по таблице растворимости кислот, оснований и солей;
в) газов: СО2, SO2, NH3 и т.д.;
г) оксидов: Al2O3, CuO, FeO, P2O5 и т.д.;
д) водородсодержащих остатков слабых кислот:  ,
,  ,
, 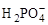 , НS–,
, НS–,  и т.д.;
и т.д.;
е) остатков слабых оснований, содержащих гидроксогруппы: CuOH+, MgOH+, AlOH2+,  .
.
2. В виде ионов записывают формулы:
а) сильных кислот: HCl, HNO3, HBr, HI, HClO3, HClO4, HMnO4, H2SO4;
б) щелочей (гидроксидов щелочных и щелочноземельных металлов): LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2;
в) растворимых в воде солей: NaCl, K2SO4, Сu(NO3)2 и т.д. Формулы растворимых комплексных солей также представляют в виде ионов:
K[Al(OH)4] ® K+ + [Al(OH)4]–.
Таблица. Названия важнейших кислот и их солей
| Кислота | Названия | |
| Кислоты | Соли | |
| HAlO2 | Метаалюминиевая | Метаалюминат |
| HBO2 | Метаборная | Метаборат |
| H3BO3 | Ортоборная | Ортоборат |
| H2B4O7 | Четырехборная | Тетраборат |
| HBr | Бромоводородная | Бромид |
| HCOOH | Муравьиная | Формиат |
| CH3COOH | Уксусная | Ацетат |
| HCN | Циановодородная | Цианид |
| H2CO3 | Угольная | Карбонат |
| H2C2O4 | Щавелевая | Оксалат |
| HCl | Хлороводородная (соляная) | Хлорид |
| HOCl | Хлорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HF | Фтороводородная (плавиковая) | Фторид |
| HСrO2 | Метахромистая | Метахромит |
| H2CrO4 | Хромовая | Хромат |
| H2Cr2O7 | Двухромовая | Дихромат |
| HI | Иодоводородная | Иодид |
| HМnO4 | Марганцовая | Перманганат |
| H2MnO4 | Марганцовистая | Манганат |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Азотная | Нитрат |
| H3PO4 | Ортофосфорная | Ортофосфат |
| H2S | Сероводородная | Сульфид |
| HSCN | Родановодородная | Роданид |
| H2SO3 | Сернистая | Сульфит |
| H2SO4 | Серная | Сульфат |
| H2S2O3 | Тиосерная | Тиосульфат |
| H2Se | Селеноводородная | Селенид |
| H2SeO3 | Селенистая | Селенит |
| H2SiO3 | Кремниевая | Силикат |
| HN3 | Азотистоводородная | Азид |






