Цель изучения темы. Йодометрия и броматометрия относятся к методам окислительно-восстановительного титрования. Йодометрия основана на использовании в качестве титрантов растворов йода и тиосульфата натрия, броматометрия – раствора бромата калия. Метод йодометрии применяется для определения веществ, обладающих восстановительными, окислительными свойствами, вступающих в реакции замещения или присоединения йода, а также веществ, образующих полийодиды. Методом йодометрии проводят определение доброкачественности некоторых лекарственных препаратов и определение йодного числа лекарственного растительного сырья. Метод броматометрии применяется для веществ, окисляющихся броматом калия или вступающих в реакции замещения или присоединения брома. Для проведения йодометрического и броматометрического титрования лекарственных средств необходимо знать титранты методов, условия проведения, определение конечной точки титрования.Знание методов йодометрического и броматометрического титрования необходимо для дальнейшего изучения фармацевтической химии.
Задачи. Освоить метод йодометрического, броматометрического титрования.
Студент должен знать:
1.до изучения темы
· правила техники безопасности работы в химической лаборатории и с физической аппаратурой;
· химические свойства элементов и их соединений;
· растворы и процессы, протекающие в водных растворах;
· основные начала термодинамики, термохимия;
· химическое равновесие, способы расчета констант равновесия;
2.после изучения темы
· основные законы, лежащие в основе окислительно-восстановительных методов титрования;
· методы, приемы и способы выполнения йодометрического и броматометрического методов титрования;
Студент должен уметь:
· проводить количественное определение веществ методами йодометрического и броматометрического титрования.
Студент должен владеть:
· простейшими операциями при выполнении йодометрического титрования.
Задание для самостоятельной аудиторной работы студентов по указанной теме:
1) Ознакомиться с теоретическим материалом по теме занятия с использованием конспектов лекций, рекомендуемой учебной литературы.
2) Ответить на вопросы для самоконтроля:
1. Йодометрическое титрование. Сущность метода.
2. Титранты йодометрии, их приготовление и стандартизация.
3. Условия проведения йодометрического титрования. Определение конечной точки титрования.
4. Применение йодометрии для определения восстановителей, окислителей, веществ, не обладающих окислительно-восстановительными свойствами. Химизм.
5. Броматометрическое титрование. Сущность метода.
6. Титрант броматометрии, его приготовление и стандартизация.
7. Условия проведения броматометрического титрования. Определение конечной точки титрования.
8. Применение броматометрии для определения восстановителей и веществ, не обладающих окислительно-восстановительными свойствами. Химизм.
9. Задачи на расчет молярной концентрации титранта, поправочного коэффициента. Расчет титра соответствия (титра по определяемому веществу). Расчет предварительного объема титранта. Расчет количественного содержания определяемого вещества по результатам титрования.
УИРС. 1. Йодохлорметрия. Сущность метода. Применение.
1. Титранты йодохлорметрии, их приготовление и стандартизация.
3) Проверить свои знания с использованием тестового контроля:
1. Метод йодометрии основан на реакциях
А) кислотно-основного взаимодействия
Б) образования малорастворимых соединений
В) образования малодиссоциирующих комплексных соединений
Г) окисления-восстановления
Ответ:Г
2. Основным (первым) титрантом в методе обратной йодометрии является
А) перманганат калия
Б) йод
В) тиосульфат натрия
Г) бромат калия
Д) нитрит натрия
Ответ:Б
3. Для установления конечной точки титрования в методе йодометрии в качестве индикатора используют
А) метиловый оранжевый
Б) метиловый красный
В) крахмал
Г) тропеолин 00
Ответ: В
4. Броматометрическое титрование проводят в
А) кислой среде
Б) нейтральной среде
В) шелочной среде
Ответ: А
5. Количественное определение глюкозы можно проводить методом
А) ацидиметрии
Б) алкалиметрии
В) аргентометрии
Г) комплексонометрии
Д) йодометрии
Ответ: Д
Типовые задачи:
1. Рассчитайте молярность и поправочный коэффициент 0,1 М раствора натрия тиосульфата, если на титрование 20,0 мл 0,0167 М раствора калия бромата (после реакции с калия йодидом в присутствии хлористоводородной кислоты) израсходовали 20,05 мл приготовленного раствора натрия тиосульфата.
2. Рассчитайте молярность и поправочный коэффициент 0,0167 М раствора калия бромата, если на титрование 20,0 мл приготовленного раствора калия бромата (после реакции с калия йодидом в присутствии хлористоводородной кислоты) израсходовали 19,15 мл 0,1 М раствора натрия тиосульфата.
3. Напишите химизм, рассчитайте титр соответствия при количественном определении натрия тиосульфата методом йодометрии с использованием 0,1 М раствора титранта. М.м.(Na2S2О3·5Н2О) = 248,17.
4. Рассчитайте предварительный объем титранта 0,1 М раствора натрия тиосульфата (Кп=1,0172) при количественном определении 3% раствора перекиси водорода методом йодометрии, если на титрование взята навеска 1 мл. 1 мл 0,1 М раствора натрия тиосульфата соответствует 1,701 мг перекиси водорода.
5. Рассчитайте процентное содержание кислоты аскорбиновой, если на титрование 0,0973 г субстанции израсходовали 11,05 мл 0,05 М раствора йода с Кп=0,9864. 1мл 0,05 М раствора йода соответствует 8,806 мг кислоты аскорбиновой.
Формы контроля освоения заданий по самостоятельной аудиторной работе по данной теме
Типовой вариант выходного контроля.
1. Титранты йодометрии, их приготовление и стандартизация.
2. Применение броматометрии для определения восстановителей и веществ, не обладающих окислительно-восстановительными свойствами. Химизм.
3. Задача.
Рекомендуемая литература:
Основная:
1. Харитонов, Ю.Я. Аналитическая химия (аналитика) / Ю.Я. Харитонов.- М.: Высшая школа, 2001.- Кн. 1.
2. Лекционный материал.
Дополнительная:
1. Харитонов Ю.Я. Практикум (электронный ресурс): учебное пособие/ Ю.Я. Харитонов, В.Ю. Григорьева, 2009.
2. Харитонов Ю.Я. Примеры и задачи по аналитической химии (электронный ресурс): учебное пособие/ Ю.Я. Харитонов, В.Ю. Григорьева, 2009.
3. Основы аналитической химии / под ред. Ю.А. Золотова.- М.: Высшая школа, 1999.- Кн. 1.
4. Основы аналитической химии / под ред. Ю.А. Золотова.- М.: Высшая школа, 1999.- Кн. 2.
5. Государственная фармакопея РФ ХII изд., часть 1, М., НЦЭСМП, М., 2007 г
анятие № 11
ема: Нитритометрия.
Цель изучения темы. Нитритометрия – титриметрический метод анализа, применяемый для количественного определения первичных и вторичных ароматических аминов, их ацилированных производных (после предварительного гидролиза), а также ароматических нитропроизводных, гидразидов и др. В основе нитритометрии лежат реакции диазотирования (при определении первичных ароматических аминов) и нитрозирования (вторичных ароматических аминов и гидразидов). Для проведения нитритометрического титрования необходимо знать титрант метода, условия проведения, определение конечной точки титрования.Знание методов нитритометрического титрования необходимо для дальнейшего изучения фармацевтической химии.
Задачи. Освоить метод нитритометрического титрования.
Студент должен знать:
1.до изучения темы
· правила техники безопасности работы в химической лаборатории и с физической аппаратурой;
· химические свойства элементов и их соединений;
· растворы и процессы, протекающие в водных растворах;
· основные начала термодинамики, термохимия;
· химическое равновесие, способы расчета констант равновесия;
2.после изучения темы
· основные законы, лежащие в основе окислительно-восстановительных методов титрования, нитритометрии;
· методы, приемы и способы выполнения нитритометрического титрования;
Студент должен уметь:
· проводить количественное определение веществ методом нитритометрического титрования.
Студент должен владеть:
· простейшими операциями при выполнении нитритометрического титрования.
Задание для самостоятельной аудиторной работы студентов по указанной теме:
1) Ознакомиться с теоретическим материалом по теме занятия с использованием конспектов лекций, рекомендуемой учебной литературы.
2) Ответить на вопросы для самоконтроля:
1. Окислительные и восстановительные свойства нитрита натрия.
2. Нитритометрическое титрование. Сущность метода, химизм.
3. Титрант нитритометрии, его приготовление и стандартизация.
4. Определение конечной точки титрования в нитритометрии (инструментальными методами, визуально). Индикаторы метода: внешние (йодкрахмальная бумага), внутренние (тропеолин 00, нейтральный красный, смесь тропеолина 00 с метиленовым синим).
5. Условия проведения нитритометрического титрования: температура, среда, катализатор, скорость титрования.
6. Применение нитритометрии для определения веществ, содержащих первичную ароматическую аминогруппу. Химизм.
7. Применение нитритометрии для определения веществ, содержащих вторичную ароматическую аминогруппу. Химизм.
8. Применение нитритометрии для определения веществ, содержащих ароматическую нитрогруппу Химизм.
УИРС. Применение нитритометрии для определения гидразидов. Химизм.
3) Проверить свои знания с использованием тестового контроля:
1. Титрантом в методе нитритометрии является
А) перманганат калия
Б) йод
В) тиосульфат натрия
Г) бромат калия
Д) нитрит натрия
Ответ: Д
2. При выборе индикатора по кривой титрования интервал изменения окраски должен лежать
А) до скачка титрования
Б) в пределах скачка титрования
Ответ: Б
3. При нитритометрическом титровании органических соединений, имеющих в молекуле первичную ароматическую аминогруппу реакция среды должна быть
А) кислая
Б) нейтральная
В) щелочная
Ответ: А
4. Для установления конечной точки титрования в методе нитритометрии в качестве индикатора используют
А) метиловый оранжевый
Б) метиловый красный
В) крахмал
Г) тропеолин 00
Ответ: Г
5. Количественное определение органических соединений, содержащих вторичную ароматическую аминогруппу можно проводить методом
А) алкалиметрии
Б) йодометрии
В) комплексонометрии
Г) нитритометрии
Д) броматометрии
Ответ: Г
Типовые задачи:
1.
 |
Напишите химизм, рассчитайте титр соответствия при количественном определении анестезина методом нитритометрии с использованием в качестве титранта 0,1 М раствора нитрита натрия. М.м.(анестезина) = 165,19.
2.
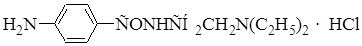 |
Напишите химизм, рассчитайте титр соответствия при количественном определении новокаинамида методом нитритометрии с использованием в качестве титранта 0,1 М раствора нитрита натрия. М.м.(новокаинамида) = 271,79.
3. Рассчитайте предварительный объем титранта 0,02 М раствора натрия нитрита при количественном определении 0,25% раствора новокаина методом нитритометрии, если на титрование взята навеска 2,0 мл. 1 мл 0,02 М раствора натрия нитрита соответствует 5,456 мг новокаина.
4. Рассчитайте процентное содержание левомицетина, если на титрование 2,0 мл исследуемого раствора (после восстановления цинковой пылью) израсходовали 0,78 мл 0,02 М раствора натрия нитрита (Кп=1,0231). Объем контрольного опыта – 0,05 мл. 1 мл 0,02 М раствор натрия нитрита соответствует 6,462 мг левомицетина.
Формы контроля освоения заданий по самостоятельной аудиторной работе по данной теме
Типовой вариант выходного контроля.
1. Нитритометрическое титрование. Сущность метода. Окислительные и восстановительные свойства нитрита натрия.
2. Применение нитритометрии в фарманализе для определения веществ, содержащих первичную и вторичную ароматическую аминогруппу. Химизм.
3. Задача.
Рекомендуемая литература:
Основная:
1. Харитонов, Ю.Я. Аналитическая химия (аналитика) / Ю.Я. Харитонов.- М.: Высшая школа, 2001.- Кн. 1.
2. Лекционный материал.
Дополнительная:
1. Харитонов Ю.Я. Практикум (электронный ресурс): учебное пособие/ Ю.Я. Харитонов, В.Ю. Григорьева, 2009.
2. Харитонов Ю.Я. Примеры и задачи по аналитической химии (электронный ресурс): учебное пособие/ Ю.Я. Харитонов, В.Ю. Григорьева, 2009.
3. Основы аналитической химии / под ред. Ю.А. Золотова.- М.: Высшая школа, 1999.- Кн. 1.
4. Основы аналитической химии / под ред. Ю.А. Золотова.- М.: Высшая школа, 1999.- Кн. 2.
5. Государственная фармакопея РФ ХII изд., часть 1, М., НЦЭСМП, М., 2007 г
анятие № 12






