МЕТОДИЧНІ ВКАЗІВКИ
ЩОДО ВИКОНАННЯ РОЗРАХУНКОВИХ РОБІТ
З НАВЧАЛЬНОЇ ДИСЦИПЛІНИ
«ОРГАНІЧНА ХІМІЯ»
ДЛЯ СТУДЕНТІВ ДЕННОЇ ТА ЗАОЧНОЇ ФОРМ НАВЧАННЯ
ЗІ СПЕЦІАЛЬНОСТІ 6.070800 – “ЕКОЛОГІЯ ТА ОХОРОНА НАВКОЛИШНЬОГО СЕРЕДОВИЩА”
КРЕМЕНЧУК 2007
Методичні вказівки щодо виконання розрахункових робіт з навчальної дисципліни «Органічна хімія» для студентів денної та заочної форм навчання зі спеціальності 6.070800 – “Екологія та охорона навколишнього середовища”
Укладачі: доц., к.т.н. Л.А.Бездєнєжних,
асист. Л.М. Корнійко
Рецензент проф., к.б.н. В.В. Никифоров
Кафедра екології
Затверджено методичною радою КДПУ
Протокол № ____ від___________________________ 2007 р.
Заступник голови методичної ради ____________доц. С.А. Сергієнко
ЗМІСТ
Вступ………………………………………………………………………………….4
Розрахункова робота №1……………………………………………………………5
Вуглеводні……………………………………………………………………………5
Галогенопохідні……………………………………………………………………...8
Спирти………………………………………………………………………………..9
Альдегіди та кетони………………………………………………………………..11
Карбонові кислоти, складні ефіри, жири…………………………………………13
Розрахункова робота №2…………………………………………………………..18
Амінокислоти і білки………………………………………………………………18
Вуглеводи…………………………………………………………………………...20
Ароматичні вуглеводні…………………………………………………………….21
Феноли та ароматичні спирти……………………………………………………..23
Полімеризаційні та поліконденсаційні смоли……………………………………25
Багатоядерні ароматичні сполуки…………………………………………………27
Таблиця варіантів…………………………………………………………………..30
Список літератури………………………………………………………………….31
ВСТУП
Студент виконує два завдання, кожне з яких складається з 8 завдань у семестрі. Завдання охоплює органічні сполуки - сполуки з відкритим ланцюгом вуглецевих атомів та карбоциклічні й гетероциклічні сполуки.
Відповіді на питання контрольного завдання слід подати не лише в описовій формі, але й у вигляді формул і хімічних рівнянь. Обов'язково писати структурні формули речовини, а не зображувати останні емпіричними формулами.
Синтези органічних речовин подавати у вигляді схем, над стрілками вказувати реагенти і необхідні умови реакцій (температура, каталізатор).
Під формулами всіх органічних сполук необхідно писати їх назву за міжнародною номенклатурою.
У кінці виконаного контрольного завдання слід навести список використаної літератури.
Номер варіанту контрольного завдання вибирають за останньою цифрою залікової книжки.
РОЗРАХУНКОВА РОБОТА №1
ВУГЛЕВОДНІ
У молекулах насичених вуглеводнів (алканів, парафінів) кожен атом вуглецю витрачає на з’єднання з іншим сусіднім вуглецевим атомом не більше однієї валентності, при цьому всі вільні його валентності насичені воднем. Насичені вуглеводні утворюють гомологічний ряд із загальною формулою СnН2n+2. Необхідно запам’ятати назву і формули перших десяти представників гомологічного ряду насичених вуглеводнів (алканів), засвоїти принцип добудови гомологічного ряду. Цей принцип буде повторюватись при побудові всіх гомологічних рядів. Найважливішою номенклатурою є міжнародна (систематична, ІЮПАК). Також використовують тривіальну (випадкову) назву органічних сполук.
Так, перші чотири члени гомологічного ряду алканів мають тривіальні назви: СН4 – метан; С2Н6 – етан; С3Н8 – пропан; С4Н10 – бутан.
Насичені вуглеводні за нормальних умов малоактивні сполуки. Пояснюється це тим, що всі атоми в молекулах зв’язані між собою  -зв’язками, які є міцними. При підвищеній температурі, опромінюванні, дії активних реагентів вони вступають у реакції.
-зв’язками, які є міцними. При підвищеній температурі, опромінюванні, дії активних реагентів вони вступають у реакції.
Ненасичені вуглеводні (етиленові – алкени, дієнові – алкадієни, ацетиленові – алкіни) мають у молекулах подвійні та потрійні зв’язки між атомами вуглецю (СН2=СН2 – етилен; CН2=СН-СН=СН2 – 1,3-бутадієн; СН≡СН – ацетилен). У зв’язку з цим треба звернути увагу на природу подвійного і потрійного зв’язків. Вуглеводні з такими типами зв’язків мають здатність легко вступати в різні реакції. Етиленові вуглеводні утворюють гомологічний ряд із загальною формулою СnН2n, алкадієни – СnН2n-2, алкіни – СnН2n-2.
| Сl хлорбензол) |
Аліциклічні вуглеводні. Вивчаючи аліциклічні вуглеводні (циклоалкани), необхідно звернути увагу на міцність циклів, які складаються з різної кількості атомів вуглецю (теорія напруги) та залежність властивостей циклоалканів від розміру циклу. До аліциклічних сполук належать терпени. Це особлива група ненасичених вуглеводнів складу С10Н16. Вони входять до складу ефірних олій, скипидару. Вивчаючи терпени, слід звернути увагу на класифікацію. Для кожної з груп терпенів треба знати один-два представника: ациклічні терпени (мірцен, гераніол), моноциклічні (лімонен, ментол), біциклічні (пінен, камфора). У молекулах терпенів один, два або три подвійні зв’язки, різні функціональні групи. Терпени входять до складу ефірних олій укропу, селери, цитрусових, петрушки.
Контрольні завдання
1. Які найбільш прості галогеналкани можуть бути взяті для одержання за
реакцією Вюрца таких вуглеводнів: а) 2,2 диметилпентану; б) 2-метилбутану; в) 2,4 диметилгексану. Напишіть до кожного випадку відповідні рівняння реакцій. Назвіть узяті речовини.
2. Напишіть рівняння реакцій приєднання: а) бромистого водню до
пропилену; б) йодистого водню до триметилетилену; в) водню до 2-бутену.
3. Напишіть рівняння реакцій окиснення перманґанатом калію (р. Вагнера)
таких вуглеводнів: а) етилену; б) 2-бутену; в) 4-метил-1пентену.
Чи може бути окиснення перманґанатом калію якісною реакцією на ненасичений зв’язок?
4. Наведіть схеми полімеризації: а) пропилену; б) ізобутилену, в) етилену.
5. Напишіть рівняння реакцій взаємодії: а) брому з ацетиленом; б) хлору з
2-бутином; в) брому з 1,3-бутадієном. Назвіть одержані сполуки.
6. Напишіть і поясніть реакції гідратації ацетиленових вуглеводнів (р. Кучерова): а) ацетилену; б) пропіну; в) 3-метил-1-бутану. До яких класів належать одержані сполуки?
7. Наведіть рівняння реакцій і умови одержання таких сполук: а) 2,3-диметилбутану за реакцією Вюрца; б) метилацетилену з відповідного дибромпохідного.
8. Напишіть рівняння реакцій і вкажіть умови їх проходження: а) подіяти
металічним натрієм на суміш з йодистого етилу та йодистого ізопропилу;
б) одержати 1-бутен з 1-бутану.
9. Напишіть рівняння реакцій і позначте умови їх проведення: а) одержати
відповідний вуглеводень ацетиленового ряду дією спиртового розчину лугу на 1,1-дихлорбутан; б) одержати 2-метил-пентан з відповідної сполуки етиленового ряду.
10. Наведіть рівняння реакцій одержання вуглеводнів: а) бутану всіма відомими засобами; б) етилену з етилового спирту.
11. Наведіть рівняння таких реакцій: а) взаємодії 2-метилпентану з 1молем хлору; б) взаємодії 2,3 диметилпентину-2 з 1 молем бромводню. Назвіть одержані сполуки.
12. Напишіть рівняння реакцій: а) взаємодії 2 метилбутану з одним молем брому; в) взаємодії пентадієну-1,3 з 1 молем водню. Назвіть одержані сполуки.
13. Напишіть рівняння наступних реакцій: а) взаємодії 2-бутину з водою; б) нітрування ізобутану (р. Коновалова).
14. Напишіть рівняння реакцій: а) сульфування 2-метилпентану; б) взаємодії 3,3 - диметилпентану-1 з одним молем бромводню. Назвіть одержані сполуки.
15. Напишіть рівняння реакцій: а) нітрування 2-метилпентану; б) полімеризації 1,3-бутадіену. Назвіть одержані сполуки.
16. За допомогою яких реактивів і за яких умов можна здійснити
перетворення при а) нітруванні ізобутану; б) окисненні метилбензолу; в) гідратації пропілену. Наведіть відповідні рівняння реакцій і назвіть одержані сполуки.
17. Напишіть рівняння реакцій: а) взаємодії 3-етилпентану з одним молем хлору; б) взаємодії о-ксилолу з перманґанатом калію; а) взаємодії бутену-1,3 з бромистим воднем. Назвіть одержані сполуки.
18. Напишіть рівняння таких реакцій: а) нітрування пропану; б) взаємодії 3,3 - діетилпентену-1 з 1 молем хлору.
19. Напишіть рівняння реакцій: а) взаємодії бутадієну-1,3 з 1 молем
бромистого водню; б) хлорування пропану.
20. Напишіть рівняння реакцій взаємодії: а) 3-метилбутану з 1 молем
хлору; б) пропілену з бромводнем. Назвіть одержані сполуки.
Література: [1, с. 40-47; 2, с. 105; 3, с. 301; 4, с. 50-69].
ГАЛОГЕНОПОХІДНІ
Галогенопохідні вуглеводнів – це продукти заміщення одного або кількох атомів водню в молекулах вуглеводнів атомами фтору, хлору, брому, йоду. Галогенопохідні можна добути для вуглеводнів різного типу: насичених, ненасичених, ароматичних.
Залежно від того, який галоген входить до складу сполуки, розрізняють фтор-, хлор-, бром-, йодпохідні. Існують сполуки, що містять в одній молекулі різні галогени. Приклади: С2Н5F – фторетан; СН2=СНС1 – хлоретилен; С3Н7І – йодпропан;
 -Вr - бромбензол.
-Вr - бромбензол.
Контрольні завдання
21. Напишіть рівняння реакцій взаємодії: а) бромистого водню зпропиленом; б) йодистого водню з триметилетиленом; в) хлористого водню з 1-бутеном. Назвіть одержані сполуки.
22. Напишіть формули всіх можливих монобромпохідних: а) бутану; б) толуолу. Визначте серед одержаних сполук первинні, вторинні, третинні бромпохідні. Назвіть одержані сполуки.
23. Напишіть рівняння реакцій взаємодії з воднем і спиртовим розчином
лугу таких сполук: а) 2-бром-3-метилбутану; б) 3,3-дихлорпропану. Назвіть одержані сполуки.
24. Складіть структурн формули таких галагенопохідних: а) 4,4-дихлорбутану; б) 2-бром-2,3-диметилбутану.
25. Які монобромпохідні утворюються при бромуванні: бензолу, толуолу, 2-метилбутану. Умови: звичайна температура, наявність каталізатора. Назвіть одержані сполуки.
26. Наведіть приклади рівняння полімеризації: а) хлористого вінілу; б) 2-хлор – 1,3-бутадієну. Назвіть одержані сполуки.
27. Наведіть рівняння одержання хлористого вінілу з ацетилену та
етилену.
28. Складіть структурні формули та назвіть монобромпохідні, які можна
одержати при дії брому на такі вуглеводні: а) ізобутан; б) пропілен.
29. Приведіть рівняння одержання пропілену, його взаємодію з бромною
водою і полімеризацію.
30. Наведіть приклади рівняння реакцій взаємодії трет-бутилброміду з
такими сполуками: а) гідроксидом натрію (водний розчин); б) гідроксидом
калію (спиртовий розчин); в) нітратом срібла. Назвіть одержані сполуки.
Література: [1, с. 46-47; 2, с. 120-122; 4, с. 105-117; 5, с. 321-326].
СПИРТИ
Спирти – це похідні вуглеводнів, у молекулах яких один або декілька атомів водню замішується на гідроксогрупу –ОН. Група –ОН є функціональною групою спиртів. За кількістю гідроксильних груп спирти поділяються на одноатомні та багатоатомні. Одноатомні спирти мають загальну формулу R-ОН, де R – вуглеводневий радикал. Розрізняють первинні, вторинні та третинні спирти. Наприклад: СН3-СН2-ОН – первинний спирт (етанол-1)
СН3-СН-СН3 – вторинний спирт (пропанол-2)
│
ОН
СН3
│
СН3- С-СН3 третинний спирт (2-метил-пропанол-2)
│
ОН
Найважливішими представниками багатоатомних спиртів є етиленгліколь та гліцерин.
Контрольні завдання
31. Виведіть формули спиртів С4H10О. Назвіть їх. Зазначте первинні,
вторинні, третинні спирти.
32. Напишіть рівняння реакцій внутрішньомолекулярної та міжмолекулярної дегідратації ізобутилового спирту. Назвіть одержані сполуки.
33. Які сполуки утворюються при взаємодії гліцерину з однією, двома та трьома молекулами азотної кислоти.
34. За допомогою яких реакцій можна відрізнити: а) бутанол-4 від бутанолу-2; б) етиленгліколь від метанолу, в) етанол від 2-метилпропанолу-2? Напишіть рівняння реакцій та назвіть одержані сполуки.
35. Наведіть рівняння реакцій технічних засобів одержання спиртів: метилового, етилового, етиленгліколю, гліцерину.
36. Написати структурні формули таких сполук: а) 2-метилпентанол-1; б) 2,3-диметилбутанол-2; в) 2-пропанол; г) 2-метил-1,2- бутандіол.
37. Якими реакціями можна відрізнити один від одного первинні, вторинні та третинні спирти?
38. Написати всі промислові способи добування етанолу.
39. Написати рівняння реакції ізопропілового спирту з такими реагентами: а) металічним натрієм; б) хлористим воднем; в) оцтовою кислотою (за наявності сірчаної кислоти); г) трихлористим фосфором.
40. Одержіть 2-метил-2-бутанол з допомогою магнійорганічного синтезу. Покажіть хімічні властивості одержаного спирту рівняннями реакції.
Література: [1, с. 47-49; 4, с. 120-143; 5, с. 329-327].
АЛЬДЕГІДИ ТА КЕТОНИ
Альдегіди і кетони мають функціональну групу –С=О− - карбонільну групу. В альдегідах карбонільна група зв’язана з вуглеводневим радикалом і воднем R-С-Н,
║
О
а у кетонів – з двома вуглеводневими радикалами R-С-R.
║
О
Альдегіди і кетони схожі за властивостями, оскільки мають однакову функціональну групу. Альдегіди називають за кількістю атомів вуглецю з закінченням –аль. Часто альдегіди називають за кислотами, в яких вони окислюються (матаналь – мурашиний альдегід, етаналь – оцтовий). Кетони називають за кількістю атомів вуглецю із закінченням –он (пропанон, диметилкетон).
Контрольні завдання
41. Напишіть рівняння реакцій: а) одержання пропіонового альдегіду; б) взаємодію цього альдегіду з аміачним розчином оксиду срібла. Назвіть одержану сполуку. Чому ця реакція є якісною на альдегідну функціональну групу?
42. Напишіть рівняння реакцій: а) окиснення диметилкетону; б) відновлення диметилкетону; в) взаємодії оцтового альдегіду з воднем та фенілгідразином. Назвіть одержані сполуки.
43. Які сполуки утворюються при взаємодії масляного альдегіду з: а) синильною кислотою; б) гідроксидом міді (II) (при нагріванні); в) пентахлоридом фосфору. Наведіть відповідні рівняння реакцій.
44. Наведіть рівняння реакцій альдольної та кротонової конденсацій для таких сполук: а) мурашиного альдегіду; б) оцтового альдегіду; в) диметилкетону. Назвіть одержані сполуки.
45. Поясніть вплив альдегідної функціональної групи на вуглеводневий радикал на прикладі масляного альдегіду. Які атоми водню в цій молекулі найбільш активні? Напишіть відповідні рівняння реакцій. Назвіть одержані сполуки.
46. Наведіть рівняння одержання акролеїнового альдегіду. Які сполуки утворюються при взаємодії його з: а) воднем; б) аміачним розчином оксиду срібла; в) хлором.
47. Написати рівняння реакції в результаті яких можна здійснити перетворення: а) оцтового альдегіду в етандіол; б) ацетату натрію в бутадієн-1,3.
48. Наведіть відповідні рівняння реакцій технічних засобів одержання:
а) формальдегіду; б) оцтового альдегіду; в) ацетону. Де застосовують ці сполуки?
49. Наведіть формулу бензальдегіду. Напишіть рівняння реакцій взаємодії бензальдегіду з: а) аміачним розчином оксиду срібла; б) воднем; в) азотною кислотою. Назвіть одержані сполуки.
50. Які альдегіди утворяться при окисненні таких спиртів: а) 2-метилпропанолу-1; б) 3-метилбутанолу-1; в) 2,2-диметилпропанолу-1? Назвіть одержані сполуки.
Література: [1, с. 46-4750-51; 4, с. 151-169; 5, с. 344-358].
КАРБОНОВІ КИСЛОТИ, СКЛАДНІ ЕФІРИ, ЖИРИ
Карбоновими кислотами називають органічні речовини, до складу яких входить карбоксильна група – СООН. Загальна формула карбонової кислоти – R–СООН. Виділяють насичені (мурашина, оцтова, пропіонова, масляна – одноосновні кислоти; щавлева, малонова, янтарна – двохосновні), ненасичені (акрилова, кротонова, вінілоцтова, олеїнова) та ароматичні (бензойна, саліцилова – одноосновні; фталева, ізофталева – двохосновні) кислоти.
Оксикислоти – органічні карбонові кислоти, які містять, крім карбоксильних груп, одну або декілька гідроксильних груп. Наприклад, молочна кислота СН3СНОН-СООН – одноосновна двохатомна, яблучна НООС-СНОН-СН2-СООН двохосновна трьохатомна, винна НООС-СНОН-СНОН-СООН двохосновна чотириатомна.
Складні ефіри – це речовини, які мають загальну формулу R–С−ОR*,
║
О
де R та R*- вуглеводневі радикали.
Складні ефіри – це похідні кислот, де гідроксильна група замінена на групу – ОR* спирту. За сучасною номенклатурою назву ефіру будують з назви вуглеводневого радикалу, що відповідає спирту, і кореня латинської назви кислоти з додаванням закінчення –ат. Застосовують також назви, які складаються з назв спирту і кислоти, що утворюють ефір.
Наприклад, Н–С−ОС2Н5 – етилформіат (етиловий ефір мурашиної кислоти). ║
О
Жири – різновид класу природних органічних сполук – ліпідів – речовин, що входять до складу тваринних і рослинних тканин. За хімічною будовою жири – складні ефіри гліцерину і вищих карбонових кислот. Їх називають також тригліцеридами.
Загальна формула СН2-О-СО-R1
|
СН-О-СО-R2
|
СН2-О-СО-R3,
де –О-СО-R1, -О-СО-R2, -О-СО-R3 – залишки різних кислот, які можуть бути однаковими.
Мила – солі високомолекулярних кислот (пальмітинової та стеаринової). Наприклад, С17Н35СООNа – стеарат натрію, С15Н31СООК – пальмітат калію.
Контрольні завдання
51. Які карбонові кислоти називають вищими? Наведіть їх формули. Де їх застосовують?
52. Напишіть рівняння реакції взаємодії масляної кислоти з вторинним пропіловим спиртом. Назвіть одержану сполуку. Як називають цю реакцію?
53. Напишіть структурні формули ізомерних оксибензойних кислот складу С7Н3О3. Назвіть їх. Який ізомер зветься саліциловою кислотою. Напишіть рівняння взаємодії саліцилової кислоти з оцтовою кислотою. Назвіть одержані сполуки.
54. Напишіть структурні формули таких сполук: а) галової кислоти; б) молочної кислоти; в) винної кислоти; г) аміду оксимасляної кислоти.
55. Що таке оптична активність сполук? Причина оптичної активності. Який вид ізомерії характерний для оптично активних сполук? Наведіть приклади оптичних ізомерів для  -оксимасляної кислоти.
-оксимасляної кислоти.
56. Напишіть рівняння реакцій взаємодії молочної кислоти з такими реагентами: а) оцтовою кислотою; б) метиловим спиртом; в) NаОН; г) КмnО4. Назвіть одержані сполуки.
57. Напишіть структурні формули кислот: а) лимонної; б) молочної; в) саліцилової. Яка з цих кислот є ароматичною сполукою? Застосування цих кислот.
58. Напишіть рівняння реакцій за схемою: винна кислота  В. Назвіть одержані сполуки. Яке практичне застосування має кінцева сполука?
В. Назвіть одержані сполуки. Яке практичне застосування має кінцева сполука?
59. Напишіть рівняння реакцій, які протікають при нагріванні таких кислот: а) оксиоцтової кислоти; б)  -оксипропіонової кислоти; в)
-оксипропіонової кислоти; в) 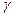 -оксимасляної кислоти; г) саліцилової кислоти; д) галової кислоти. Назвіть одержані сполуки.
-оксимасляної кислоти; г) саліцилової кислоти; д) галової кислоти. Назвіть одержані сполуки.
60. Напишіть рівняння реакцій: а) окиснення  -оксипропіонової кислоти; б) окиснення
-оксипропіонової кислоти; б) окиснення  -оксипропіонової кислоти; в) взаємодії саліцилової кислоти з оцтовою. Назвіть одержані сполуки.
-оксипропіонової кислоти; в) взаємодії саліцилової кислоти з оцтовою. Назвіть одержані сполуки.
61. Використовуючи малоновий ефір та ізопропіловий спирт, синтезуйте ізопропілоцтову кислоту.
62. Яка реакція називається реакцією етерифікації? У чому полягає реакція, обернена етерифікації? За яких умов вона протікає та як називається? Напишіть рівняння реакції одержання таких сполук і назвіть їх:
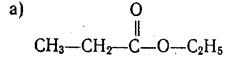 .
.
63. Синтезуйте з допомогою малонового ефіру пропіонову кислоту.
64. Напишіть реакцію добування етилформіату, використовуючи хлорангідрид мурашиної кислоти та етиловий спирт.
65. Напишіть реакцію добування тринітрогліцерину.
66. Що таке реакція омилення? Коли вона відбувається практично необоротно? Напишіть реакцію омилення етилацетату.
67. Добудьте малоновий ефір за допомогою реакції етерифікації. Чи може цей ефір реагувати з металічним натрієм?
68. Напишіть рівняння реакції етерифікації мурашиної кислоти бутанолом-1 і омилення диметилтерефталату.
69. Проведіть реакцію гідрування пропіонетилового ефіру.
70. Грушева есенція являє собою складний ефір оцтової кислоти з ізоаміловим спиртом (3-метилбутанолом-1). Скласти реакцію добування такогоефіру.
71. Жири. Будова жирів. Фізичні властивості жирів. Напишіть рівняння реакцій гідролізу диолестеарину. Назвіть одержані сполуки.
72. Йодне число. Напишіть рівняння реакції взаємодії триолеїну з йодом.
73. Напишіть рівняння утворення змішаного тригліцериду зі стеаринової, олеїнової, ліноленової кислот. Назвіть одержаний тригліцерид. Напишіть рівняння взаємодії цього тригліцериду з гідроксидом натрію.
74. Напишіть рівняння утворення змішаного тригліцериду з гліцерином, 2 молями олеїнової кислоти, І молем стеаринової кислоти. Напишіть рівняння омилення цього триглицериду гідроксидом калію. Яка консистенція мила.
75. Напишіть структурну формулу змішаного триглицериду, утвореного залишками стеаринової, ліноленової та линолевої кислот. Поясніть, від чого залежить фізичний стан жиру. Наведіть рівняння реакції каталітичного гідрування цього тригліцериду. Назвіть одержану сполуку.
76. Напишіть рівняння одержання диолеолинолену та рівняння його гідрування. Яке значення має гідрування жирів?
77. Одержати тригліцерид з гліцерину та линолевої кислоти. Навести рівняння каталітичного гідрування цього тригліцериду. У чому сутність прогоркання жирів.
78. Напишіть рівняння реакцій одержання тригліцеридів: а) дипальмитостеарину; б) триолеїну. Чим ці тригліцериди відрізняються один від одного за фізичними та хімічними властивостями? Наведіть відповідні рівняння реакцій.
79. Одержати змішаний тригліцерид з олеїнової, линолевої та ліноленової кислот. Навести рівняння реакцій гідрування цього жиру.
80. Навести рівняння одержання дипальмитостеарину. Який фізичний стан цього жиру? Написати рівняння реакції гідролізу цього жиру за наявності гідроксиду калію. Який фізичний стан мила?
Література: [1, с. 49, 52-53; 4, с. 143-146, 176-200, 562; 5, с. 342, 358-383].
РОЗРАХУНКОВА РОБОТА №2
АМІНОКИСЛОТИ ТА БІЛКИ
Амінокислоти – це органічні сполуки, до складу яких входять дві функціональні групи: карбоксильна –СООН і аміногрупа –NН2. Назви амінокислот за замісниковою номенклатурою будують з назви кислоти з префіксом аміно-; положення аміногрупи зазначають цифрою звичайно прийнятим способом. Наприклад:
3 2 1
СH3—CH—CООH
|
NH2 2-амінопропанова кислота
Для амінокислот широко поширені раціональні назви. При побудові таких назв вуглецеві атоми молекулярного ланцюга позначають грецькими літерами. Наприклад:
β α
СH3—CH—CООH
|
NH2 α-амінопропіонова кислота (тривіальна назва – гліцин)
Білки – природні полімерні речовини, які складаються із залишків α-амінокислот. Амінокислоти в білках сполучені пептидними зв'язками С-N. До поширених білків належить альбумін (міститься в курячих яйцях), гемоглобін (у крові людини), казеїн (у коров'ячому молоці) та ін.
У будові молекул білків виділяють чотири структури. Деякі білки характеризуються трьома структурами. Первинна структура - певний порядок сполучення залишків α-амінокислот. Основний міжатомний тип зв'язку -пептидний. Вторинна структура - розміщення поліпептидного ланцюга в просторі у вигляді спіралі. Міжатомний тип зв'язку - водневий. Білкові молекули, які мають певне просторове розміщення (третинну структуру), називають глобулами. Під четвертинною структурою білка розуміють просторове розташування самих глобул.
Контрольні завдання
81. Охарактеризувати амінокислотний склад білків. Напишіть структурні формули: а) аланіну; б) фенілаланіну; в) лізину. Привести рівняння одержання діаміну. Який міжатомний тип зв'язку в ньому утворюється.
82. Одержати двома способами  - аланін. Напишіть рівняння реакції взаємодії цієї кислоти з оксидом міді.
- аланін. Напишіть рівняння реакції взаємодії цієї кислоти з оксидом міді.
83. Надати приклади  - амінокислот, які входять до складу білків. Які ізомери (Д чи L рядів) амінокислот утворюються при гідролізі білків. Навести проекційну формулу однієї з
- амінокислот, які входять до складу білків. Які ізомери (Д чи L рядів) амінокислот утворюються при гідролізі білків. Навести проекційну формулу однієї з  -амінокислот.
-амінокислот.
84. Що відбувається з білком, коли на його розчин подіяти фенолом? Які чинники здатні викликати подібні явища? Практичне значення цього процесу.
85. Напишіть рівняння реакцій, які проходять при нагріванні: а)  -аміновалеріанової кислоти; б) гліцину; в)
-аміновалеріанової кислоти; б) гліцину; в) 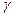 - аміновалеріанової кислоти. Назвіть одержані речовини.
- аміновалеріанової кислоти. Назвіть одержані речовини.
86. Білки. Якісні реакції, які використовуються для ідентифікації білка. Умови їх проведення.
87. Будова білкової молекули. Напишіть утворення поліпептидного ланцюга з амінокислот: гліцину, аланіну, лейцину, цистеїну.
88. Охарактеризувати значення білків як продуктів харчування. Напишіть реакцію добування α-амінопропіонової кислоти.
89. Напишіть рівняння реакцій впливу азотистої кислоти на: а) гліцин: б) аланін; в)  -аміномасляну кислоту. Назвіть сполуки.
-аміномасляну кислоту. Назвіть сполуки.
90. Властивості білків. Чим відрізняється денатурація білків від висолювання. Який чинник викликає кожне з цих явищ?
Література: [1, с. 57; 4, с. 505-516; 5, с. 401-408].
ВУГЛЕВОДИ
Вуглеводи або сахари – речовини, склад яких звичайно виражають формулою Сx(H2O)y, де параметри x, y – більші або дорівнюють трьом. До складу їх молекул входять гідроксильні групи ОН, а також залишки альдегідів (Н-С=О) або кетонів (С=О), тобто вуглеводи є альдегідоспиртами або кетоноспиртами. Відповідно до будови вуглеводи поділяють на три групи: моносахариди (глюкоза, фруктоза) – найпростіші вуглеводи, олігосахариди (сахароза) – продукти конденсації двох або кількох молекул моносахаридів і полісахариди (крохмаль, целюлоза) - продукти конденсації більшої кількості молекул моносахаридів, полімерні вуглеводи.
Контрольні завдання
91. Напишіть  - та
- та  -піранозні форми глюкози. Укажіть, до складу яких вуглеводів входять: а) α-глюкоза; б) β-глюкоза.
-піранозні форми глюкози. Укажіть, до складу яких вуглеводів входять: а) α-глюкоза; б) β-глюкоза.
92. Напишіть структурні формули: а) глюкози; 6) фруктози; в) галактози; г) лактози; д) клітковини. Які з них моносахариди, дисахариди, полісахариди? Які функціональні групи входять до складу кожної сполуки?
93. Глюкоза. Будова молекули. Проаналізуйте хімічні властивості глюкози.
94. У доданій схемі таутомерної рівноваги глюкози замініть назви, проекційними формулами:
 -
- 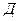 - глюкопіраноза
- глюкопіраноза  глюкоза
глюкоза  -
- 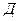 - глюкопіраноза.
- глюкопіраноза.
Як довести наявність альдегідної функціональної групи в глюкозі? Наведіть відповідні рівняння реакцій.
95. Напишіть рівняння реакцій одержання таких сполук: а) озазону глюкози; б) шестиатомного спирту з глюкози; в) метилглюкозиду.
96. У поданій схемі таутомерної рівноваги фруктози замініть назви проекційнимиформулами:  -
- 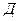 - фруктоза
- фруктоза  фруктоза
фруктоза  -
- 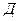 фруктоза. Дайте визначення явища таутомерії.
фруктоза. Дайте визначення явища таутомерії.
97. Напишіть структурні формули: а) глюкози; б) фруктози; в) галактози; г) сахарози; д) крохмалю. Які з цих сполук є моносахаридами, дисахаридами, полісахаридами? Яка реакція лежить в основі класифікації вуглеводнів? Напишіть схему гідролізу крохмалю.
98. Написати рівняння реакції синтезу целюлози, використовуючи формули Хеуорса. Наведіть рівняння реакцій утворення повних складних ефірів целюлози: а) з азотною кислотою; б) з оцтовою кислотою. Практичне використання цих сполук.
99. Для лактози напишіть такі рівняння реакцій: а) гідролізу; б) окиснення Сu(ОН)2; в) утворення глюкозиду.
100. Напишіть структурні формули сахарози та мальтози. Вкажіть різницю в їх будові. Який з цих вуглеводів дає реакцію на альдегідну функціональну групу? Напишіть рівняння.
Література: [4, с. 522-552; 5, с. 383-391].
АРОМАТИЧНІ ВУГЛЕВОДНІ
 Ароматичні вуглеводні – органічні сполуки, до складу яких входять одне або декілька бензольних ядер. Найпростіший представник – бензол С6Н6. У молекулі бензолу немає звичайних простих і подвійних зв’язків
Ароматичні вуглеводні – органічні сполуки, до складу яких входять одне або декілька бензольних ядер. Найпростіший представник – бензол С6Н6. У молекулі бензолу немає звичайних простих і подвійних зв’язків
Усі зв’язки С-С рівноцінні за довжиною і за енергією утворення. Електронна густина в молекулі бензолу розподіляється рівномірно.
Ароматичні вуглеводні мають велике значення при одержанні барвників, полімерів, фармацевтичних препаратів.
Найбільш типовими реакціями бензолу і його гомолога є реакція електрофільного заміщення атомів водню на галоген, нітрогрупу (-N02), сульфогрупу (-SО3Н). У зв’язку з тим, що зв’язки в –СН- бензолу рівноцінні, то реакція заміщення водню може бути у кожного з атомів вуглецю.
За умови введення другого замісника в бензольне кільце, він буде направлятись першим замісником у зазначене положення. З метою вивчення цього питання необхідно знати правило заміщення в бензольному кільці.
Контрольні завдання
101. Наведіть рівняння реакцій і умови одержання бензолу з циклогексану. Приведіть спосіб добування стиролу.
102. Напишіть рівняння реакції та вкажіть умови її проходження: одержання етилбензолу за реакцією Фріделя – Крафтса. Навести схему полімеризації стиролу.
103. Напишіть рівняння реакції та позначте умови її проведення: одержання бензолу з бензолокислого натрію. Напишіть реакцію електрофільного заміщення нафталіну.
104. Наведіть рівняння такої реакцій: нітрування метилбензолу. Назвіть одержані сполуки.
105. Напишіть рівняння реакцій: а) сульфування метилбензолу; б) нітрування бромбензолу. Назвіть одержані сполуки.
106. Напишіть рівняння наступних реакцій: а) сульфування толуолу;
б) бромування нітробензолу.
107. Одержати ксилол з 1,2-дихлорбензолу. Написати реакцію взаємодії толуолу з 1 молем хлору при нагріванні.
108. Напишіть рівняння реакції бензолу з воднем та бромом. Пояснити, чому реакції приєднання у нього відбуваються важче, ніж реакції заміщення. 109. Чи реагує бензол з бромною водою, нітратною кислотою, киснем? Написати рівняння можливих реакцій. Назвати речовини, що утворилися.
110. Напишіть рівняння реакцій: а) між етилбензолом і концентрованою сірчаною кислотою; б) окиснення пара -ксилолу.
Література: [1, с. 60-62; 4, с. 296-333; 5, с. 304-314].






