Величини, що визначають стан газу - тиск р, температуру Т і об'єм V, який займає визначена маса газу - називаються параметрами стану. Параметри не є незалежними, кожен з них є функцією двох інших.
Рівняння, що зв'язує тиск р, температуру Т і об'єм V для даної маси газу називається рівнянням стану, і може бути записане у загальному вигляді:
F (p,V,T)=0.
Тобто, стан газу визначається двома будь-якими параметрами, третій параметр однозначно визначається двома іншими.
Співвідношення
p = nkT, (10)
що поєднує тиск газу з його температурою і концентрацією молекул, отримано для моделі ідеального газу, молекули якого взаємодіють між собою і зі стінками посудини тільки під час пружних зіткнень. Це співвідношення може бути записане в іншій формі, що встановлює зв'язок між макроскопічними параметрами газу – об'ємом V, тиском p, температурою T і кількістю речовини ν.
Якщо в об'ємі V міститься N часток, то 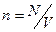 і маємо
і маємо
 (11)
(11)
В це рівняння входять усі три параметри стану, тому воно є рівнянням стану ідеального газу.
Але число N неможливо виміряти безпосередньо, тож його треба замінити на масу газу М, яку досить легко виміряти. Для цього перетворення скористуємось поняттям про моль. Як відомо, моль будь-якої речовини містить одну й ту ж саму кількість молекул (по визначенню), яка дорівнює числу Авогадро NA = 6,02×1023. Число молів речовини в даній масі дорівнює:  , звідси число молекул у даній масі газу
, звідси число молекул у даній масі газу  .
.
Остаточно:
 (12)
(12)
Добуток числа Авогадро NA на сталу Больцмана k називається універсальною газовою сталою і позначається буквою R. Її чисельне значення в СІ є:
R = 8,31 Дж/моль·К.
Співвідношення

 (13)
(13)
вперше було записане Д. І. Менделєєвим.
Для одного моля будь-якого газу воно приймає вигляд:
pV=RT (14)
Це рівняння, що встановлює зв'язок між тиском, об'ємом і температурою 1 молю газу було отримано в середині XIX століття французьким фізиком Б. Клапейроном. Тому рівняння стану газу називається рівнянням Клапейрона–Менделєєва.
Слід зазначити, що задовго до того, як рівняння стану ідеального газу було теоретично отримане на основі молекулярно-кінетичної моделі, закономірності поведінки газів у різних умовах були добре вивчені експериментально. Тому рівняння (13) можна розглядати як узагальнення дослідних фактів, що знаходять пояснення в молекулярно-кінетичній теорії.
Закони ідеального газу
- квазістатичний процес
- діаграма стану
- ізопроцеси
- закон Бойля–Маріотта
- стисливість
- коефіцієнт стисливості
- закон Шарля
- законом Гей-Люссака
- коефіцієнт об’ємного розширення
- закон Авогадро
- закон Дальтона
- парціальний тиск






