При сплавлении диоксида марганца с карбонатом и нитратом калия получается зеленый сплав, растворяющийся в воде с образованием красивого зеленого раствора. Из этого раствора можно выделить темно-зеленые кристаллы манганита калия K2MnO4 - соли марганцовистой кислоты H2MnO4, очень нестойкой даже в растворе.
Реакцию образования манганата калия можно выразить уравнением:

Если раствор манганата оставить стоять на воздухе, то окраска его постепенно изменяется, переходя из зеленой в малиновую, причем образуется темно-бурый осадок. Это объясняется тем, что в водном растворе манганаты самопроизвольно превращаются в соли марганцовой кислоты HMnO4 (перманганаты) с одновременным образованием диоксида марганца. Реакция выражается уравнением

или в ионно-молекулярной форме:

При этой реакции один ион MnO42- окисляет два других таких же иона в ионы MnO4-, а сам восстанавливается, образуя MnO2.
Процесс превращения манганата в перманганат обратим. Поэтому в присутствии избытка гидроксид-ионов зеленый раствор манганата долгое время может сохраняться без изменения. Если же прибавить кислоту, связывающую гидроксид-ионы, зеленая окраска почти мгновенно изменяется на малиновую.
При действии сильных окислителей (например, хлора) на раствор манганата последний полностью превращается в перманганат:

Перманганат калия KMnO4 — наиболее широко применяемая соль марганцовой кислоты. Кристаллизуется он в виде красивых темно-фиолетовых, почти черных призм, умеренно растворимых в воде. Растворы KMnO4 имеют темно-малиновый, а при больших концентрациях — фиолетовый цвет, свойственный ионам MnO4-. Как и все соединения марганца (VII), перманганат калия — сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа (II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т. д.
Вступая в окислительно-восстановительные реакции, KMnO4 (ион MnO4-) может восстанавливаться в различной степени. В зависимости от pH среды продукт восстановления может представлять собою ион Mn2+ (в кислой среде), MnO2 (в нейтральной или в слабощелочной среде) или ион MnO42- (в сильнощелочной среде).
Проиллюстрируем эти три случая реакциями взаимодействия KMnO4 с растворимыми сульфитами. Если к подкисленному серной кислотой фиолетовому раствору KMnO4 прибавить сульфит калия K2SO3, то жидкость становится почти бесцветной, так как образующаяся соль марганца (II) имеет бледно-розовую окраску. Реакция выражается уравнением
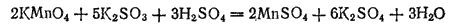
или в ионно-молекулярной форме:

При действии сульфита калия на нейтральный раствор перманганата калия тоже происходит обесцвечивание раствора, но, кроме того, выпадает бурый осадок диоксида марганца и раствор приобретает щелочную реакцию

или в ионно-молекулярной форме:

При большой концентрации щелочи и малом количестве восстановителя образуются ионы манганата согласно уравнению:

Как энергичный окислитель перманганат калия широко применяют в химических лабораториях и производствах; он служит также прекрасным дезинфицирующим средством.
При нагревании в сухом виде перманганат калия уже при температуре около 200°C разлагается согласно уравнению:
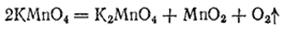
Этой реакцией иногда пользуются в лаборатории для получения кислорода.
Соответствующая перманганатам свободная марганцовая кислота HMnO4 в безводном состоянии не получена и известна только в растворе. Концентрацию ее раствора можно довести до 20%. Это очень сильная кислота, в водном растворе полностью диссоциированная на ионы: ее кажущаяся степень диссоциации в 0,1 н. растворе равна 93%.
Оксид марганца (VII), или марганцовый ангидрид, Mn2O7 может быть получен действием концентрированной серной кислоты на перманганат калия:

Марганцовый ангидрид — зеленовато-бурая маслянистая жидкость. Он очень неустойчив: при нагревании или при соприкосновении с горючими веществами он со взрывом разлагается на диоксид марганца и кислород.






