1. В основе кислотно-основного титрования находится реакция:
1. H++OH 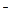 =H2O
=H2O
2. Ag++Cl-= AgCl↓
3.J2+2S2O32-=S4O62-+2J-
4.Ca2++Na2H2Y= Na2CaY+2Н+
2. В процессе кислотно-основного титрования в растворе изменяется (несколько ответов):
1. pH
2. Е;
3. рК;
4. pМе;
5. рТ;
6. СН+;
3. Титрант в кислотно-основном методе титрования (несколько вариантов):
1. Сильное основание
2. Сильная кислота
3. Слабая кислота
4. Сильный восстановитель
5. Комплексон ΙΙΙ
4. Титрант метода кислотно-основного титрования
1. Сильный восстановитель
2. Сильное основание
3. Слабое основание
4. Слабый окислитель
5. Комплексон III
6. Иод
5. Методом кислотно-основного титрования в растворе можно определить
1. NaCl 3. Na2C2O4
2. KNO3 4. K2SO4
6. Ацидиметрически можно оттитровать:
| 1. NaOH,. NH4ОН | 3. НCl | 5. Н2С2О4, FeSO4 |
| 2. NH4Cl, NaCl | 4. СН3СООNa, NaCl | 6. CaCl2, MgCl2 |
7. Задача протолитометрии, решаемая в присутствии индикатора, константа ионизации которого Кi = 1·10–5
| 1. NH4OH + НСl. | 3. NaОН + Н2SO4. |
| 2. НСl + КOH. | 4. NaOH + НСООН. |
8. Задача, решаемая в протолитометрии в присутствии индикатора с Кi=10–4
1. H2C2O4+ NaOH
2. NH4OH +HCl
3. HCOOH + NaOH
4. NH4OH + CH3COOH
9. Фиксирование точки эквивалентности при титровании раствора гидроксида калия раствором серной кислоты в присутствии метилового оранжевого производят при достижении титруемым раствором …… цвета.
1. розового
2. оранжевого
3. красного
4. желтого
10. Формула соли, в водном растворе которой индикатор фенолфталеин приобретает малиновую окраску, имеет вид
1. К2НРО4
2 К2SO4
3 KNO3
4 FeSO4
11. Укажите систему, для которой точка эквивалентности находится
в кислой среде.
| 1. НСl + NaOH. | 2. КОН + Н2SO4. |
| 3. NH4OH + НСl. | 4. NaOH + СН3СООН. |
12. При титровании раствора молочной кислоты раствором NaOH используют индикатор:
1. Фенолфталеин
2. Метиловый оранжевый
3. Эриохромовый черный
4. Дифениламин
Ответ обоснуйте.
13. Выберите титрант и индикатор для определения в растворе CH3COOH:
1. HCl и метиловый оранжевый
2. KOH и метиловый оранжевый
3. Na2B4O7 и фенолфталеин
4. KOH и фенолфталеин
14. При определении концентрации щелочи в растворе методом кислотно-основного титрования в качестве индикатора используется …
1. мурексид
2. фенолфталеин
3. эриохромовый черный
4. дифениламин
15. В чем состоит действие ауксохромных групп?
1. Сообщают окраску.
2. Стабилизируют окраску.
3. Усиливают окраску.
4. Ослабляют окраску.
16. Фиксирование точки эквивалентности при титровании раствора гидроксида калия раствором серной кислоты в присутствии метилового оранжевого производят при достижении титруемым раствором …… цвета.
1. розового
2. оранжевого
3. красного
4. желтого
17. Величина pH в точке эквивалентности больше 7 при титровании…
1. Сильной кислоты сильным основанием
2. Слабой кислоты сильным основанием
3. Сильного основания сильной кислотой
4. Слабого основания сильной кислотой
18. Объем раствора гидроксида натрия с молярной концентрацией эквивалентов 0,1 моль/л, необходимый для нейтрализации 15 мл раствора серной кислоты с молярной концентрацией эквивалентов 0,2 моль/л, равен ________ мл.
1. 45
2. 30
3. 20
4. 15
19. Объем 0,1 моль/дм3 раствора HNO3, необходимый для нейтрализации раствора гидроксида бария, содержащего 0,171 г Ва(ОН)2, равен ____ см3 (ответ с точностью до целого значения)
20. При кислотно-основном титровании 100 мл минеральной воды, содержащей гидрокарбонаты кальция и магния, раствором соляной кислоты с молярной концентрацией эквивалента 0,05 моль/дм3 затрачено 13,90 см3 титранта. Рассчитать массу гидрокарбонат-ионов, содержащуюся в 1 л этого раствора.
21. Рассчитать значение рН в точке эквивалентности при титровании раствором гидроксида натрия раствор уксусной кислоты и выбрать наиболее эффективный индикатор (ответ обосновать).
| 1. Метиловый оранжевый (∆pH = 3,1–4,4) |
| 2. Метиловый красный (∆pH = 4,4–6,2) |
| 3. Бромтимоловый синий (∆pH = 6,0–7,6) |
| 4. Фенолфталеин (∆pH = 8,2–9,8) |
| 5. Тимолфталеин (∆pH = 9,3–10,5) |
22. Рассчитайте массу двуводной щавелевой кислоты в 500 см3 раствора, если на титрование 10,0 см3 этого раствора затрачено 10,5 см3 0,1 моль/дм3 раствора NaOH:
23. Объем раствора серной кислоты с молярной концентрацией эквивалентов 0,05 моль/л, необходимый для нейтрализации 15 мл раствора гидроксида натрия с молярной концентрацией эквивалентов 0,1 моль/л, равен ______ мл (с точностью до точного значения).
24. На титрование 15 см3 раствора гидроксида натрия затрачено 13,5 см3 раствора соляной кислоты с концентрацией эквивалента 0,1 моль/дм3. Рассчитать массу гидрокисда натрия в 1 дм3 этого раствора (ответ записать с точностью до десятых долей).
25. Для нейтрализации 25 мл раствора гидроксида калия с молярной концентрацией эквивалентов 0,2 моль/л требуется ________ мл раствора серной кислоты с молярной концентрацией эквивалентов 0,1 моль/л.
1. 50
2. 100
3. 12,5
4. 25
26. Объем раствора гидроксида натрия с молярной концентрацией эквивалентов 0,1 моль/л, необходимый для нейтрализации 15 мл раствора серной кислоты с молярной концентрацией эквивалентов 0,2 моль/л, равен ________ мл.
1. 45
2. 30
3. 20
4. 15
27. Объем 0,1 М раствора HNO3, необходимый для нейтрализации раствора гидроксида калия, содержащего 0,084 г КОН, равен ________ мл.
1. 84
2. 42
3. 15
4. 150
28. На титрование 25 см3 раствора гидроксида калия затрачено 20 см3 раствора азотной кислоты с молярной концентрацией 0,1 моль/ дм3. Масса щелочи (г) в 500 см3 этого раствора равна
1. 1,12 3. 2,24
2. 5,6 4. 4,48
29. На титрование 20 см3 раствора NaOH израсходовано 25 см3 раствора HCl c молярной концентрацией 0.08 моль/дм3. Масса щелочи в 200 см3 этого раствора равна _____г.
1. 2,4 3. 3,2
2. 0,8 4. 1,6
30. Рассчитать объем раствора серной кислоты с концентрацией эквивалента 0,2 моль/дм3, затраченный на титрование 20 см3 раствора гидроксида калия с концентрацией 0,15 моль/дм3 (с точностью до точного значения).






