Общие
1. Концентрация карбоната кальция в его насыщенном растворе составляет _____ моль/дм3 (ПРСаСО3= 4,9∙10–9)
1. 4,9∙10–9 3. 9,8∙10–9
2. 3,5∙10–5 4. 7,0∙10–5
2. Концентрация сульфата бария в его насыщенном растворе составляет____ моль/дм3. 
1. 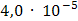 3.
3. 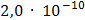
2.  4.
4. 
3. Наименьшей растворимостью (моль/л) обладает карбонат двухвалентного металла, значение произведения которого равно
1. 3,8∙10-9
2. 1,8∙10-11
3. 4,0∙10-10
4. 7,5∙10-14
4. Формула вещества, 0,01 М раствор которого характеризуется наибольшим значением рН, имеет вид
1. Fe(OH)2
2. NaOH
3. NaHCO3
4. Na2SO4
5. Формула вещества, 0,1 М раствор которого характеризуется наименьшим значением рН, имеет вид
1. H2СO3 3. НCl
2. H2S 4. Nа2НРO4
6. Для 0,1 моль/дм3 раствора HCOOH рН составляет
1. 2,88 3. 1,38
2. 2,38 4. 1,0
7. Значение рН 0,001 М раствора азотной кислоты (a = 1), равно……
1. 1
2. 2
3. 0
4. 3
8. Для поддержания рН > 9 применяется буферная смесь:
1. CH3COOH + CH3COONa
2. NH4OH + NH4Cl
3. HCOOH + HCOONa
4. C6H5OH + C6H5OO NH4
9. При разбавлении ацетатного буферного раствора значение величины рН…….
1. увеличится в 2 раза
2. уменьшится в 2 раза
3. уменьшится на 2
4. не изменяется
10. Аммонийный буферный раствор (укажите формулу) предназначен для поддержания:
1. рН=0 3. рН<7
2. рН>7 4. рН=7
Посуда и приготовление растворов
1. Укажите ошибку при подготовке бюретки к работе
1. Закрепили в штативе
2. Ополоснули анализируемым раствором
3. «Носик» бюретки заполнили титрантом
4. Объем титранта установили на нулевой отметке
2. Укажите ошибки при работе с пипеткой (несколько ответов):
1. Отмыли от жира
2. Ополоснули титрантом
3. Выдули оставшуюся в ней каплю жидкости
4. По окончании работы промыли и поставили в штатив
3. Для отбора пробы анализируемого раствора используют
1. Бюретку 3. Капельную пипетку
2. Пипетку Мора 4. Мензурку
4. Точную мерную посуду применяют для … (несколько ответов):
| 1. приготовления рабочих растворов |
| 2. приготовления стандартных растворов |
| 3. отбора пробы исследуемого раствора |
| 4. добавления растворов индикаторов |
| 5. измерения объема растворов титрантов |
5. Посуда, которая ополаскивается перед титрованием титруемым раствором
| 1. мерная колба. | 4. мерная пипетка. |
| 2. колба для титрования. | 5. мерный цилиндр. |
| 3. бюретка. | 6. химический стакан |
6. Укажите вещества по точной навеске которых можно приготовить стандартный раствор (несколько вариантов):
1. CH3COOH
2. NaOH
3. HCl 
4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
7. Вещества по точной навеске которых можно приготовить стандартный раствор:
| 1. CH3COOH | 4. H2C2O4·2H2O |
| 2. NaOH | 5. K2Cr2O7 |
| 3. HCl | 6. MgSO4 |
8. Укажите весы и мерную посуду для приготовления стандартного раствора.
1. Технические весы, мерный цилиндр.
2. Аналитические весы, мерный цилиндр.
3. Аналитические весы, мерная колба.
4. Технические весы, мерная колба.
9. Химическая посуда для разбавления 0,2000 моль/дм3 раствора Н2С2O4
| 1. мерный цилиндр | 2. мерная пипетка |
| 3. коническая колба | 4. бюретка |
| 5. мерная колба | 6. химический стакан |
10. Способ приготовления раствора гидроксида натрия:
Необходимый объем концентрированного раствора
1. отмерить мерным цилиндром, поместить в мерную колбу и довести раствор до метки дистиллированной водой.
2. мерной пробиркой перенести в мерный цилиндр и добавить дистиллированную воду до требуемого объема.
3. пипеткой перенести в мерную колбу и довести объем раствора до метки дистиллированной водой.
4. пипеткой перенести в мерный цилиндр и добавить дистиллированную воду до требуемого объема.
11. Титр это концентрация, показывающая сколько…
1. …миллиграммов вещества, содержащееся в 1 дм3 раствора.
1.... граммов вещества, содержащееся в 1 дм3 раствора.
2. …граммов вещества, содержащееся в 1 см3 раствора.
3. …граммов вещества, содержащееся в 100 г раствора.
12. Масса нитрата натрия, необходимая для приготовления 400 см3 раствора с молярной концентрацией вещества 0,5 моль/дм3, составляет ____г (с точностью до целого значения)
1. 15 3. 68
2. 34 4. 17
13. Рассчитайте титр (г/см3) раствора безводной щавелевой кислоты с молярной концентрацией эквивалента 0,0100 моль/дм3.
| 1. 4,5·10–2. | 3. 9,0·10–3. |
| 2. 4,5·10–4. | 4. 9,0·10–4. |
14. Массовая доля сульфата меди в растворе, полученном при растворении 50 г СuSO4 в 200 г воды, составляет ____% (с точностью до целого значения)
1. 20 3. 10
2. 15 4. 25
15. Масса медного купороса CuSO4∙5H2O, необходимая для приготовления 500 г раствора с массовой долей сульфата меди 16% равна….
1. 150
2. 50
3. 125
4. 160
16. Укажите вместимость (см3) мерной колбы для приготовления из фиксанала. раствора I2 с молярной концентрацией эквивалента 0,05 моль/дм3.
| 1. 200. | 3. 50. |
| 2. 2000. | 4. 1000. |
17. Навеску гидроксида калия массой 28 г растворили и разбавили водой до объема 250 мл. Молярная концентрация эквивалентов КОН в полученном растворе составляет ________ моль/л. (с точностью до целого значения)
1. 2
2. 1
3. 3
4. 4
18. Масса медного купороса, необходимая для приготовления 2 л 0,1 М раствора сульфата меди (II), составляет ________ г.
1. 32
2. 50
3. 25
4. 16
19. Какой объем воды (см3) необходимо добавить к 20 см3 0,1 моль/дм3 раствора уксусной кислоты, чтобы получить 0,05 моль/дм3 раствор?
| 17. 10. | 19. 15. |
| 18. 20. | 20. 40. |
20. Рассчитайте навеску (m, г) NaCl, необходимую для приготовления 500 см3 0,1 моль/дм3 раствора.
21. Рассчитайте титр раствора щавелевой кислоты с молярной концентрацией эквивалента 0,05 моль/дм3.
22. Масса гидроксида калия, содержащего в 10 л его раствора, значение рН которого равно 11, составляет __________ г (a = 1).
1. 0,56
2. 0,28
3. 0,112
4. 0,56
23. Масса азотной кислоты, содержащаяся в 5 л ее раствора, значение рН которого равно 3, составляет __________ г (a = 1).
1. 0,126
2. 0,315
3. 0,063
4. 0,56
24. Масса кристаллогидрата (Na2CO3 ·10Н2О), необходимая для приготовления 500 г раствора карбоната натрия с массовой долей растворенного вещества 10,6%, составляет _________ г.
1. 286
2. 106
3. 143
4. 212
25. Раствор гидроксида бария массой 200 г и массовой долей растворенного вещества 17,1 % разбавили водой до объема 400 мл. Молярная концентрация эквивалентов Ва(ОН)2 в полученном растворе составляет ________ моль/л.
1. 2
2. 0,1
3. 0,5
4. 1
Титрование (общие)
1. Точка эквивалентности – это такой момент в процессе титрования, когда:
1. Индикатор поменял окраску;
2. Титрант и титруемое вещество прореагировали между собой в эквивалентных количествах;
3. Вещества прореагировали между собой в равных количествах;
4. Число моль – эквивалентов титранта и титруемого вещества обратно пропорционально;
2. Кривые титрования строятся для:
1. определения концентрации титранта;
2. определения объема титранта;
3. выбора индикатора;
3. установления области скачка;
3. Укажите соответствие между титриметрическим методом анализа и координатами кривой титрования
1. Осадительное титрование
2. Комплексонометрия
3. Кислотно-основное титрование
4. Редоксиметрия
5. рН - Vтитранта
6. Е - Vтитранта
7. рМе - Vтитранта
8. рCl - Vтитранта
4. Укажите соответствие между титриметрическим методом анализа и реакцией, находящейся в его основе:
1. Кислотно-основной
2. Редоксиметрический
3. Комплексонометрический
4. Осадительный
5. Ме2++Cl-= МеCl↓
6. Red1+Ox2=Ox1+ Red2
7. Ме2++Na2H2Y=Na2МеY+2H+
8. H++OH 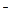 =H2О
=H2О
5. Соответствие метода, индикатора и изменения цвета титруемого раствора при фиксировании точки эквивалентности:
| 1. Алкалиметрия | 1. Эриохромовый черный Т | 1. Желтый – красный | ||
| 2. Комплексонометрия | 2. Метиловый оранжевый | 2. Бесцветный – розовый | ||
| 3. Перманганатометрия | 3. Безиндикаторное титрование | 3. Белый – кирпично-красный | ||
| 4. Метод Мора | 4. Крахмал | 4. Бесцветный – розовый | ||
| 5. Ацидиметрия | 5. Фенолфталеин | 5. Винно-красный – синий |
6. Соответствие метода, титранта и стандартного вещества:
| 1. Алкалиметрия | 1. HCl | 1. K2Cr2O7 | ||
| 2. Комплексонометрия | 2. NaOH | 2. K2CrO4 | ||
| 3. Иодометрия | 3. AgNO3 | 3. Na2B4O7 | ||
| 4. Метод Мора | 4. Na2S2O3 | 4. H2C2O4 | ||
| 5. Ацидиметрия | 5. Na2H2Y | 5. NaCl |






